超声引导胸椎旁神经阻滞复合全身麻醉对胸腔镜肺癌根治术患者术中镇痛药物使用量及氧化应激反应的影响
2020-02-22陈中刚陈林谭志敏
陈中刚,陈林,谭志敏
(南方医科大学深圳医院麻醉科,广东 深圳 518101)
目前,临床对于肺癌患者主要采用手术根治,结合放化疗治疗。胸腔镜肺癌根治术具有切口小且术后恢复快等优点,但由于手术镇痛效果不佳,患者术后早期疼痛刺激剧烈,造成术后氧化应激反应异常,进而延缓疾病恢复[1]。有研究指出,围手术期麻醉管理与镇痛效果直接影响患者术后预后情况,全身麻醉是肺癌手术常规麻醉方式,主要应用阿片类镇痛药物,但临床发现无法有效阻断手术部位刺激引发的应激反应,同时患者术后极易出现恶心呕吐、嗜睡等各种不良反应,影响预后效果[2]。胸椎旁神经阻滞复合全身麻醉主要通过对位于椎间孔旁的脊神经旁局部注射麻醉药物,以阻滞感觉、运动及交感神经,发挥良好麻醉与镇痛功效[3]。对此,本次研究旨在应用超声引导胸椎旁神经阻滞复合全身麻醉对胸腔镜肺癌根治术患者术中镇痛药物使用量及氧化应激反应的影响进行探索,现将具体结果报道如下。
1 资料与方法
1.1 临床资料
1.1.1一般资料 选取2019年3月~2020年3月期间于我院行胸腔镜肺癌根治术的110例患者为研究对象,按照随机数表法分为研究组与对照组,每组各55例。两组患者一般临床资料比较,无统计学意义(P均>0.05),具有可比性,见表1。
表1 两组患者一般资料比较
1.1.2入组标准 符合非小细胞肺癌诊断标准[4];均为单个肿瘤病灶,且最长径<5 cm;年龄18~75岁;美国麻醉医师学会分级(ASA)[5]:Ⅰ~Ⅱ级;对研究知情且自愿参与,并签署知情同意书者。
1.1.3排除标准 合并其他严重器官功能障碍者;伴有其他肺部疾病者;经影像学检查存在远处转移者;精神异常或意识模糊。
1.1.4中止与脱落标准 入组后存在不符合纳入标准或未根据研究方案进行试验的病例,予以剔除;入组后出现严重不良事件或并发症,无法继续接受试验者;受试者失访、中途自行退出或未完成全部试验过程,影响疗效判断,均视为脱落。
1.2 方法
两组患者进入手术室后常规监测心率、血压及血氧饱和度。
1.2.1对照组 麻醉诱导使用长托宁0.5 mg、依托咪酯0.3 mg/kg、舒芬太尼0.4 μg/kg、顺苯磺酸阿曲库铵0.2 mg/kg。经口插入双腔支气管导管,行单肺容量控制通气,呼气末二氧化碳参数保持在35~45 mmHg,且脑电双频指数稳定在40~60。间断使用顺苯磺酸阿曲库铵0.03~0.06 mg/kg,持续泵入瑞芬太尼、丙泊酚,并吸入七氟烷,稳定呼吸循环状态。手术结束前30 min,予以酮咯酸氨丁三醇30 mg镇痛,加以盐酸雷莫司琼0.3 mg止吐,关闭胸腔前停止输注丙泊酚及瑞芬太尼。镇痛泵采用300 mg氟比洛芬酯、10 mg托烷司琼加入100 mL盐水中,术后持续泵注48 h。
1.2.2研究组 在对照组基础上联合超声引导胸椎旁神经阻滞,在全麻后协助患者取侧卧位,选择凸阵探头,频率4Mz,当最低肺泡有效浓度达到0.8时,在超声引导下行胸椎旁神经阻滞。根据术中手术切口位置选取T4或T5下缘脊柱旁2~3cm,沿脊柱平行纵切面,观察弓背弯曲两横突处,确定胸膜位置,观察该部位亮影伴随呼吸活动上下摆动。使用平面外进针技术,确定位置后回抽无气体与血液,之后注入2 mL盐水,同时观察胸膜亮影下移与黑色暗区拓宽,注入0.3%罗哌卡因10~15 mL,在T8处采用同样方式注入5~10 mL,2处注入罗哌卡因剂量总计为100 mg,操作结束后10 min开始手术。
1.3 氧化应激反应检测
术前及术后24 h时,分别采集患者空腹静脉血4 mL,使用硫代硫酸巴比妥法测定丙二醛(MDA)数值,应用黄嘌呤氧化酶法检测超氧化物歧化酶(SOD)水平。
1.4 术后疼痛程度评估标准
在术后2 h(T1)、术后12 h(T2)、术后24 h(T3)、术后48 h(T4),两组患者分别采用视觉模拟评分量表(VAS)[6]进行评估,分值0~10分,0分表示无疼痛;<3分表示有轻微疼痛,但可以忍受;4~6分表示疼痛感显著,但能够忍受;7~10分表示疼痛感剧烈,且无法忍受。分数越高表示患者疼痛程度越强。
1.5 观察指标
比较两组患者镇痛药物使用情况(术后瑞芬太尼用量、术后静脉自控泵按压次数)评估差异;比较T1、T2、T3、T4,两组患者术后疼痛程度(VAS)评估变化;比较术后7d内,两组患者术后不良反应(恶心、呕吐、嗜睡)发生情况差异;比较术前及术后24 h,两组患者氧化应激反应(MDA、SOD)水平变化。
1.6 统计学方法
采用统计学软件SPSS19.0分析数据,计数资料以百分率表示,采用χ2检验,计量资料以均数±标准差表示,组间同一时间比较采用独立样本t检验,组内不同时间比较采用配对t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者镇痛药物使用情况评估比较
两组患者均观察至试验结束,均无脱组或剔除病例。研究组患者术中瑞芬太尼用量明显少于对照组(P<0.05),术后24 h内、48 h内,研究组患者术后静脉自控泵按压次数明显少于对照组(P<0.05),见表2。
表2 两组患者镇痛药物使用情况评估比较
2.2 两组患者术后疼痛程度评估比较
T1、T2、T3时,研究组患者VAS评分均明显低于对照组(P<0.05),而T4时两组患者VAS评分比较无统计学意义(P>0.05),见表3。
表3 两组患者术后疼痛程度评估比较分)
2.3 两组患者术后不良反应发生率比较
术后7 d内,两组患者恶心、呕吐发生率比较无统计学意义(P>0.05),而研究组患者嗜睡发生率明显低于对照组(P<0.05),见表4。
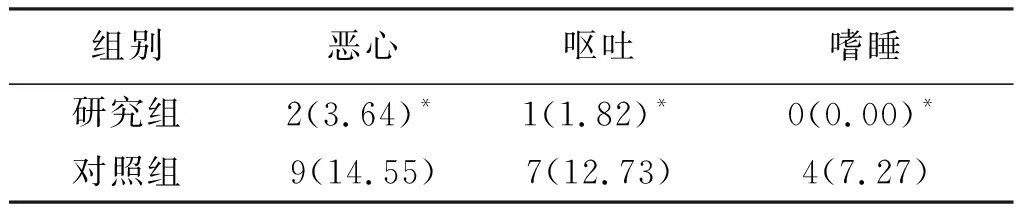
表4 两组患者术后不良反应发生率比较[n(%),n=55]
2.4 两组患者氧化应激反应评估比较
术后24h时,研究组MDA水平与术前比较无统计学意义(P>0.05),而对照组较术前显著升高(P<0.05),研究组明显低于于同一时间对照组(P<0.05);两组患者SOD水平较术前显著降低(P<0.05),且研究组明显低于同一时间对照组(P<0.05),见表5。
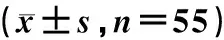
表5 两组患者氧化应激反应评估比较
3 讨论
传统肺癌手术麻醉方式主要以全身麻醉为主,多采用阿片类药物予以镇痛,但术后实行动态镇痛效果不佳,并且会引发多种不良反应[7]。本研究中,采用神经刺激器引导下行T4~T5椎旁神经阻滞麻醉,观察肋间肌收缩运动,同时使用0.3%罗哌卡因10~15ml进行胸椎旁神经组织麻醉,由于该药物属于一种长效酰胺类局部麻醉药物,因此作用于外周神经时效较长,延长阻滞持续时间,能阻断分离感觉与运动神经,具有起效快、可控性强且毒性较低等优势[8]。此外,疼痛刺激会导致下丘脑-垂体-肾上腺皮质轴功能兴奋,造成糖皮质激素与炎性细胞因子释放增加,作用于中枢神经系统与大脑海马区,造成患者出现嗜睡等现象[9]。本次研究也证实研究组患者术后嗜睡发生率明显低于对照组,猜测与胸椎旁神经阻滞的镇痛效果良好相关,利于降低患者术后嗜睡等并发症发生风险,提高治疗安全性。
临床发现由于胸椎旁组织操作较硬膜外更为复杂,常以人体形态学测量与间接方式等确定椎旁间隙部位,导致成功率较低。然而近年来,伴随着超声技术不断进展,超声引导下区域阻滞麻醉得到广泛应用,操作者可直接借助超声引导,为其提供实时画面,准确预测进针深度,确定穿刺部位,因此,超声引导下椎旁神经阻滞更具临床可行性[10]。本研究结果显示,研究组患者术后疼痛程度明显低于对照组,且患者术后及术后镇痛药物用量明显少于对照组。主要原因在于胸椎旁神经阻滞主要将局麻药物注射至胸椎旁间隙,由于该部位位于椎间孔脊神经处,前后支包含感觉与运动神经纤维,故而在椎旁间隙局部注射麻醉药物,以达到同侧相邻多节段躯体与交感神经的阻滞效果,最终发挥良好镇痛效果[11]。另外,在手术过程中麻醉药物联合使用情况下,氧化应激反应因机体受到手术等刺激后,神经内分泌发生过度活动,产生大量氧自由基,损伤生物分子氧化,造成细胞死亡或受损。其中,MDA由氧化应激产生,具有较大毒性,并能直接反映细胞受自由基损伤状况;SOD作为一种天然氧自由基清除剂,可对自由基产生一定清除作用,使得研究组患者MDA水平变化幅度较小,SOD水平较术前降低,且明显低于同一时间对照组[12]。说明,超声引导胸椎旁神经阻滞复合全身麻醉有效控制胸腔镜肺癌根治术患者术后疼痛而引发的应激反应。
综上所述,超声引导胸椎旁神经阻滞复合全身麻醉应用于胸腔镜肺癌根治术,可有效控制镇痛药物用药剂量,缓解患者术后疼痛感与氧化应激反应异常状态,降低术后并发症发生风险。
