老年急性缺血性脑卒中后抑郁患者睡眠障碍现状及与血清IL-1、IL-2、5-HT和Hypocretin的相关性
2020-02-12祝善尧葛伟张欢陈贵海
祝善尧 葛伟 张欢 陈贵海
(安徽医科大学附属巢湖医院 1神经内科,安徽 合肥 238000;2睡眠障碍科)
脑卒中后抑郁(PSD)是脑卒中后常见并发症,对脑卒中后神经功能恢复、康复和生活质量有显著负面影响,约1/3脑卒中患者可发生PSD〔1〕,睡眠障碍是PSD患者最常见、严重影响患者生活质量的并发症之一。PSD睡眠障碍发病机制尚无定论,目前研究认为代谢障碍、炎性反应、神经递质功能失调等是PSD睡眠障碍的可能因素〔2〕。白细胞介素(IL)-1、IL-2等细胞因子可调节机体炎性反应和免疫状态,对神经递质分泌合成、生理代谢等可产生明显影响,在非器质性抑郁症、缺血性脑疾病等发病机制中有重要地位〔3〕。5-羟色胺(HT)、下丘脑外侧区分泌素(Hypocretin)是大脑重要神经递质,5-HT在抗抑郁、睡眠调节中均有重要作用,Hypocretin可调控清醒和快速眼球运动(REM)睡眠〔4〕。目前少有IL-1、IL-2、5-HT和Hypocretin与PSD睡眠障碍的相关性研究,IL-1、IL-2、5-HT和Hypocretin在PSD睡眠障碍发生、发展中机制尚不清楚,本研究在分析PSD患者睡眠障碍现状的基础上,探讨IL-1、IL-2、5-HT、Hypocretin与PSD睡眠障碍的关联性。
1 资料与方法
1.1一般资料 纳入标准:①经颅脑CT或磁共振成像(MRI)证实一侧脑组织受损,首次诊断脑卒中,符合2014年中国急性缺血性脑卒中诊断标准〔5〕;②符合《中国精神障碍分类与诊断标准》中抑郁诊断标准〔6〕,汉密尔顿抑郁量表(HAMD)评分≥7分;③年龄≥60周岁;④发病时间<1年;⑤认知功能正常、无交流障碍,能完成量表测评;⑥患者及其家属知情同意并签署同意书。排除标准:①发病前既已存在抑郁症和睡眠疾病;②合并肿瘤、感染、心肺肾等器官衰竭患者;③严重精神性疾病患者;④认知障碍、失语、视觉障碍、无法配合完成量表评估患者;⑤研究期间服用抗抑郁药物患者;⑥抵触本研究者。选择2016年7月至2018年12月安徽医科大学附属巢湖医院住院部收治的脑卒中患者共152例,根据是否发生PSD将患者分为PSD组和非(N)PSD组,另选择60例门诊体检老年人为健康对照组,均排除急性缺血性/出血性脑卒中和抑郁的可能。本研究获得医院伦理会批准,严格遵循伦理学原则,患者均知情并自愿加入本研究,签署知情同意书,诊疗过程中保证患者隐私和安全。
1.2临床资料收集 登记患者个人资料如:性别、年龄、基础疾病(高血压、糖尿病、冠心病、打鼾史、吸烟、饮酒等),测量身高、体重,计算体重指数(BMI),测量颈围。记录患者美国国立研究院脑卒中评定量表(NIHSS)评分、改良RANKIN量表(MRS)评分、HAMD评分、改良Barthel指数(MBI)评分。
1.3研究方法
1.3.1抑郁程度评估 由专业评定人员应用HAMD量表对PSD患者进行抑郁程度评价,共17项,得分0~54分,分数越高表示抑郁程度越重,其中HAMD 评分<7分为正常,7~17分为轻度抑郁,18~24为中度抑郁,>24分为重度抑郁〔7〕。
1.3.2多导睡眠(PSG)监测 监测前1 d禁用镇静药物、含酒精、咖啡、浓茶等饮料,监测当天不午休,使用美国德邦PSG监测仪进行夜间7 h以上睡眠监测,记录口鼻气流、眼动图、脑电图、肌电图、心电图、鼾声指数、血氧饱和度、胸腹动、睡眠结构、睡眠呼吸功能等。经电脑自动分析后统计相关数据,专业睡眠呼吸医师人工分析修正后记录睡眠全程,分为睡眠潜伏期、REM潜伏期、REM-1、REM-2、REM-3期、REM期,计算睡眠效率(REM-1、REM-2、REM-3期、REM期占总睡眠时长的百分比)。
1.3.3匹兹堡睡眠质量指数(PSQI)量表〔8〕该量表从睡眠质量(1分较好,2分较差,3分很差)、入睡时间(0分≤15 min,1分16~30 min,2分31~60 min)、睡眠时间(0分≥7 h,1分>6 h且<7 h;2分>5 h且≤6 h,3分≤5 h)、睡眠效率(睡眠效率=睡眠时间/床上时间×100.00%,0分睡眠效率≥85.00%,1分睡眠效率75.00%~84.00%,2分睡眠效率66.00%~74.00%,3分睡眠效率≤65.00%)、睡眠障碍(0分无,1分1次/w,2分2次/w,3分1 w≥3次)、催眠药物(0分无,1分1次/w,2分2次/w,3分1 w≥3次)、日间功能障碍(0分无,1分偶尔,2分有时,3分经常)评定患者睡眠质量,分数0~21分,分数越高代表睡眠质量越差。PSQI量表重测信度0.994,7个维度的Cronbach α系数为0.832〔9〕。根据文献〔10〕标准将PSQI≥7分定义为睡眠障碍,PSQI 7~14分为轻度睡眠障碍、PSQI>14分为严重睡眠障碍。
1.3.4临床样本采集与检测方法 患者于入院后次日清晨空腹抽取静脉血(对照组于体检当日上午采血)5~10 ml,分别注入枸橼酸钠抗凝真空采血管。经离心分离血清后置于-70℃ DW-86L386型超低温冰箱(青岛海尔医用低温科技有限公司)保存,24~48 h上机测定。Elx800酶标仪(美国BioTek公司)采用酶联免疫吸附试验检测IL-1、IL-2、5-HT、Hypocretin水平,试剂盒购自深圳迈瑞生物医疗公司。室内质控数据均在控,实验检测严格按照检验科标准作业程序(SOP)文件进行。
1.4统计学分析 采用SPSS25.0软件进行单因素方差分析、LSD-t检验、独立样本t检验、Kruskal WallisH检验、Logistic多重线性回归分析。
2 结 果
2.1基线资料比较 152例脑卒中患者中PSD组69例,NPSD组83例,3组性别、年龄、BMI、合并糖尿病、高脂血症、冠心病、打鼾史,饮酒史均无统计学差异(P>0.05),PSD组和NPSD组颈围、合并高血压、吸烟史、睡眠障碍发生率与对照组比较差异均有统计学意义(P<0.05)。PSD组睡眠障碍发生率、NIHSS评分、MRS评分、HAMD评分显著高于NPSD组(P<0.05),MBI评分显著低于对照组(P<0.05),见表1。
2.2PSQI评估结果 PSD组睡眠质量、入睡时间、睡眠时间、睡眠效率、睡眠障碍、催眠药物、日间功能障碍评分均显著高于NPSD组和对照组(P<0.05),NPSD组显著高于对照组(P<0.05)。PSD组不同抑郁程度患者睡眠质量、入睡时间、睡眠时间、睡眠效率、睡眠障碍、催眠药物、日间功能障碍评分差异显著(P<0.05),重度抑郁组最高,其次是中度抑郁组和轻度抑郁组,各组间差异具有统计学意义(P<0.05),见表2。
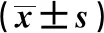
表1 3组基线资料比较
与对照组比较:1)P<0.05;与PSD组比较:2)P<0.05

表2 各组PSQI评分比较分)
与对照组比较:1)P<0.05;与NPSD组比较:2)P<0.05;与轻度抑郁组比较:3)P<0.05;与中度抑郁组比较:4)P<0.05;表3同
2.3PSG检测结果 PSD组总睡眠时长显著短于NPSD组和对照组(P<0.05),睡眠潜伏期、REM潜伏期、REM-1期睡眠效率显著长于NPSD组和对照组(P<0.05),REM-2期、REM-3期、REM期睡眠效率显著短于NPSD组和对照组(P<0.05),NPSD组睡眠潜伏期、REM-1期睡眠效率显著高于对照组(P<0.05),REM-2期、REM-3期、REM期睡眠效率显著低于对照组(P<0.05),总睡眠时长、REM潜伏期与对照组无统计学差异(P>0.05)。PSD组不同抑郁程度患者睡眠潜伏期、REM潜伏期、睡眠效率差异显著(P<0.05),重度抑郁组总睡眠时长显著短于轻度抑郁组(P<0.05),与中度抑郁组之间无统计学差异(P>0.05);重度抑郁组睡眠潜伏期、REM潜伏期、REM-1期占睡眠效率最长,其次是中度抑郁组和轻度抑郁组,各组间差异具有统计学意义(P<0.05);重度抑郁组REM-2期、REM-3期、REM期睡眠效率最短,其次是中度抑郁组和轻度抑郁组,各组间差异具有统计学意义(P<0.05),见表3。
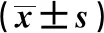
表3 各组PSG检测对比结果
2.4血清IL-1、IL-2、5-HT、Hypocretin比较 PSD组血清IL-1、IL-2、Hypocretin显著高于NPSD组和对照组(P<0.05),NPSD组显著高于对照组(P<0.05),PSD组5-HT显著低于NPSD组和对照组(P<0.05),NPSD组显著低于对照组(P<0.05)。PSD组不同睡眠状态组血清IL-1、IL-2、5-HT、Hypocretin水平差异显著(P<0.05),严重睡眠障碍组血清IL-1、IL-2、Hypocretin水平最高,其次是轻度睡眠障碍组和睡眠正常组,各组间差异具有统计学意义(P<0.05),严重睡眠障碍组血清5-HT水平最低,其次是轻度睡眠障碍组和睡眠正常组,各组间差异具有统计学意义(P<0.05),见表4。
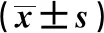
表4 各组血清IL-1、IL-2、5-HT、Hypocretin比较
与对照组比较:1)P<0.05;与NPSD组比较:2)P<0.05;与睡眠正常组比较:3)P<0.05;与轻度睡眠障碍组比较:4)P<0.05
2.5影响PSD患者睡眠障碍的因素分析 以PSD患者是否患有睡眠障碍为因变量(0=否,1=是),以HAMD评分、NIHSS评分、MRS评分、MBI评分、IL-1、IL-2、5-HT、Hypocretin为应变量进行多重线性回归分析,逐步法排除无关变量(P>0.05),最终HAMD评分、5-HT、Hypocretin、IL-1、IL-2均与PSD睡眠障碍的发生独立相关,见表5。

表5 影响PSD患者睡眠障碍的回归分析结果
3 讨 论
20.00%~40.00%脑卒中患者伴有睡眠-觉醒障碍,脑卒中可损害睡眠-觉醒神经结构引起器质性睡眠增多〔11〕。相关研究发现脑卒中后患者可出现睡眠时间延长、觉醒度降低和睡眠结构紊乱,即便在脑卒中后1年神经功能逐渐恢复后睡眠结构仍有异常〔12〕。PSD是脑卒中后常见并发症,患者多出现消极情绪、兴趣索然、悲观消沉等负性情感增加表现和睡眠障碍,睡眠障碍可刺激儿茶酚胺分泌,促进血小板聚集,增加脑卒中复发风险〔13〕。因此关注PSD患者睡眠障碍对了解睡眠障碍发生机制,指导临床治疗有极大帮助。
Suh等〔14〕报道显示脑卒中后睡眠障碍发生率高达44.20%,睡眠障碍与抑郁症显著相关(P=0.044),提示睡眠障碍是脑卒中后常见并发症,而抑郁可加重睡眠障碍。本研究分别从PSQI评分、PSG检测主客观两个角度观察PSD患者睡眠障碍现状和特点,发现PSD组患者PSQI各个维度评分均显著高于对照组,验证 PSD与睡眠障碍的相关性。睡眠障碍与患者躯体化、焦虑情绪呈正相关,脑卒中后患者肢体瘫痪影响患者独立生活和工作能力,经济收入减少,患者丧失安全感和价值感,同时疾病增加家庭经济负担,患者心理承受压力巨大,生活能力降低严重影响患者生活质量,因此容易出现焦虑、恐惧、悲观、绝望、抑郁等消极情绪和恶劣心境,引起睡眠障碍,而睡眠质量下降又可以加重身心症状,形成恶性循环〔15〕。本研究脑卒中患者不论是否发生PSD均出现一定程度睡眠结构破坏,表现为总睡眠时间缩短和睡眠效率的下降,觉醒增多、睡眠潜伏期增多,而PSD患者上述问题更为严重,且随抑郁程度的增加而增加,分析原因可能为:5-HT是大脑重要神经递质,广泛分布于大脑皮层和神经突触内,为自体活性物质可使人产生愉悦感,脑组织梗死发生时可阻断5-HT能神经通路,导致分泌5-HT减少,降低神经活动兴奋度,导致抑郁的发生〔16〕,而5-HT是引起快速眼动的重要神经递质〔17〕,这也从分子生物学角度解释了抑郁与睡眠障碍的关系。
神经-内分泌-免疫是相互联系和相互作用的一个整体系统,共同调节和维持体内环境稳定状态〔18,19〕。大脑、免疫系统形成双向调控网络,大脑组织受损时,免疫细胞大量激活可导致生理、行为、情感、认知等方面发生明显变化。促炎细胞因子不仅在脑卒中、PSD中扮演重要角色,在睡眠障碍发生过程中也起到重要作用。相关研究发现非器质性抑郁症患者血清IL-1、IL-18、超敏C反应蛋白(hs-CRP)细胞因子水平高于无抑郁症人群〔20〕,说明炎性细胞因子作为联络网神经递质,参与了抑郁症发病机制。装载脑特殊蛋白小鼠敲除IL-1受体后,非快速眼球运动(NREM)睡眠延长,REM睡眠减少,提示IL-1受体具有调节睡眠作用〔21〕。本研究观察PSD组患者血清IL-1、IL-2水平明显升高,高于NPSD组和对照组,睡眠障碍越重患者血清IL-1、IL-2水平越高,回归分析IL-1、IL-2与PSD睡眠障碍相关,一方面为脑卒中炎性病理发生机制提供了证据,另一方面说明炎性细胞因子IL-1、IL-2可能参与PSD后睡眠障碍和炎性病理机制的发生发展过程。
与觉醒相关的神经递质功能失调是导致脑卒中后睡眠障碍的主要因素,5-HT是介导感觉传递的神经递质,5-HT能和去甲肾上腺素能神经元轴突通过丘脑、基底节区到达额叶皮质,脑梗死累及上述部分可影响5-HT能和去甲肾上腺素能神经通路,引起5-HT和去甲肾上腺素分泌下降,产生睡眠-觉醒障碍〔22〕。睡眠障碍患者5-HT水平偏低,神经系统兴奋性偏高,表现为难以入睡或进入深度睡眠〔23〕。Hypocretin是广泛分布于下丘脑区域的神经肽,由神经元分泌,通过丘脑中线核向大脑皮层投射,激活皮层引起觉醒,减少睡眠和REN睡眠时间〔24〕。脑梗死可阻断Hypocretin信号通路,损害Hypocretin神经元和投射系统,扰乱神经递质间相互调节,干扰睡眠-觉醒调节。本研究观察PSD组患者血清Hypocretin水平高于NPSD组和对照组,且随睡眠障碍程度加重而升高,5-HT水平明显低于NPSD组和对照组,随睡眠障碍程度加重而降低,Hypocretin升高、5-HT降低增强了促觉醒作用,加重患者觉醒-睡眠障碍,导致睡眠障碍发生。回归分析Hypocretin、5-HT是PSD睡眠障碍的发生显著相关,验证了Hypocretin、5-HT在 PSD睡眠障碍中发挥重要调节作用,可能参与PSD睡眠障碍发生发展。
综上,脑卒中后PSD患者睡眠障碍发病率较高,睡眠障碍程度与抑郁程度密切相关,炎性反应和神经递质功能失调可能是导致PSD睡眠障碍的原因。本研究创新之处在于探讨了PSD睡眠障碍可能的发病机制,在同类研究中少有。不足之处在于样本数量有限,采用主观评价量表PSQI为评价睡眠障碍的标准,导致主观恶化睡眠质量评测结果的可能,望在以后研究中寻求更为可靠的评价指标、增加样本数量进一步证实研究结果的可靠性。
