海洋生物抗炎活性物质研究进展
2020-02-07杨超凡李文军
杨超凡, 秦 松, 李文军
海洋生物抗炎活性物质研究进展
杨超凡1, 2, 秦 松2, 李文军2
(1. 哈尔滨工业大学 海洋科学与技术学院, 山东 威海 264209; 2. 中国科学院 烟台海岸带研究所, 山东 烟台 264003)
炎症是一种常见生理反应, 在疾病的发生发展过程中具有非常重要的作用。炎症反应既具有阻止致炎因子蔓延全身和清除致炎因子、修复损伤组织和器官等积极作用, 也有引发细胞和组织变性和坏死, 甚至诱发某些肿瘤的潜在危害。目前临床常用的抗炎药分为甾体类和非甾体类抗炎药, 它们常伴有胃肠损伤等各种副作用。海洋独特的自然环境孕育了独特而多样的抗炎活性物质, 如萜类、生物碱、多糖类、多肽类、脂肪酸类和聚酮类化合物等。这些独特的抗炎活性物质因具有较好的抗炎效果和较少的副作用, 从而备受关注。本文综述了近年来具有抗炎活性的海洋生物活性物质及其衍生物的研究进展。
活性物质; 抗炎; 海洋生物; 环氧合酶; 一氧化氮合酶
炎症反应是免疫系统应对致炎因子或组织损伤的普遍而复杂的生理反应[1], 这种机体对刺激的防御性反应, 常表现为红肿、疼痛和功能障碍等[2]。炎症反应可能导致疾病的发生, 如癌症、关节炎、胰岛素耐受和病毒性心肌炎等[3]。同时炎症因子的过度表达可能导致其他疾病的发生, 如细菌性脑膜炎、阿尔茨海默病、心血管疾病和慢性结肠炎引发的结肠癌等[4]。例如, 研究发现TLR4的过表达会增加小鼠对结肠癌的易感性, 而抑制TLR4基因可以抑制环氧化酶-2(COX-2)的产生, 从而减少前列腺素E2(PGE2)的产生以及抑制表皮生长因子受体(EGFR)在慢性结肠炎中的信号传导, 进而保护小鼠避免患上由慢性炎症引起的结肠癌。TLR4中被诱导的双调蛋白依赖于COX-2, 并激活结肠上皮细胞中EGFR磷酸化[5]。近期备受关注的SARS-CoV-2(亦被称为2019-nCoV)诱导患者的免疫系统大量释放粒细胞巨噬细胞刺激因子(GM-CSF)和IF-6等细胞因子, 导致瀑布效应和急性炎症反应。这将弱化全身血管功能, 引发急性呼吸窘迫症以及多器官衰竭[6]。
目前, 临床上应用的主要是甾体类和非甾体类抗炎药[7]。甾体类抗炎药主要是为皮质激素类药物(glucocorticoid, GC), 可以用于治疗类风湿性关节炎和炎性肠病。GC通过与细胞浆和细胞膜上的糖皮质激素受体结合、细胞膜的非特异作用独立或共同发挥抗炎作用[8]。非甾体药有聚酮类、生物碱类、脂肪酸类及其他抗炎生物活性物等[9]。它们种类繁多机制多样, 可以通过抑制COX-2、PGE2、一氧化氮合酶(NOS)和TLRs多种信号通路途径发挥抗炎作用 (图1)。其中, 较为常见的抑制作用靶点分子为COX-2和诱导型一氧化氮合酶(iNOS)。COX-2途径通过抑制COX的表达来阻断花生四烯酸(AA)合成PGs, 从而抑制PGs引起的炎症反应。COX-1诱导的PGs可保护胃肠黏膜、平衡肾脏血流量, 而COX-2则促进炎症部位的PGs的合成。因此如何较高选择性抑制COX-2、降低药物与COX-1的亲和力成为研发新型非甾体抗炎药的关键[10]。
海洋生物与陆生生物的生存环境存在较大差异, 因此产生了大量具有特殊化学结构和独特生物活性的物质, 这些物质为筛选新型抗炎药构建了一个巨大的化合物库[11]。近年来从海洋生物中分离提纯出许多萜类、生物碱、多糖类、多肽类、脂肪酸类和聚酮类化合物, 都具有一定的抗炎活性。这些海洋抗炎生物活性物质可以用于研发新型抗炎药或者作为新型抗炎药的前体。
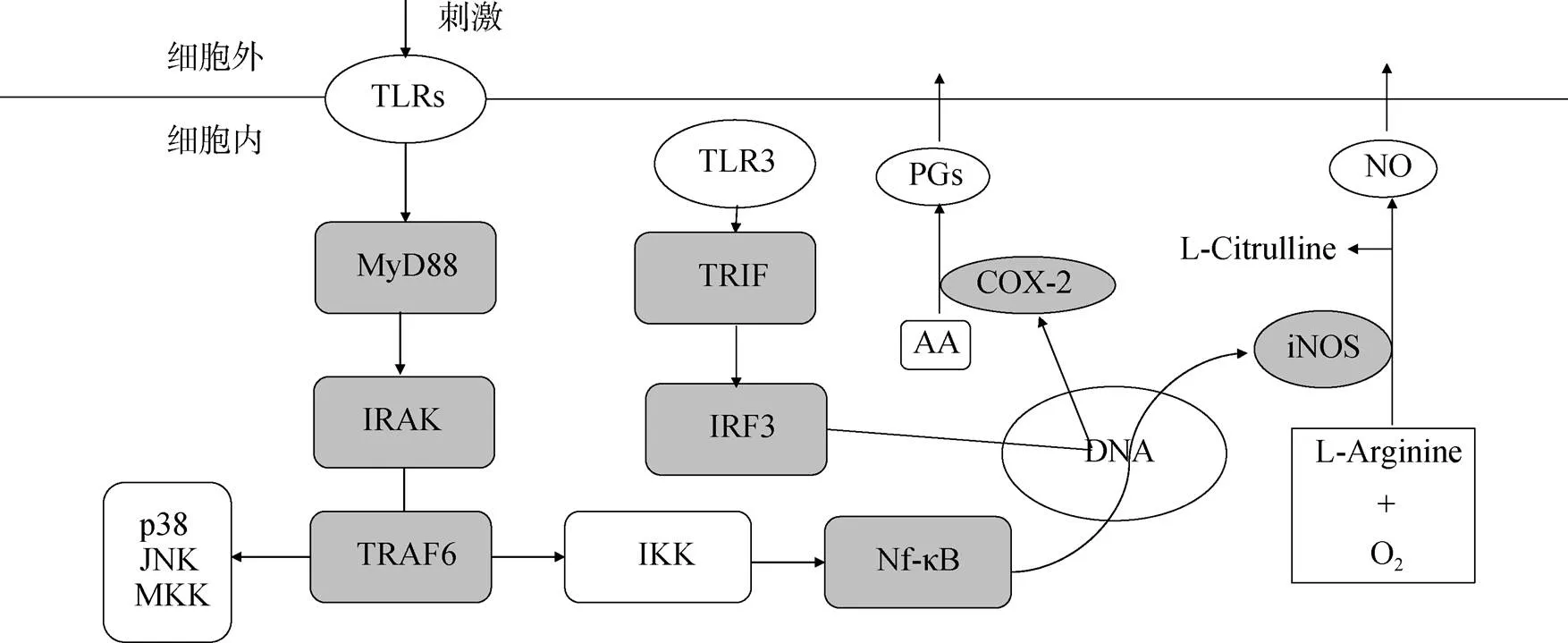
图1 非甾体类抗炎药作用机制示意图
注: 灰色标注为已知的作用位点
1 海洋生物活性物质
1.1 海洋抗炎萜类
萜类化合物是指由若干异戊二烯结构单元组成的碳氢化合物。根据其组成可以分为单萜、倍半萜、二萜、二倍半萜、三萜和多聚萜等。海洋生物主要合成二萜、二倍半萜或分子量较高的萜类, 这些萜类通常含有卤素、异氰基和呋喃环官能团[12]。目前海藻、海绵和珊瑚动物是海洋中萜类化合物的主要来源。
Lin等[13]从软珊瑚中分离得到的二萜Excavatolide B(图2-1), 脂多糖(LPS)诱导的小鼠巨噬细胞(RAW 264.7)中iNOS和COX-2的表达受到它的显著抑制。Excavatolide B可使卡拉胶诱导的足水肿显著减弱, 组织病理学和蛋白印迹进一步研究表明, 卡拉胶诱导的白细胞浸润和足组织在Excavatolide B作用下iNOS的表达减弱。Tseng等[14]从软珊瑚分离出二萜Accidenol A(1)(图2-2)和7-pavidolide D(2)(图2-3), 它们通过抑制人类嗜中性白细胞产生超氧阴离子以及释放弹性蛋白酶表现抗炎活性。此外, Glaucumolides A和B表现出对LPS诱导RAW264.7产生的iNOS具有抑制作用。Ahmed等[15]从软珊瑚中分离的化合物9通过减少LPS诱导的RAW 264.7细胞中COX-2和iNOS蛋白的表达而显示抗炎活性。Shen等[16]从软珊瑚中分离出了二萜叶绿素A(1)和B(3)(图2-9和2-10), 它们对NO的产生显示出抑制作用而具有抗炎能力。
Huang等[17]从紫菜中提取出的二萜 Briaviodiol A(2)和(4)(图2-11和2-12)。体外促炎症抑制试验结果显示, Briaviodiol A(2)和(4)与细胞仅受到LPS刺激时相比, 在10 μM时释放抑制率分别为67.7%和61.9%, 表现出显著的抗炎活性。
Lee等[18]从海绵sp.中分离出的酯类萜Sesterterpenoid在LPS诱导的RAW 264.7中表现出NO抑制作用。Seo等[19]从海绵sp. 中分离出脂类半萜Phorbaketal A(图2-13), 它不仅可以抑制NO生成, 同时通过抑制iNOS减少生成其他炎性细胞因子。Gui等[20]从海绵中分离出Septosone A(图2-14), 它对TNF-α诱导的人HEK-293T中NF-κB通路活化有抑制作用, NF-κB信号通路的失活导致Septosone A在硫酸铜诱导的转基因荧光斑马鱼体内表现抗炎活性。
1.2 海洋抗炎生物碱类
海洋生物碱是海洋动植物中具有胺型氮功能基和复杂碳骨架环系结构的碱性有机物。这些生物碱大都是氨基酸的衍生物等次生代谢物[25]。目前海洋抗炎生物碱主要来自海绵, 部分来自珊瑚和霉菌。
Di等[26]从海绵中提取出生物碱Geobarrettin B和C(图2-15和2-16), Geobarrettin B抑制树突细胞(DC)中IL-12p40的分泌, 但GeobarrettinC伴随IL-10产生的增加。与同种异体CD4+T细胞共培养之前, 用Geobarrettin B和C处理的成熟DCs降低了IFN-γ的T细胞分泌, 表明Th1分化减少。虽然Barettin降低IL-12p40和IL-10的DC分泌, 在Barettin存在下成熟的DC不会影响T细胞分泌IFN-γ和IL-17的能力, 但减少了IL-10的分泌。这些结果表明Geobarrettin B和C可用于治疗Th1型炎症。Barettin(图2-17)于1982年首次从中分离出来, Lind等[27]研究发现Barettin通过抑制LPS诱导的THP-1细胞分泌IL-1β和TNF-α而具有抗动脉粥样硬化的活性。
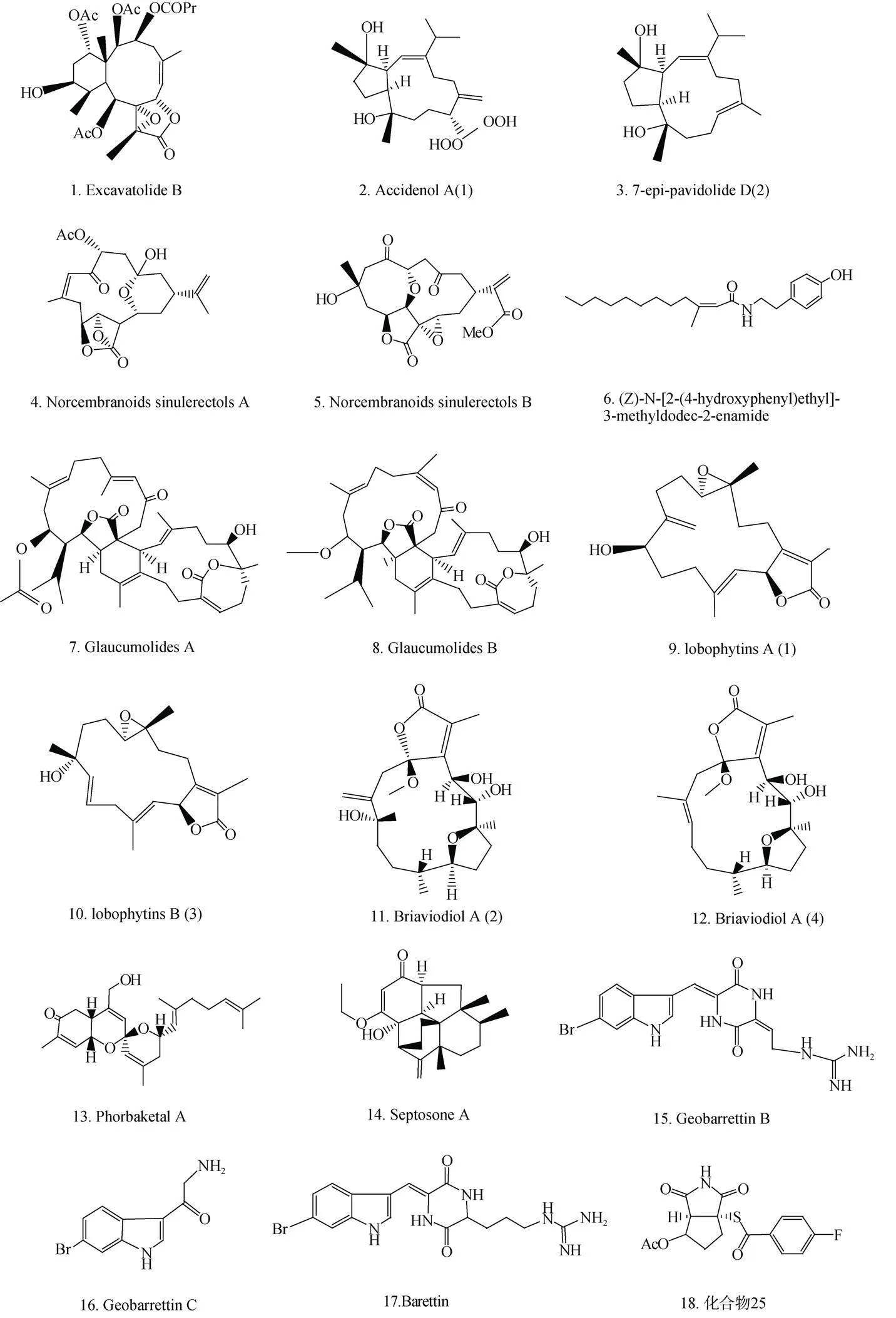
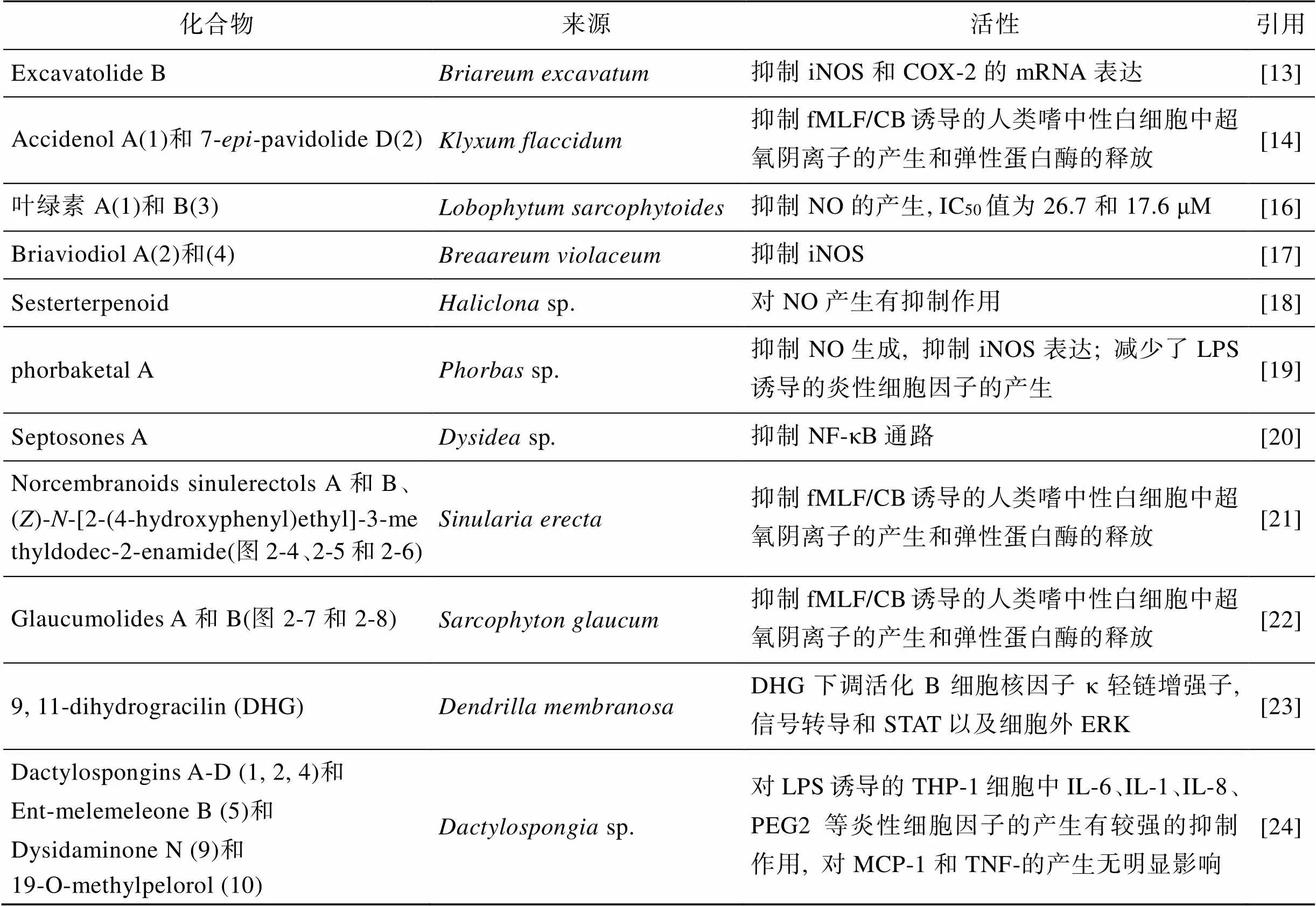
表1 海洋生物萜类抗炎物质
Carpes等[28]发现珊瑚的甲醇提取物存在皂素类似物, 其通过抑制产生NO从而减少水肿。而且其乙酸乙酯馏分抗炎活性更强。这种提取物仍需要进一步分离纯化, 以便确定具体的活性成分和抗炎通路。
Philkhana等[29]从曲霉中提取到Nitrosporeusines A和B, 然后根据其产物人工合成化合物25、29和40(图2-18、2-19和2-20), 数据显示LPS诱导的RAW 264.7产生的NO、细胞内活性氧(reactive oxygen species, ROS)和促炎性细胞因子的含量显著降低。通过免疫印迹反应发现LPS诱导的细胞中NF-κB的活化作用显著地减弱, 并观察到iNOS、COX-2表达的降低。
由顶头孢霉菌中的头孢霉素C(Cephaloseporin C)开发而来的头孢噻吩等头孢菌素类抗生素, 其作用机制大多是与青霉素结合蛋白结合而抑制细菌细胞壁合成过程中的第三期和终末期, 临床上用于治疗中耳炎、扁桃体炎、急慢性支气管炎等炎症[30]。
1.3 海洋抗炎脂肪酸类
海洋生物中的N-3多不饱和脂肪酸(PUFAs)是人类饮食中不饱和脂肪酸的重要来源。脂肪组织不仅起到能量存储的作用, 而且还具有内分泌功能, 可以分泌和释放各种可能具有促炎或抗炎活性的脂肪酸。目前海洋抗炎脂肪酸主要分离自海鱼、软珊瑚、海藻等。
其中二十碳五烯酸(Eicosapentaenoic Acid, EPA)和二十二碳六烯酸(Docosahexaenoic acid, DHA) (图2-21和2-22)具有显著的抗炎作用[31]。EPA竞争性地抑制AA形成PGE2并产生PGE3, 从而显示出抗炎作用[32]。DHA由于其代谢中的产物, 从而显示出比EPA更有效地抑制炎症[32-33]。Rod-In等[34]从产于日本的鱼类中分离得到Japonicus egg lipids, 这类脂质主要包含多不饱和脂肪酸(占总脂肪酸含量的52.9%, 主要为EPA和DHA), 其次是单不饱和脂肪酸和饱和脂肪酸(分别为23.7%和23.4%)。Japonicus egg lipids可显著降低NO的产生, 并抑制免疫相关基因(如iNOS, COX-2, IL-1β, IL-6和TNF-α), 此外还可以降低NF-κB和MAPK途径中ERK1/2、NF-κB p65和p38、JNK的磷酸化水平。Shen等[16]从软珊瑚分离得到的提取物中含有(5)-PGB2、13, 14-dihydro-PGB2和13, 14-dihydro-PGB2-Me (图2-23、2-24和2-25), 能够抑制LPS诱导的RAW264.7细胞中NO的产生。Contignasterol[35]是从海绵中分离出来的, 它具有治疗哮喘和炎症的作用, 并且已经成功研制出了平喘和抗炎药物Contignasterol(考替特罗)。Contignasterol衍生物类固醇IPL576092[36]也作为抑制炎症的新药进入Ⅱ期临床试验。

表2 海洋生物生物碱抗炎物质

表3 海洋生物脂肪酸抗炎物质
1.4 海洋抗炎多糖类
许多海洋多糖具有增强免疫调节、抗炎、抗肿瘤、抗病毒等活性[39], 具有开发成为保健食品和药物的巨大潜力, 目前海洋抗炎多糖类生物活性物质主要来自海藻。
海藻中的海藻多糖具有显著的抗炎活性, 并在多个炎症模型中得到证实。海藻多糖通过调控NF-κB、MAPK、JAK/STAT等信号通路发挥其抗炎作用[40]。
抗炎硫化多糖是抗炎多糖的重要成分之一, 其中岩藻依聚糖(MFS)是来自褐藻硫酸化多糖。Dutot等[41]通过测量细胞因子、COX-2和PGE2的表达情况, 证明其具有抗炎活性。MFS抑制某些细胞因子、趋化因子和PGE2的产生, 但不会改变IL-12的产生表达。在临床上证明, MFS通过抑制TLR3介导的炎性介质产生, 从而阻断病毒感染炎症的发生。帕金森氏病是涉及炎症和神经退行性过程的疾病, Coura等[42-43]从巴西红藻中分离出来的硫酸化多糖无毒性且呈现体内抗炎活性。Souza等[44]实验数据显示6-羟基多巴胺(6-OHDA)纹状体内注射使炎性基因p65、iNOS和IL-1β的表达高于正常值, 并造成脑源神经营养因子的转录基因下调。但是硫酸多糖(Sulphated polysaccharide, SA-Gc)可以拮抗上述作用并恢复至本底水平。富含生物活性分子的海藻具有多种生物活性, Ananthi等[45]研究发现其硫酸化多糖在(Complete Freund’s Adjuvant, CFA)诱导的大鼠关节炎模型中表现了良好的抗炎潜力。硫酸化多糖显著降低了脚掌体积和关节炎评分, 并且它可以在超低剂量下抑制炎症和骨骼损伤, 证明它在抗炎应用上具有极高的价值。
Wang等[46]研究发现, 肠道营养不良症促进的神经炎症与小鼠阿尔默兹海默症(Alzheimer’s disease, AD)密切联系。肠道中苯丙氨酸和异亮氨酸随肠道菌群组成的改变而异常积累, 并刺激Th1细胞的增殖和分化。随后脑内M1型小胶质细胞与侵润入脑的Th1细胞共同活化, 造成AD相关神经炎症发生。耿美玉等原创的海藻寡糖类抗AD新药GV-971已经上市, 它通过重塑肠道菌群平衡降低苯丙氨酸和异亮氨酸的产生, 在抑制神经炎症的同时, 减少Aβ的沉积和Tau蛋白的磷酸化, 从而改善认知障碍。
从螺旋藻中提取的杂多糖螺旋藻糖肽(K-001)[35], 具有预防治疗病毒性肺炎和非典型肺炎的功效。由此开发的藻糖蛋白胶囊, 目前正处于临床Ⅱ期实验中。此外, 由红藻硫酸多糖开发的滴眼剂Carragelos, 临床研究用于治疗病毒性结膜炎[35]。
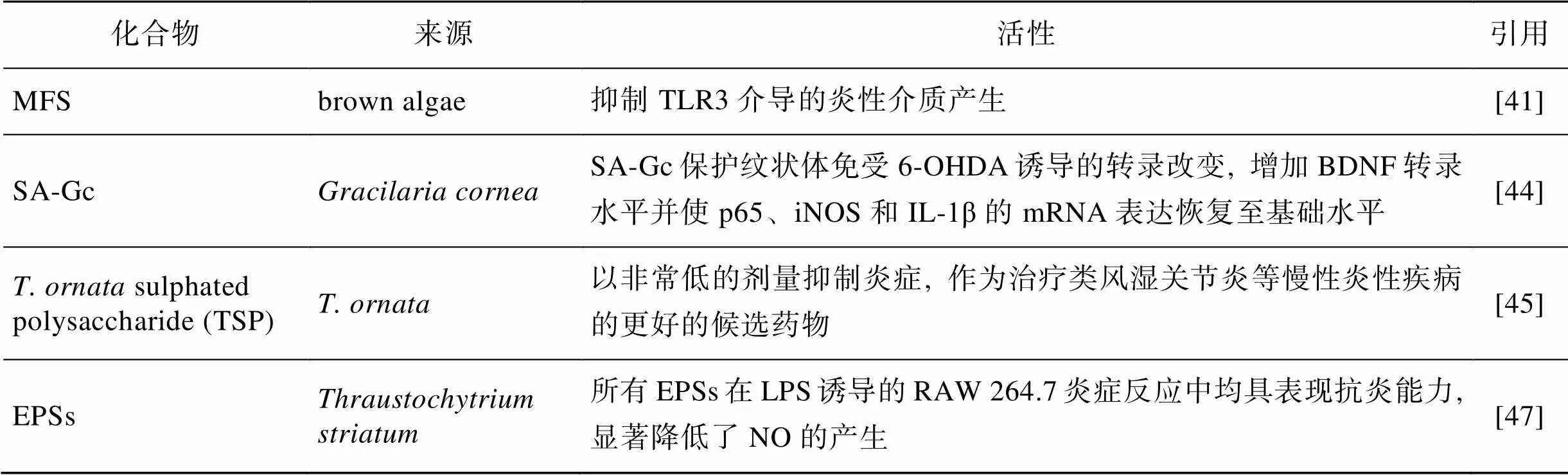
表4 海洋生物多糖类抗炎物质
1.5 海洋抗炎多肽类
海洋多肽主要来源于海藻、海绵等海洋生物中, 多具有免疫调节、抗炎、抗肿瘤和抗病毒的生物活性。
海洋来源凝集素是海洋生物中的糖蛋白或与糖结合的多肽, 具有促进细胞识别和黏着的作用, 一部分还表现抗炎生物活性。海藻凝集素与陆生植物凝集素相比多以单体形式存在, 结构较为简单, pH多数在5~10时具有生物活性[48]。
在食品工业中, 凝集素是这些化合物中重要的生物活性物质。Abreu等[49]发现红藻中提取的凝集素(SfL)在急性炎症试验中显示出抗炎活性。该凝集素的抗炎作用的确切机制尚待阐明。然而, 已经表明其作用机理除了部分维持血氧合酶-1途径的完整性外, 还可能有抑制血清素的作用。在有效剂量的凝集素浓度下, 动物测试没有表现毒性。另外, 海洋藻类凝集素Caulerpa cupressoides凝集素、Pterocladiella capillace凝集素、Solieria filiformis凝集素都增加了IL-6的生成而无细胞毒性。在鼠淋巴细胞中, IL-10增强它们的抗炎活性, 但没有影响IFN-γ和IL-2的表达[42]。将从绿藻提取的Caulerpa cupressoides凝集素[50]静脉给药, 半小时后将酵母聚糖注射到左颞下颌关节。结果表明该凝集素减轻了酵母聚糖引起的关节炎和机械性神经痛, 并抑制了髓过氧化物酶活性。因此, 凝集素减轻颞下颌关节痛感和炎症的机制部分依赖于抑制IL-1β和TNF-α, 凝集素可能有助于研究影响颞下颌关节的疾病。
经鱼蛋白水解物(fish protein hydrolysate, FPH)[51]处理的小鼠血浆INF-γ水平降低, 而其他细胞因子未改变, 因此FPH可能因为其对脂肪酸代谢的影响而具有抗炎潜力。向高脂饮食喂养的hTNFα小鼠施用FPH会影响肝脏中的脂肪酸组成, 同时增加脂肪酸的抗炎指数。
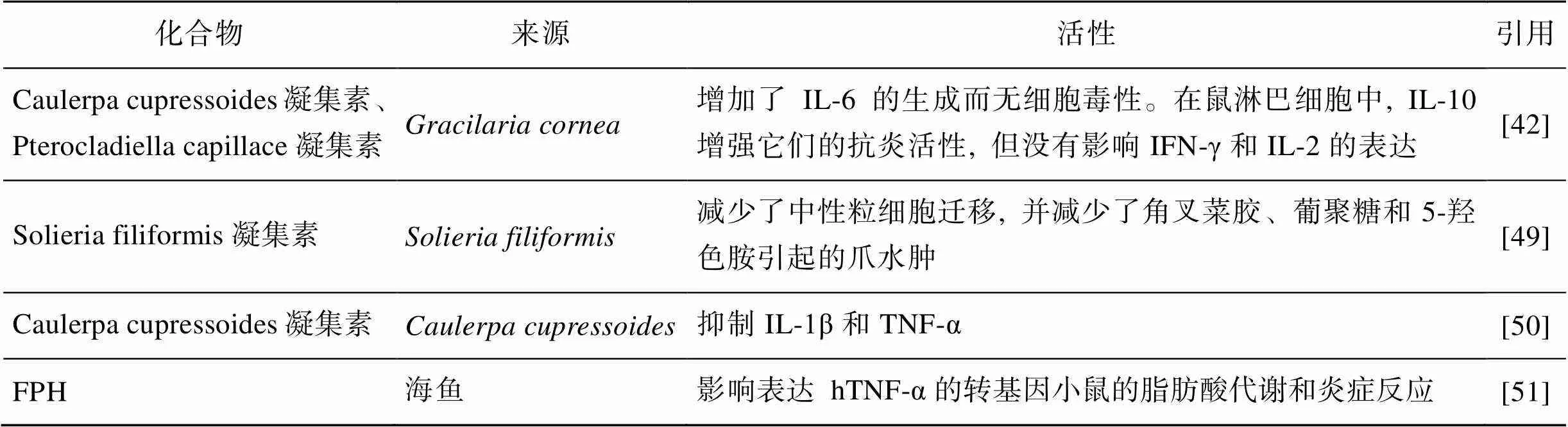
表5 海洋生物多肽抗炎物质
1.6 海洋抗炎聚酮类
聚酮类化合物是通过聚酮类化合物生物途径合成的一类化合物的总称, 包括蒽醌类、大环内酯、聚醚类和四环类等化合物。它具有结构的多样性, 还具有功能的复杂性, 例如抗炎、抗病毒、抗细菌、抗真菌和抗肿瘤等。目前海洋抗炎聚酮类生物活性物质主要来自海绵和真菌[52]。
Du等[53]从海绵中分离出包括六种新化合物在内的二十种聚酮类化合物。用MTT法检测化合物的细胞毒性作用, 结果显示100 μM剂量对BV2和SW480无细胞毒性。LPS诱导的BV2中NO的产生明显增加。化合物1-20对LPS诱导的BV2细胞产生的NO有抑制作用。其中化合物4(图2-26)的活性最强, 化合物2、5显著降低NF-κB表达(图2-27和2-28)。化合物9(图2-29)和16-18(图2-30、2-31和2-32)对NF-κB表达的抑制作用较弱且对NO的产生作用较弱, 表明这些化合物通过NO以外的其他炎症介质调控炎症反应。
Yang 等[54]从海洋源真菌中分离出蒽醌衍生物Questinol(图2-33), 其可在指定温度下显著抑制NO和PGE2的产生浓度。还发现Questinol可抑制TNF-α、IL-1β和IL-6等促炎细胞因子的产生。此外, 蛋白质印迹分析表明Questinol抑制iNOS在一个剂量依赖性方式表达水平。然而, Questinol可以在200 µM CO2浓度稍微抑制COX-2的表达。因此Questinol是开发抗炎药的潜在药物。Lee等[55]从海洋源sp. SF-5292中分离出Penicillospirone (1)(图2-34)。在LPS诱导的RAW264.7和BV2中, Penicillospirone (1)对 NO和PGE2的表达表现抑制作用。这些抑制作用与Penicillospirone (1)对iNOS和COX-2过表达的抑制作用相关。此外, Penicillospirone (1)还抑制TNF-α、IL-1β、IL-6和IL-12的生成。总体而言, Penicillospirone (1)可能通过NF-κB信号通路的负调控作用表现出抗炎作用。
sp IFB-Z10是从中国黄海采集的白姑鱼的肠道中分离得到的[56]。Ding等[57]从中分离出六个新缩酚酸环醚Curdepsidones B-G(1-6)。其中Curdepsidone C(图2-35)存在立体异构体化合物1和化合物2。化合物2对IL-1β产生显著抑制作用, 而化合物1在其安全浓度下没有抗炎特性, 这表明化合物的立体构型对抗炎活性有巨大影响。进一步的研究表明, 化合物2可以通过剂量依赖性机制选择性降低JNK和ERK的磷酸化来抑制IL-1β的产生, 并且对p38的磷酸化没有明显作用。因此Curdepsidone C化合物2可以进一步用于开发抗炎药物。
Choi等[58]从红藻中分离出3-bromo-4, 5-dihydroxybenzyl(BBDE, 图2-36), 研究表明在LPS诱导的RAW 264.7中, BBDE通过抑制ROS参与调控的ERK信号转导途径来抑制炎症。
2 展望
炎症是一种重要而常见的生理反应, 受到刺激时可释放多种促炎因子和炎症介质以激活免疫系统, 从而有助于人体恢复健康。但是, 当炎症过表达时则可能导致机体发热、休克、器官损伤甚至死亡[59]。近年来文献表明, 炎症的患病率、严重性和复杂性日趋严重, 对现有的抗炎药物和卫生体系提出巨大的挑战。当前, 随着合成药物的发展, 临床上广泛使用了阿司匹林、皮质类固醇和塞来昔布等类型的抗炎药。阿司匹林和皮质类固醇对人类胃肠道和肾脏常伴随副作用, 这在一定程度限制了抗炎药在临床上的应用。辉瑞公司生产的塞来昔布[60]是用于缓解骨关节炎、成人类风湿关节炎的非甾体抗炎药。它较好地平衡了COX-2和COX-1的相对抑制程度, 具有良好抗炎疗效和胃肠道安全性, 相对于传统NSAID更适宜中国人群使用。

表6 海洋生物聚酮类抗炎物质
海洋是地球资源库中表面积和生物量占比最大, 且生物种类繁多的生态系统。海洋生物中丰富而独特的生物活性物质分离出了大量具有抗炎活性物质[61]。随着海洋抗炎生物活性的结构、功能和作用机制不断被解析, 未来, 可以通过对海洋抗炎活性物质修饰和改良从而增强其抗炎活性、降低毒副作用[62]; 也可以利用化学修饰和半合成技术, 从头设计出效果更佳、更适合大规模生产的全新药物分子。随着基因工程和蛋白质工程技术的发展, 将海洋抗炎活性物质的基因整合到高表达载体中, 将实现海洋抗炎活性物质的高效、低成本生产。
[1] Coussens L M, Werb Z. Inflammation and cancer[J]. Nature, 2002, 420(6917): 860-867.
[2] Xu J, Yi M, Ding L, et al. A review of anti-inflammatory compounds from marine fungi, 2000-2018[J]. Marine Drugs, 2019, 17(11): 636-659.
[3] Hunter P. The inflammation theory of disease: the growing realization that chronic inflammation is crucial in many diseases opens new avenues for treatment[J]. EMBO Reports, 2012, 13(11): 968-970.
[4] Hotamisligil G S. Inflammation, metaflammation and immunometabolic disorders[J]. Nature, 2017, 542(7640): 177-185.
[5] Fukata M, Chen A, Vamadevan A S, et al. Toll-like receptor-4 promotes the development of colitis-associated colorectal tumors[J]. Gastroenterology, 2007, 133(6): 1869-1881.
[6] Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. The Lancet, 2020, 395(10223): 497-506.
[7] Wei W C, Sung P J, Duh C Y, et al. Anti-inflammatory activities of natural products isolated from soft corals of Taiwan between 2008 and 2012[J]. Marine Drugs, 2013, 11(10): 4083-4126.
[8] Sasse S K, Gruca M, Allen M A, et al. Nascent transcript analysis of glucocorticoid crosstalk with TNF defines primary and cooperative inflammatory repression[J]. Genome Research, 2019, 29(11): 1753-1765.
[9] Qandil A M. Prodrugs of nonsteroidal anti-inflammatory drugs (NSAIDs), more than meets the eye: a critical review[J]. International Journal of Molecular Sciences, 2012, 13(12): 17244-17274.
[10] Howes L G. Selective cox-2 inhibitors, nsaids and cardiovascular events - is celecoxib the safest choice?[J]. Therapeutics and Clinical Risk Management, 2007, 3(5): 831-845.
[11] Bull A T, Stach J E. Marine actinobacteria: new opportunities for natural product search and discovery[J]. Trends in Microbiology, 2007, 15(11): 491-499.
[12] Gross H, König G M. Terpenoids from marine organisms: unique structures and their pharmacological potential[J]. Phytochemistry Reviews, 2006, 5(1): 115-141.
[13] Lin Y Y, Lin S C, Feng C W, et al. Anti-Inflammatory and analgesic effects of the marine-derived compound Excavatolide B isolated from the culture-type Formosan Gorgonian Briareum excavatum[J]. Marine Drugs, 2015, 13(5): 2559-2579.
[14] Tseng W R, Ahmed A F, Huang C Y, et al. Bioactive capnosanes and cembranes from the Soft Coral[J]. Marine Drugs, 2019, 17(8): 461-472.
[15] Ahmed A F, Chen Y W, Huang C Y, et al. Isolation and structure elucidation of cembranoids from a Dongsha Atoll soft coral[J]. Marine Drugs, 2018, 16(6): 210-224.
[16] Shen H, Liu X, Jiang M, et al. Anti-inflammatory cembrane-type diterpenoids and prostaglandins from soft coral[J]. Marine Drugs, 2019, 17(8): 481-491.
[17] Huang P C, Lin W S, Peng B R, et al. New furanocembranoids from[J]. Marine Drugs, 2019, 17(4): 214-222.
[18] Lee K, Rho J R. A new sesterterpenoid showing anti- inflammatory effect from the marine sponge[J]. Journal of the Korean Magnetic Resonance Society, 2015, 19(1): 23-28.
[19] Seo Y J, Lee K T, Rho J R, et al. Phorbaketal A, isolated from the marine spongesp., exerts its anti-inflammatory effects via NF-kappa B inhibition and heme oxygenase-1 activation in lipopolysaccharide-stimulated macrophages[J]. Marine Drugs, 2015, 13(11): 7005-7019.
[20] Gui Y H, Jiao W H, Zhou M, et al. Septosones A-C, In vivo anti-inflammatory meroterpenoids with rearranged carbon skeletons from the marine sponge[J]. Organic Letters, 2019, 21(3): 767-770.
[21] Huang C Y, Tseng Y J, Chokkalingam U, et al. Bioactive isoprenoid-derived natural products from a Dongsha Atoll soft coral[J]. Journal of Natural Products, 2016, 79(5): 1339-1346.
[22] Huang C Y, Sung P J, Uvarani C, et al. Glaucumolides A and B, Biscembranoids with new structural type from a cultured soft coral[J]. Scientific Reports, 2015, 5(1): 15624-15624.
[23] Ciaglia E, Malfitano A M, Laezza C, et al. Immuno- modulatory and anti-inflammatory effects of Dihydrogracilin A, a terpene derived from the marine sponge[J]. International Journal of Molecular Sciences, 2017, 18(8): 1643-1658.
[24] Li J, Yang F, Wang Z, et al. Unusual anti-inflammatory meroterpenoids from the marine spongesp.[J]. Organic & Biomolecular Chemistry, 2018, 16(36): 6773-6782.
[25] Jin L, Quan C, Hou X, et al. Potential pharmacological resources: natural bioactive compounds from marine- derived fungi[J]. Marine Drugs, 2016, 14(4): 76-100.
[26] Di X, Rouger C, Hardardottir I, et al. 6-Bromoindole derivatives from the Icelandic marine sponge: isolation and anti-inflammatory activity[J]. Marine Drugs, 2018, 16(11): 437-453.
[27] Lind K F, Hansen E, Osterud B, et al. Antioxidant and anti-inflammatory activities of barettin[J]. Marine Drugs, 2013, 11(7): 2655-2666.
[28] Carpes R M, Correa Fernandes D, Coelho M G P, et al. Anti-inflammatory potential of invasive sun corals (Scleractinia: Tubastraea spp.) from Brazil: alternative use for management?[J]. Journal of Pharmacy and Pharmacology, 2020, 72(4): 633-647.
[29] Philkhana S C, Verma A K, Jachak G R, et al. Identification of new anti-inflammatory agents based on nitrosporeusine natural products of marine origin[J]. European Journal of Medicinal Chemistry, 2017, 135: 89-109.
[30] 戴德银, 卢海波, 赵俊. 头孢菌素的分类、药效及临床应用[J]. 现代临床医学, 2007(S1): 81-84. Dai Deyin, Lu Haibo, Zhao Jun. Classification, efficacy and clinical application of cephalosporins[J]. Journal of modern clinical medicine, 2007(S1): 81-84.
[31] Ueno Y, Miyamoto N, Yamashiro K, et al. Omega-3 polyunsaturated fatty Acids and stroke burden[J]. International Journal of Molecular Sciences, 2019, 20(22): 5549-5564.
[32] Araujo P, Belghit I, Aarsaether N, et al. The effect of omega-3 and omega-6 polyunsaturated fatty acids on the production of cyclooxygenase and lipoxygenase metabolites by human umbilical vein endothelial cells[J]. Nutrients, 2019, 11(5): 966-983.
[33] Calder P C. Intravenous lipid emulsions to deliver bioactive omega-3 fatty acids for improved patient outcomes[J]. Marine Drugs, 2019, 17(5): 274-287.
[34] Rod-In W, Monmai C, Lee S M, et al. Anti-inflammatory effects of lipids extracted fromEggs on LPS-stimulated RAW264.7 cells[J]. Marine Drugs, 2019, 17(10): 580-590.
[35] 王成, 张国建, 刘文典, 等. 海洋药物研究开发进展[J].中国海洋药物, 2019, 38(6): 35-69. Wang Cheng, Zhang Guojian, Liu Wendian, et al. Recent progress in research and development of marine drugs[J]. Chinese Journal of Marine Drugs, 2019, 38(6): 35-69.
[36] Kasserra C E, Harris P, Stenton G R, et al. IPL576, 092, a novel anti-inflammatory compound, inhibits leukocyte infiltration and changes in lung function in response to allergen challenge[J]. Pulmonary Pharmacology & Therapeutics, 2004, 17(5): 309-318.
[37] Mayer C, Come M, Ulmann L, et al. Preventive effects of the Marine Microalga, used as a food supplement, on risk factors associated with metabolic syndrome in wistar rats[J]. Nutrients, 2019, 11(5): 1069- 1087.
[38] Gasmi A, Mujawdiya P K, Shanaida M, et al. Calanus oil in the treatment of obesity-related low-grade inflammation, insulin resistance, and atherosclerosis[J]. Applied Microbiology and Biotechnology l, 2020, 104(3): 967- 979.
[39] Ichinose K, Yamamoto M, Khoji T, et al. Antitumor effect of polysaccharide coated liposomal adriamycin on AH66 hepatoma in nude mice[J]. Anticancer Research, 1998, 18(1A): 401-404.
[40] He L, Yang W, Guan C, et al. Microalgal cultivation and hydrodynamic characterization using a novel tubular photobioreactor with helical blade rotors[J]. Bioprocess and Biosystems Engineering, 2017, 40(12): 1743-1751.
[41] Dutot M, Grassin-Delyle S, Salvator H, et al. A marine- sourced fucoidan solution inhibits Toll-like-receptor- 3-induced cytokine release by human bronchial epithelial cells[J]. International Journal of Biological Macromolecules, 2019, 130: 429-436.
[42] Coura C O, de Araujo I W, Vanderlei E S, et al. Antinociceptive and anti-inflammatory activities of sulphated polysaccharides from the red seaweed[J]. Basic & Clinical Pharmacology & Toxicology, 2012, 110(4): 335-341.
[43] Coura C O, Souza R B, Rodrigues J A, et al. Mechanisms involved in the anti-inflammatory action of a polysulfated fraction fromin rats[J]. PloS One, 2015, 10(3): 1-18.
[44] Souza R B, Frota A F, Sousa R S, et al. Neuroprotective effects of sulphated agaran from marine algain rat 6-hydroxydopamine parkinson’s disease model: behavioural, neurochemical and transcriptional alterations[J]. Basic & Clinical Pharmacology & Toxicology, 2017, 120(2): 159-170.
[45] Ananthi S, Gayathri V, Malarvizhi R, et al. Anti-arthritic potential of marine macroalgaein Complete Freund’s Adjuvant induced rats[J]. Experimental and Toxicologic Pathology, 2017, 69(8): 672-680.
[46] Wang X, Sun G, Feng T, et al. Sodium oligomannate therapeutically remodels gut microbiota and suppresses gut bacterial amino acids-shaped neuroinflammation to inhibit Alzheimer’s disease progression[J]. Cell Research, 2019, 29(10): 787-803.
[47] Xiao R, Yang X, Li M, et al. Investigation of composition, structure and bioactivity of extracellular polymeric substances from original and stress-induced strains of[J]. Carbohydrate Polymers, 2018, 195: 515-524.
[48] Cheung R C F, Wong J H, Pan W, et al. Marine lectins and their medicinal applications[J]. Applied Microbiology and Biotechnology, 2015, 99(9): 3755-3773.
[49] Abreu T M, Ribeiro N A, Chaves H V, et al. Antinociceptive and anti-inflammatory activities of the lectin from marine red alga[J]. Planta Medica, 2016, 82(7): 596-605.
[50] da Conceicao Rivanor R L, Chaves H V, do Val D R, et al. A lectin from the green seaweedreduces mechanical hyper-nociception and inflammation in the rat temporomandibular joint during zymosan-induced arthritis[J]. International Immunopharmacology, 2014, 21(1): 34-43.
[51] Bjorndal B, Berge C, Ramsvik M S, et al. A fish protein hydrolysate alters fatty acid composition in liver and adipose tissue and increases plasma carnitine levels in a mouse model of chronic inflammation[J]. Lipids in Health and Disease, 2013, 12(1): 143-153.
[52] 张柳红, 宋双. 海洋来源的聚酮类化合物及其活性研究进展[J]. 中山大学研究生学刊(自然科学医学版), 2015, 36(4): 25-34. Zhang Liuhong, Song Shuang. The research progress of the marine derived polyketides and their activity[J]. Sun Yet-Sen Journal of the Graduates (Natural science, Medicine), 2015, 36(4): 25-34.
[53] Du X, Liu D, Huang J, et al. Polyketide derivatives from the sponge associated funguswith antioxidant and NO inhibitory activities[J]. Fitoterapia, 2018, 130: 190-197.
[54] Yang X, Kang M C, Li Y, et al. Anti-inflammatory activity of questinol isolated from marine-derived fungusamstelodami in lipopolysaccharide-stimulated RAW 264.7 macrophages[J]. Journal of Microbiology & Biotechnology, 2014, 24(10): 1346-1353.
[55] Lee S, Kim D C, Park J S, et al. Penicillospirone from a marine isolate ofsp. (SF-5292) with anti-inflammatory activity[J]. Bioorganic & Medicinal Chemistry Letters, 2017, 27(15): 3516-3520.
[56] Liu J Y, Huang L L, Ye Y H, et al. Antifungal and new metabolites ofsp. Z16, a fungus associated with white croaker[J]. Journal of Applied Microbiology, 2006, 100(1): 195-202.
[57] Ding Y, An F L, Zhu X J, et al. Curdepsidones B-G, six depsidones with anti-inflammatory activities from the marine-derived Fungussp. IFB-Z10[J]. Marine Drugs, 2019, 17(5): 266-278.
[58] Choi Y K, Ye B R, Kim E A, et al. Bis (3-bromo-4, 5-dihydroxybenzyl) ether, a novel bromophenol from the marine red algathat suppresses LPS-induced inflammatory response by inhibiting ROS- mediated ERK signaling pathway in RAW 264.7 macrophages[J]. Biomedicine & Pharmacotherapy, 2018, 103: 1170-1177.
[59] Galli S J, Tsai M, Piliponsky A M. The development of allergic inflammation[J]. Nature, 2008, 454(7203): 445-454.
[60] Clemett D, Goa K L. Celecoxib: A review of its use in osteoarthritis, rheumatoid arthritis and acute pain[J]. Drugs, 2003, 59(4): 957-980.
[61] Sang V T, Dat T T H, Vinh L B, et al. Coral and coral- associated microorganisms: a prolific source of potential bioactive natural products[J]. Marine Drugs, 2019, 17(8): 468-513.
[62] 董志峰, 李新萍, 秦松, 等. 基因工程与海洋药物研究[J]. 海洋科学, 1998, 22(1): 16-20. Dong Zhifeng, Liu Xinping, Qin Song, et al. Genetic engineering and marine drug research[J]. Marine Sciences, 1998, 22(1): 16-20.
Advances in anti-inflammatory bioactive substances derived from marine organisms
YANG Chao-fan1, 2, QIN Song2, LI Wen-jun2
(1. School of Marine Science and Technology, Harbin Institute of Technology, Weihai 264209, China; 2. Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264003, China)
Inflammation is a common physiological reaction which plays a key role in the occurrence and development of certain diseases. The inflammatory reaction has a positive influence on preventing inflammatory factors from spreading throughout the body, removing inflammatory mediators, and repairing damaged tissues and organs. It also offers the opportunity to cause degeneration or necrosis of cells and tissues, even inducing certain tumors. Steroidal and non-steroidal anti-inflammatory drugs derived from terrestrial organisms are used for clinical purposes, but their administration is accompanied by various side effects, such as gastrointestinal damage. The specialized marine environment creates unique and varied anti-inflammatory bioactive substances, such as terpenes, alkaloids, polysaccharides, peptides, fatty acids, and polyketides. These individualized anti-inflammatory bioactive substances have attracted considerable attention with their vast potential for improved anti-inflammatory effects and fewer possible side effects. This paper reviews recent advances in marine anti-inflammatory bioactive substances and their derivatives.
bioactive substances; anti-inflammatory; marine organisms; COX-2; iNOS
Feb. 24, 2020
Q71
A
1000-3096(2020)11-0102-12
10.11759/hykx20200224002
2020-02-24;
2020-04-21
烟台市重点研发项目(2019XDHZ101, 2020MSGY084)
[Yantai Key Research and Development Project, No. 2019XDHZ101, No. 2020MSGY084]
杨超凡(1992-), 河南永城人, 硕士研究生在读, 研究方向为海洋生物学中蛋白质合成及应用、生物太阳能电池, E-mail: chaofanyang@stu.hit.edu.cn; 李文军,通信作者, 博士, 中科院烟台海岸带所副研究员, 研究方向为海岸带功能蛋白分子结构、功能及应用, E-mail: wjli@yic.ac.cn
(本文编辑: 杨 悦)
