中性厌氧环境中硫酸盐还原菌导致锌的腐蚀行为研究
2020-02-07窦雯雯韩晓梅蒲亚男陈守刚
全 雨, 窦雯雯, 韩晓梅, 蒲亚男, 宋 翼, 陈守刚
中性厌氧环境中硫酸盐还原菌导致锌的腐蚀行为研究
全 雨, 窦雯雯, 韩晓梅, 蒲亚男, 宋 翼, 陈守刚
(中国海洋大学 材料科学与工程学院, 山东 青岛 266100)
以锌为研究对象, 使用表面表征方法和电化学测试, 研究了一个培养周期内硫酸盐还原菌(Sulfate- reducing bacteria, SRB)()引起锌(Zn)试样腐蚀行为的影响。实验结果表明, SRB导致Zn试样发生了严重的均匀腐蚀和点蚀。浸泡7天后, SRB体系中的Zn试样平均失重为32.2 mg/cm2, 是无菌培养基中试样平均失重的42倍, 腐蚀产物主要为ZnS。生物膜和腐蚀产物膜的累积在培养初期可以减缓金属基体与溶液界面的电子传输过程, 导致腐蚀速率减缓。培养中后期, 由于生物膜和腐蚀产物膜的阻隔作用, 导致混合膜层底部有机碳源缺乏, SRB转向Zn获取自身所需电子, 表现为腐蚀速率上升。
硫酸盐还原菌; 微生物腐蚀; 锌; 点蚀; 中性厌氧
金属的微生物腐蚀(Microbiologically influenced corrosion, MIC)是指微生物的自身生命活动及其代谢产物直接或间接地加速金属材料腐蚀的过程[1]。微生物导致的金属腐蚀能在海水、淡水、土壤和油田系统等各种环境中发生。全球每年因腐蚀而造成的损失约为4万亿美元[2], 其中MIC占总腐蚀损失的20%[3]。2006年, 美国阿拉斯加州北部的普拉德霍湾输油管道泄漏就是由微生物腐蚀导致, 事件造成了世界原油价格的大幅上涨, 并引发了公众对于微生物腐蚀所引起的经济损失和环境危害的关注[4]。
硫酸盐还原菌(Sulfate-reducing bacteria, SRB)是缺氧环境中广泛存在的一种细菌[5], 被认为是厌氧MIC最重要的微生物, 因为硫酸盐是厌氧环境中最丰富的氧化剂[6]。即使是在开放系统中, SRB诱导的MIC仍然可以发生, 因为SRB可以在其他好氧微生物形成的生物膜下迅速繁殖生长[7]。
锌(Zn)是除铜(Cu)和铝(Al)之外最常用的有色金属, 以镀Zn[8]、Zn基合金[9]等形式在海洋工程领域具有广泛应用。将Zn材料置于开放海洋环境中, 能够在短时间内被海洋中的微生物附着并形成生物膜。生物膜主要由细胞和胞外多聚物组成[10-12]。生物膜一旦形成, 就容易在膜下形成厌氧环境。因此, 生物膜的覆盖为SRB提供了良好的生存环境[13]。
目前已有大量的研究表明, SRB能够通过直接或间接的方式导致Fe和Cu的腐蚀加速[14-16]。孙成等人研究还发现土壤中的SRB能够明显加速Zn的腐蚀[17]。然而, 在中性厌氧环境中, SRB是否能够像导致Fe和Cu加速腐蚀一样, 加速Zn的腐蚀, 目前尚无报道。因此, 本文主要通过研究中性厌氧环境中微生物SRB作用下Zn的腐蚀行为, 以期揭示其微生物腐蚀机理, 为Zn涂层和Zn基合金的微生物腐蚀防护提供理论依据。
1 材料与方法
1.1 样品及样品准备
锌样品(99.9%, w/w)尺寸为1 cm × 1 cm × 0.5 cm。采用60目、180目、400目砂纸磨制试样六个表面, 每个试样的工作面均为1 cm2, 除工作面外, 其他面使用惰性聚四氟乙烯涂料刷涂。将工作面采用600目的砂纸磨平, 样品在使用之前用乙醇清洗, 后转移至无菌氩气氛围的手套箱中于紫外线照射下灭菌。
1.2 细菌和培养基
脱硫弧菌(ATCC 7757)在ATCC 1249培养基中进行培养, ATCC 1249培养基具体成分详见表1。将培养基溶液的pH调为7, 后将培养基溶液和厌氧小瓶用灭菌箱加热至121℃, 保持30 min。灭菌结束后, 将培养基在冷水中冷却, 加入硫酸亚铁铵, 通氩气60 min以除去培养基中的氧气。将100´10–6的半胱氨酸加入到培养基中以除去瓶中残留的氧气。所有的厌氧操作均在无菌氩气氛围的手套箱中进行。

表1 ATCC 1249培养基的组成
1.3 SRB的培养
每个厌氧小瓶中放置三个锌试样并注入50 mL ATCC 1249培养基, 将每个厌氧小瓶分别接种1 mL SRB母液。所有厌氧小瓶均置于37℃恒温箱内, 分别孵育3天和7天后, 取出样品进行分析。
1.4 SRB生长曲线测定
在7天的培养期间, 每天检测厌氧小瓶中的浮游细胞计数和Zn试样表面的固着细胞计数。取出试样, 用pH为7.4的PBS溶液轻轻冲洗, 以除去浮游细胞和培养基, 然后使用无菌刷刮擦每个试样上的生物膜至10 mL pH为7.4的PBS溶液中, 最后将试样、无菌刷和PBS溶液放入离心管中, 涡旋1 min, 使细胞均匀地分布在溶液中。在荧光显微镜(FM, Scope.A1, ZEISS)下以400X放大倍数使用血细胞计数器进行浮游、固着细胞的计数以及固着细胞的荧光观察。
1.5 生物膜和腐蚀产物的观察
用扫描电子显微镜(SEM, ProX, Phenom)观察细胞、腐蚀产物的形态及去除产物膜后的形貌。首先, 将附有生物膜的试样浸没在4%(w/w)戊二醛溶液中4小时以杀死细胞并固定生物膜, 然后, 将生物膜依次在25%, 50%, 75%和100%(v/v)乙醇中脱水5 min, 最后, 使用真空干燥仪干燥试样。在SEM观察之前, 喷金以提高导电性。采用X射线衍射仪(XRD, Bruker D8 Discovery model, Bruker AXS GmbH)进行样品表面物质的晶体结构物相分析。
1.6 腐蚀分析
根据ASTM G1−02[18], 使用10% (w/w) (NH4)2S2O8水溶液去除生物膜与腐蚀产物膜, 使用SEM观察凹坑形态, 使用激光共聚焦显微镜(CLSM, Model VK-X250K, Keyence)进行点蚀坑深度的测试, 使用天平进行失重的测试。
1.7 电化学测试
使用电化学工作站(Gamry reference 600, Gamry)进行开路电位(OCP), 线性极化电阻(LPR)的测试。采用三电极法, 工作电极是嵌入环氧树脂中的Zn试样, 仅露出一个工作表面(10 mm×10 mm), 参比电极是饱和甘汞电极(SCE), 对电极是铂网板(20 mm×20 mm)。在450 mL玻璃瓶中进行电化学测试, 该玻璃瓶中装有200 mL ATCC 1249培养基, 接种2 mL SRB母液, 在无菌氩气氛围的手套箱中进行组装并密封。LPR扫描范围为OCP上下10 mV。
2 结果和讨论
图1显示了7天培养期间培养基中的SRB浮游细胞计数以及Zn试样上的固着细胞计数。SRB的数量在培养初期迅速增加, 第3天时SRB细胞浓度达到峰值2.4×108个/mL, 3天后, 培养基中的浮游细胞浓度开始下降, 7天后浮游细胞浓度达到4.1×107个/mL,由此, 细胞进入衰亡期[19]。Zn试样上的固着细胞计数与培养基中浮游细胞计数规律一致。
图2显示了分别经过3天、7天的培养后, Zn样品上固着细胞的FM图像。经过3天培养的样品显示出大量的活细胞(绿点)。经过7天培养的样品上的活细胞减少并出现了大量的死细胞(红点)。此处的FM图像结果与图1中固着细胞计数结果一致。

图1 厌氧瓶中培养7天期间脱硫弧菌的浮游细胞计数(a)和Zn表面固着细胞计数(b)

图2 厌氧小瓶中培养3天(a)和7天(b)后的Zn表面脱硫弧菌固着细胞的FM图像
图3中的SEM图像显示了Zn试样表面的固着细胞形态和腐蚀产物形态, 可以看出, 在含有SRB的培养液中浸泡3天后, 样品表面附着了密集的杆状SRB细胞和腐蚀产物, 7天后, 腐蚀产物进一步增多, 腐蚀产物较为疏松。疏松的腐蚀产物不仅无法起到保护膜的作用, 反而对溶液中有机碳的扩散起到阻碍作用。当有机碳难以扩散至腐蚀产物膜与生物膜的混合膜底部时, 会导致混合膜底部的SRB无法从培养基中的有机碳源获得电子, 进而转向Zn获取自身所需电子, 从而促进对Zn试样的腐蚀。

图3 厌氧瓶中培养3天(a)和7天(b)后Zn表面脱硫弧菌生物膜和腐蚀产物膜的SEM图像
图4显示了带有腐蚀产物的试样的横截面图像。在无菌对照组中浸泡3天、7天后, 样品表面没有观察到腐蚀产物层。在含有SRB的培养基中浸泡3天后, 样品表面形成了40~50 μm的腐蚀产物层, 培养7天后厚度达到了70 μm, 腐蚀产物较为疏松且分布不均。图5中的XRD测试结果表明在有菌条件下腐蚀产物主要是ZnS。

图4 无菌条件下浸泡3天(a)和7天(b)后Zn的截面SEM图像; 脱硫弧菌培养基中浸泡3天(c)和7天(d)后Zn的截面SEM图像
去除生物膜和腐蚀产物后, 观察点蚀坑。如图6,在无菌对照组中浸泡3天、7天后, 在Zn试样表面均未发现明显的点蚀。在含有SRB的培养基中浸泡3天后, 样品表面变得粗糙, 并出现了较为分散的点蚀坑, 7天后, 样品表面粗糙度增加, 点蚀坑的密度和尺寸也明显增大。通过CLSM在Zn试样表面上测量的3D点蚀形态和最大凹坑深度如图7所示, 在无菌培养基中浸泡7天后, 在Zn试样表面未发现明显的点蚀。在含有SRB的培养基中浸泡3天后, 样品出现了较为分散的点蚀坑, 最大点蚀坑深度为30 μm, 7天后, 可以看到样品表面发生了严重的不均匀腐蚀, 最大点蚀坑深度达到了90 μm。
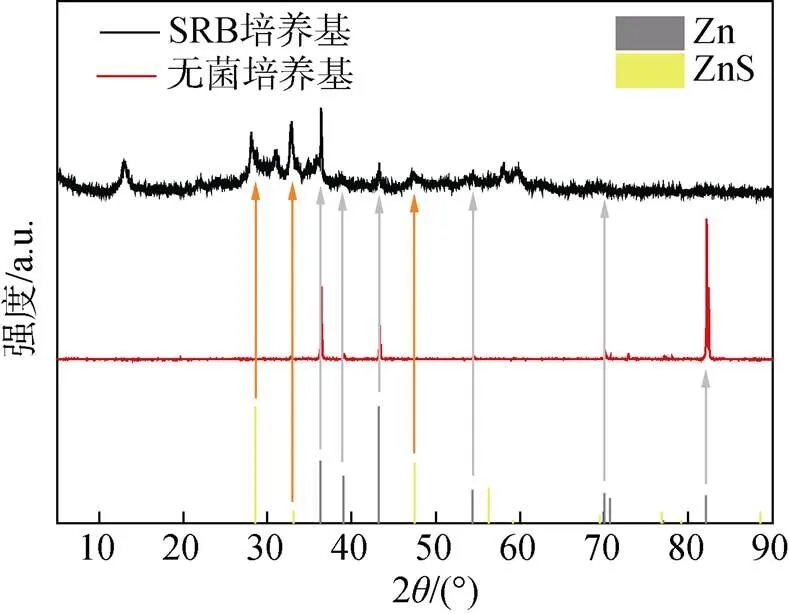
图5 无菌和有菌培养基中培养7天后Zn样品表面腐蚀产物的XRD图谱和对应的标准峰

图6 无菌条件下浸泡3天(a)和7天(b)并去除腐蚀产物后Zn试样表面的SEM照片; 脱硫弧菌培养基中浸泡3天(c)和7天(d)并去除生物膜和腐蚀产物后Zn试样表面的SEM照片
随着培养时间的增加, 无菌对照组的培养基pH值几乎没有变化。含有SRB的体系中, 由于SRB代谢过程中将SO42−还原成HS−[20], 部分HS−结合H+生成H2S从体系逸出到厌氧小瓶顶部空间, 导致pH由6.92上升到7.43[21](图8)。这期间pH值和培养基的初始值均处于中性, 因此, 在本实验中酸腐蚀不是影响因素。
图9显示的是在无菌培养基和含脱硫弧菌培养基中浸泡3天、7天后Zn试样的失重。在无菌条件下, Zn样品的失重可以忽略。在含有SRB的体系中浸泡3天后, Zn样品的失重为15.4 mg/cm2, 7天后, 失重增加至32.2 mg/cm2。这个结果与图7中的点蚀情况是相对应的。
图10显示了培养7天期间在无菌和SRB体系下Zn样品的OCP值随浸入时间的变化情况。从图中可以观察到, 在SRB的存在的情况下, OCP的值明显降低。在无菌对照培养基中, OCP的值由−831 mV缓慢正移至−793 mV。在含有SRB的培养基中, Zn样品的OCP值呈现先升高后降低的趋势, 第一天测量的OCP值为−974.5 mV, 第三天正移至−937.7 mV后开始负移, 五天后稳定在−1 000 mV左右。从热力学上讲, OCP的值越负意味着更加容易失去电子, 从而更容易发生腐蚀。
图11显示了培养7天内, 在无菌和SRB体系下Zn样品的极化电阻(p)值随浸入时间的变化情况。从图中可以看出, 实验组Zn样品的p值明显低于无菌对照组。在无菌对照培养基中,p值持续升高, 表明腐蚀速率的降低。在含有SRB的培养基中, 前4天p值逐步升高, 4天后降低, 并趋于稳定。
生物阴极催化硫酸盐还原理论[22]认为, 在SRB的代谢过程中, 有机碳源(例如乳酸盐)充当电子供体, 硫酸盐充当电子受体, 发生如下反应:

图7 无菌条件下浸泡3天(a)和7天(b)并去除腐蚀产物后Zn试样表面的CLSM照片; 脱硫弧菌培养基中浸泡3天(c)和7天(d)并去除生物膜和腐蚀产物后Zn试样表面的CLSM照片
CH3CHOHCOO−+ H2O → CH3COO−+ CO2+ 4H++ 4e−(1)
SO42−+ 9H++ 8e−→ HS−+ 4H2O (2)
反应(1)中的CO2+醋酸盐/乳酸盐还原电势可以用下面的能斯特方程表示[23]:

其中F代表法拉第常数, R代表气体常数,代表绝对温度,代表分压。SHE代表标准氢电极。
反应(2)中的硫酸盐的还原电势可以用以下方程表示[24]:


图8 厌氧瓶中培养7天期间无菌对照培养基和脱硫弧菌培养基的pH值

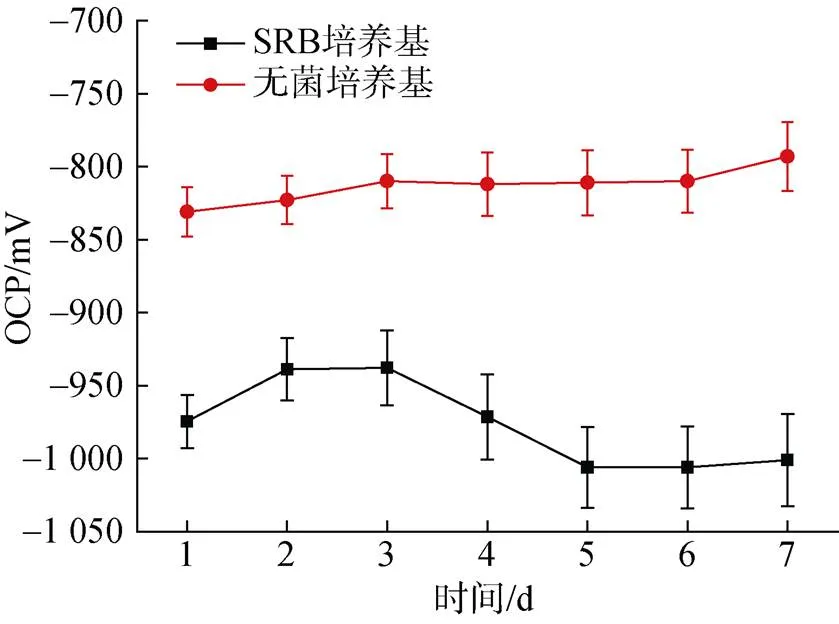
图10 厌氧瓶中培养7天期间无菌对照培养基和脱硫弧菌培养基中Zn的开路电位OCP值

当SRB细胞无法获得足够的有机碳源时, 可能会利用金属直接获取电子以供自身的呼吸作用随即引发胞外电子传输-微生物腐蚀(EET-MIC)[25-26]。
Zn2+/Zn反应方程和能斯特方程如下所示:
Zn → Zn2++ 2e−(3)

在25℃, 1 mol/L溶液(1 bar气体)条件下, 硫酸盐还原反应(2)与Zn氧化反应(3)的总反应电势cell= +0.545V > 0, 这说明硫酸盐的还原和Zn的氧化总反应在热力学上是一个自发的氧化还原反应过程, 这意味着Zn是能够为SRB的呼吸作用提供能量的。
p值的变化说明腐蚀速率先降低后升高, 这是因为前4天试样表面逐渐形成生物膜和腐蚀产物膜, 导致基体与溶液的界面电子传输速率降低, 4天后, 随着生物膜和腐蚀产物膜的累积, 溶液中的有机碳难以扩散至膜层底部, 处于膜底部的SRB难以通过溶液获取足够的能量, 从而转向Zn获取电子, 进一步加速Zn的腐蚀。
3 结论
本文研究了SRB导致Zn的腐蚀行为, 并对机理进行了探讨。将Zn试样分别在无菌和SRB培养基中浸泡7天后, 得出了以下结论:
(1) 失重及电化学测试结果表明SRB引起了Zn的平均腐蚀速率成倍增加, 点蚀形貌结果表明SRB引发了Zn的严重点蚀。
(2) 分析认为, 培养初期, 生物膜和腐蚀产物膜的混合膜层的累积导致了Zn基体与溶液界面电子传输速率的降低。培养后期, 因为混合膜层的阻碍作用, 导致膜层底部SRB缺乏碳源供给而转向金属Zn获取能量以维持自身的新陈代谢, 同时因为不均匀性混合膜层的作用, 导致p值在4天后的明显降低, 且点蚀程度加剧。
[1] Zhang P, Xu D, Li Y, et al. Electron mediators accelerate the microbiologically influenced corrosion of 304 stainless steel by thebiofilm[J]. Bioelectrochemistry, 2015, 101: 14-21.
[2] Li X, Zhang D, Liu Z, et al. Materials science: share corrosion data[J]. Nature, 2015, 527(7579): 441-442.
[3] Javaherdashti R. A review of some characteristics of MIC caused by sulfate reducing bacteria: past, present and future[J]. Anti-Corrosion Methods and Materials, 1999, 46: 173-180.
[4] Jacobson G A. Corrosion at Prudhoe Bay: a lesson on the line[J]. Materials Performance, 2007, 46(8): 26-34.
[5] 严莉, 王佳. 硫酸盐还原菌对海水状态和碳钢腐蚀行为的影响[J]. 海洋科学, 2004, 28(9): 70-74. Yan Li, Wang Jia. Effect of sulfate reducing bacteria on seawater state and marine corrosion of D36 carbon steel[J]. Marine Sciences, 2004, 28(9): 70-74.
[6] Lee W, Lewandowski Z, Nielsen P H, et al. Role of sulfate reducing bacteria in corrosion of mild steel: a review[J]. Biofouling, 1995, 8: 165-194.
[7] Liu H, Fu C, Gu T, et al. Corrosion behavior of carbon steel in the presence of sulfate reducing bacteria and iron oxidizing bacteria cultured in oilfield produced water[J]. Corrosion Science, 2015, 100: 484-495.
[8] 李言涛, 黄彦良, 侯保荣. 海洋环境下锌铝喷涂层防护性能研究[J]. 海洋科学, 2005, 29(7): 81-83. Li Yantao, Huang Yanliang, Hou Baorong. Experiments on the corrosion protection of thermal-sprayed Al and Zn coatings for offshore steel structure: a review[J]. Marine Sciences, 2005, 29(7): 81-83.
[9] 石磊. 金属Zn在NaCl溶液与NaOH溶液中的腐蚀磨损行为研究[D]. 青岛: 青岛理工大学, 2018. Shi Lei. Corrosive wear behavior of Zn in NaCl solution and NaOH solution[D]. Qingdao: Qingdao University of Technology, 2018.
[10] Videla H, Herrera L K. Microbiologically influenced corrosion: looking to the future[J]. International Microbiology, 2005, 8(3): 169-180.
[11] Monroe D. Looking for chinks in the armor of bacterial biofilms[J]. PloS Biology, 2007, 5(11): 2458-2461.
[12] Castaneda H, Benetton X D. SRB-biofilm influence in active corrosion sites formed at the steel-electrolyte interface when exposed to artificial seawater conditions[J]. Corrosion Science, 2008, 50(4): 1169-1183.
[13] 许昆明. 海洋生物膜的形成及其对金属腐蚀的影响[J].海洋科学, 2008, 32(9): 71-75.Xu Kunming. Marine biofilm formation and its effect on metal corrosion[J]. Marine Sciences, 2008, 32(9): 71-75.
[14] 赵伟, 苏璐璐, 段继周, 等. 天然海水中微生物膜对碳钢腐蚀行为的影响[J]. 海洋科学, 2012, 36(9): 24- 31. Zhao Wei, Su Lulu, Duan Jizhou, et al. Effect of biofilms on corrosion of carbon steel in seawater[J]. Marine Sciences, 2012, 36(9): 24-31.
[15] Dou W, Liu J, Cai W, et al. Electrochemical investigation of increased carbon steel corrosion via extracellular electron transfer by a sulfate reducing bacterium under carbon source starvation[J]. Corrosion Science, 2019, 150: 258-267.
[16] Dou W, Jia R, Jin P, et al. Investigation of the mechanism and characteristics of copper corrosion by sulfate reducing bacteria[J]. Corrosion Science, 2018, 144: 237-248.
[17] 孙成, 韩恩厚. 不同土壤湿度下硫酸盐还原菌对锌腐蚀的影响[J]. 中国有色金属学报, 2002, 12(6): 1109-1112. Sun Cheng, Han Enhou. Effects of SRB on corrosion of zinc in different humidity soils[J]. The Chinese Journal of Nonferrous Metals, 2002, 12(6): 1109-1112.
[18] ASTM International. Standard practice for preparing, cleaning, and evaluating corrosion test specimens[S/OL]. West Conshohocken, PA, 2017: ASTM G1-03(2017)e1 [2020-2-12]. www.astm.org.
[19] 朱永艳, 郑传波, 李言涛, 等. 海泥中硫酸盐还原菌数量变化对主要腐蚀环境因子的影响[J]. 海洋科学, 2006, 30(11): 37-40. Zhu Yongyan, Zheng Chuanbo, Li Yantao, et al. The change in corrosion parameter with SRB growth in sea mud[J]. Marine Sciences, 2006, 30(11): 37-40.
[20] Jia R, Tan J, Jin P, et al. Effects of biogenic H2S on the microbiologically influenced corrosion of C1018 carbon steel by sulfate reducingbiofilm[J]. Corrosion Science, 2018, 130: 1-11.
[21] Gu T, Xu D. Why are some microbes corrosive and some not?[J]. Corrosion, 2013, 2336: 17-21.
[22] Gu T, Zhao K, Nesic S. A new mechanistic model for MIC based on a biocatalytic cathodic sulfate reduction theory[C]. NACE-International Corrosion Series, 2009: 09390.
[23] Thauer R K, Stackebrandt E, Hamilton W A. Energy metabolism and phylogenetic diversity of sulphate reducing bacteria[M]. Cambridge, Cambridge University Press, 2007: 1-37.
[24] Xu D, Li Y, Song F, et al. Laboratory investigation of microbiologically influenced corrosion of C1018 carbon steel by nitrate reducing bacterium[J]. Corrosion Science, 2013, 77: 385-390.
[25] 夏进, 徐大可, 南黎, 等. 从生物能量学和生物电化学角度研究金属微生物腐蚀的机理[J]. 材料研究学报, 2016, 30(3): 161-170.Xia Jin, Xu Dake, Nan Li, et al. Study on mechanisms of microbiologically influenced corrosion of metal from the perspective of bioelectrochemistry and bio-energetics[J]. Chinese Journal of Materials Research, 2016, 30(3): 161-170.
[26] Gu T. New understandings of biocorrosion mechanisms and their classifications[J]. Journal of Microbial and Biochemical Technology, 2012, 4(4): iii-vi.
Investigation of zinc corrosion by sulfate-reducing bacteria in a neutral anaerobic environment
QUAN Yu, DOU Wen-wen, HAN Xiao-mei, PU Ya-nan, SONG Yi, CHEN Shou-gang
(School of Material Science and Engineering, Ocean University of China, Qingdao 266100, China)
In this work, we investigated Zn corrosion by(), a type of sulfate-reducing bacteria (SRB), by surface characterizations and electrochemical measurement. The experimental data indicated that the minimum inhibitory concentration (MIC) of Zn by the SRB increased the corrosion rate during a 7-day incubation period, with both uniform and pitting corrosions evident on the coupons. After 7 days of immersion, the presence ofcaused a weight loss in the Zn of 32.2 mg/cm2, which was 42 times larger than that occurring in sterile medium. The corrosion product was ZnS. In the initial stage of incubation, the accumulation of biofilms and corrosion-product films reduced the electron transfer between the metal and solution interface, resulting in a decreased MIC. In the middle and late stages of incubation, biofilms and corrosion-product films formed on the coupons, which resulted in carbon-source starvation. As such, SRB sessile cells were forced to use elemental zinc as a substitute for lactate as the electron donor to achieve sulfate reduction, thereby leading to a more severe MIC.
sulfate-reducing bacteria; microbiologically influenced corrosion; Zinc; pitting corrosion; neutral anaerobic
Mar. 5, 2020
TG172.5
A
1000-3096(2020)11-0028-08
10.11759/hykx20200305001
2020-03-05;
2020-04-08
中国博士后科学基金(2018M640655, 2019T120610); 国家自然科学基金(51572249, U1806223)
[the China Postdoctoral Science Foundation, No. 2018M640655; No. 2019T120610; National Natural Science Foundation of China, Nos. 51572249, U1806223]
全雨(1994—), 女, 山东省青岛人, 硕士研究生, 主要研究方向为微生物腐蚀, E-mail: daisyq777@163.com; 陈守刚(1974—),通信作者, 男, 博士, 教授, 主要研究方向为腐蚀与防护, 邮箱: sgchen@ouc.edu.cn; 窦雯雯(1987—), 通信作者, 女, 博士, 博士后, 主要研究方向为微生物腐蚀, 邮箱: dww@ouc.edu.cn
(本文编辑: 赵卫红)
