饲料中添加戊糖乳杆菌HC-2对黄曲霉毒素B1刺激下的凡纳对虾肝胰腺显微结构、基因表达及酶活性的影响
2020-02-07王宝杰蒋克勇
房 涵, 刘 梅, 王宝杰, 蒋克勇, 王 雷
饲料中添加戊糖乳杆菌HC-2对黄曲霉毒素B1刺激下的凡纳对虾肝胰腺显微结构、基因表达及酶活性的影响
房 涵1, 3, 刘 梅1, 2, 4, 王宝杰1, 2, 4, 蒋克勇1, 2, 4, 王 雷1, 2, 4
(1. 中国科学院海洋研究所 中国科学院实验海洋生物学重点实验室, 山东 青岛 266071; 2. 青岛海洋科学与技术国家实验室 海洋生物学与生物技术功能实验室, 山东 青岛 266237; 3. 中国科学院大学, 北京 100049; 4. 中国科学院 海洋大科学中心, 山东 青岛 266071)
为探究饲料中添加戊糖乳杆菌HC-2对黄曲霉毒素B1(AFB1)刺激下的凡纳对虾肝胰腺显微结构、基因表达及肝胰腺酶活性的影响, 将健康的凡纳对虾(900尾)随机分成三组, 分别投喂基础饲料、添加AFB1(500 μg/kg)饲料以及添加AFB1(500 μg/kg)+戊糖乳杆菌HC-2(5 × 108CFU/g)饲料6周。在试验结束后, 分别取三组对虾的肝胰腺进行显微观察以及免疫相关基因和肝胰腺酶活性的测定。AFB1+HC-2组肝胰腺组织同AFB1组相比损伤程度较轻。同对照组相比, AFB1组和AFB1+HC-2组的肝胰腺免疫基因的相对表达量均呈现显著下调(<0.05), 且同AFB1组相比, AFB1+HC-2组的免疫相关基因的相对表达量下调的较少(<0.05)。同对照组相比, AFB1组和AFB1+HC-2组的碱性磷酸酶活性(AKP)明显上升, 且AFB1+HC-2组的AKP活性要高于AFB1组。同对照组相比, AFB1组和AFB1+HC-2组中谷胱甘肽巯基转移酶(GST)活性明显升高但两组间无显著性差异, 超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性在AFB1组和AFB1+HC-2组间无显著性差异, 且三组的总抗氧化能力(T-AOC)无显著性差异。研究认为饲料中添加戊糖乳杆菌HC-2对AFB1刺激下的凡纳对虾肝胰腺组织结构有一定程度的保护作用, 对部分免疫基因和碱性磷酸酶活性有显著影响, 但对肝胰腺总抗氧化能力没有显著影响。
凡纳对虾; 戊糖乳杆菌HC-2; 黄曲霉毒素B1; 基因表达; 肝胰腺酶活
我国对虾养殖产量位居世界第一, 其中凡纳对虾()是养殖规模最大的对虾品种。但是在现代高密度集约化养殖过程中, 水环境、对虾种质、饲料品质以及病害等多方面因素常常造成对虾养殖业的严重损失。饲料受潮发霉产生的黄曲霉毒素是影响饲养生物的生长和健康的严重危害之一, 其中以黄曲霉毒素B1(AFB1)的危害尤为严重。黄曲霉毒素是黄曲霉和寄生曲霉的次生代谢产物, 广泛存在于贮存不当的发霉饲料和食品中[1-2]。饲料中的黄曲霉毒素污染, 特别是AFB1的高毒性, 导致养殖动物的产量和经济效益降低, 长期以来是水产养殖业特别关注的问题。
肝胰腺是虾类消化和免疫系统的主要器官, 根据对AFB1致癌作用的研究, 肝胰腺是代谢从外界摄入的AFB1的主要器官。肝胰腺主要功能与消化酶及免疫分子的合成与分泌、营养物质的吸收、贮藏和排泄有关[3]。益生菌在水产养殖和陆生动物中的应用, 可以显著提高养殖动物的存活率和生长性能[4-5], 戊糖乳杆菌HC-2是本实验室筛选的一株益生菌, 在之前的研究中发现其具有高黏附性和抗菌活性, 在虾肠内能够黏附和定殖并竞争性地消灭病原弧菌, 促进有益菌的生长, 增强免疫反应, 保护对虾免受病原体的侵害[6-7]。
目前益生菌在水产养殖中的研究多集中在其对养殖生物生长性能以及抗菌能力方面, 而益生菌对受AFB1影响的生物的保护作用机制的研究有所欠缺。本实验室前期工作中已分别对戊糖乳杆菌HC-2的益生作用以及黄曲霉毒素AFB1对对虾的损伤机理进行了较为深入的研究, 并发现添加HC-2可显著降低AFB1导致的对虾死亡率。本研究在前期工作基础上, 探讨益生菌在降低黄曲霉毒素对水产动物毒性损伤中的作用机制。通过观察对肝胰腺显微结构、分析对肝胰腺相关免疫基因表达及抗氧化酶活性的影响, 从组织、基因表达及生理层面上探究戊糖乳杆菌HC-2对在AFB1刺激下的凡纳对虾肝胰腺的影响, 为益生菌在水产养殖中的推广应用、降低黄曲霉毒素对水产养殖造成的损失提供理论依据和指导策略, 为对虾的健康养殖提供科学有效的数据。
1 材料与方法
1.1 实验动物及培养条件
实验所用的凡纳对虾均由青岛瑞兹海珍品有限公司提供, 900只健康对虾[(6.2±0.3) g]随机均分到9个水族箱(400 L), 分为3组, 所有对虾均暂养在盐度30.5, pH 7.5~8.0, 温度25~29℃, 溶解氧含量5.4~6.2 mg/L的天然海水中, 持续通气, 每日早晚换两次水, 每次换水量为50%, 投喂烟台大乐饲料有限公司生产的凡纳对虾饲料(42.3%的蛋白质, 7.2%的脂肪, 11.6%的水和15.5%的灰分)暂养1周。每日在6: 00、13: 00、20: 00进行投喂, 每日投喂量为体质量的5%。
1.2 实验饲料的制备及饲养管理
实验分为3组, 分别是对照组、AFB1组、AFB1+HC-2组, AFB1组的饵料以基础饲料添加黄曲霉毒素B1(500 μg/kg), 具体操作: 先将AFB1溶解于氯仿中, 加入鱼油混匀, 后置于37℃水浴中加热2 h以蒸发多余的氯仿, 再将含有AFB1的鱼油添加到饲料中。AFB1+HC-2组在AFB1组的基础上均匀喷洒戊糖乳杆菌HC-2菌悬液, 通过测定培养的戊糖乳杆菌HC-2的浓度, 根据5 × 108CFU/g浓度计算添加量, 然后离心后用海水吹悬喷洒在饲料中从而制成菌终浓度为5 × 108CFU/g的含菌饲料, 每周制备一次以保证菌的活力。对照组饲料在基础饲料的基础上添加同实验组等量的鱼油。三组饲料在4℃冰箱中贮存。每日在6: 00、13: 00、20: 00投喂, 每日投喂量为体质量的5%, 投喂6周后取样。
1.3 组织切片的制备
将对虾的肝胰腺组织放入10%福尔马林中固定24小时, 在一系列乙醇浓度梯度中脱水(50%~95%), 并嵌入石蜡中。切片后将组织部分(5 μm厚)用苏木精和伊红染色, 然后显微镜(奥林巴斯CKX41)观察分析肝胰腺结构。
1.4 基因表达的测定
在6周的养殖试验结束时, 从每个水族箱中取3只对虾, 将肝胰腺分离后取直径约5 mm的组织分别保存在装有RNA保护液的样品管中, 在4℃箱中保存12小时后, 移到–80℃冰箱中保存备用。
总RNA提取: 用TaKaRa MiniBEST Universal RNA Extraction Kit (大连宝生物工程有限公司)试剂盒提取肝胰腺组织总RNA, 操作步骤按说明书进行。用NanoDrop2000(Thermo)对所提取RNA进行检测, 用A260/280比测定RNA的质量。
RNA反转: 采用TransScript One-Step gDNA Re-moval and cDNA Synthesis Kit试剂盒(全式金生物科技有限公司)进行cDNA的合成, 操作步骤按说明书进行。反应条件: 42℃维持30 min, 85℃加热5 min, –80℃保存。
实时荧光定量PCR(qRT-PCR): 采用TransStar Top Green qRT-PCR Supermix(北京全式金生物科技有限公司)试剂盒进行相关基因表达的测定, 操作步骤按说明书进行。本研究使用的引物如表1所示,基因被用来作为内参基因。实验所用的引物由擎科生物技术有限公司合成(表1), 用2–ΔΔCt方法来计算分析基因的差异表达水平。

表1 荧光定量PCR分析所用引物及序列
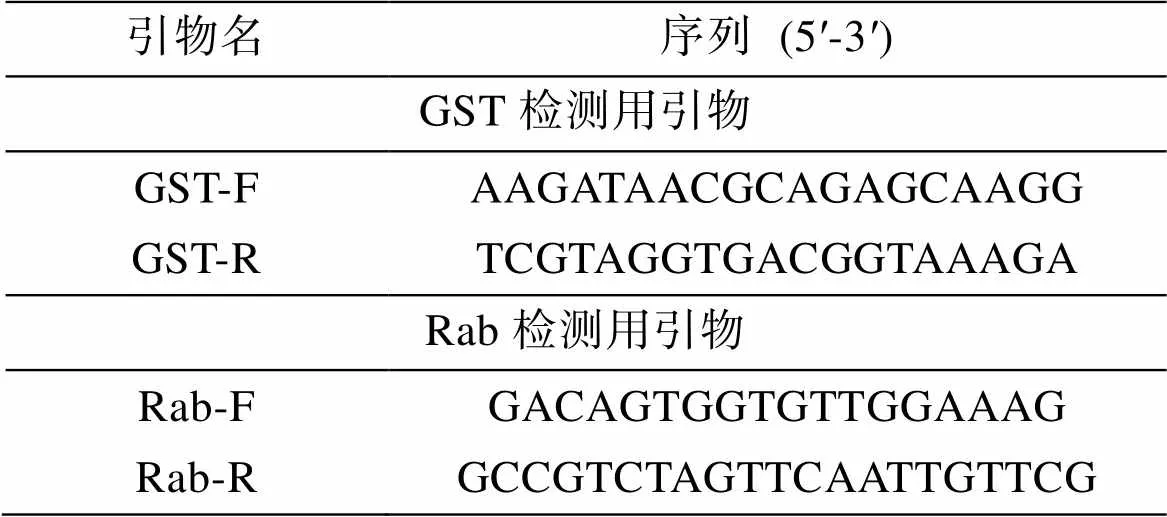
续表
1.5 抗氧化酶活的测定
在试验结束后每个水族箱分别取3只对虾肝胰腺混样, –80℃冰箱保存, 用于碱性磷酸酶(AKP)、总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性的测定。操作步骤按照酶活性测定试剂盒(南京建成生物工程研究所)说明书进行。
1.6 统计分析
数据均采用“平均值±标准差”表示。用SPSS 18.0统计软件中的单因素变量方差分析方法(One-Way ANOVA)对数据进行统计学分析。<0.05代表差异显著。
2 结果与分析
2.1 肝胰腺组织形态学分析
如图1所示,同对照组相比, 在AFB1组和AFB1+ HC-2组中对虾的肝胰腺出现组织学改变。在AFB1组中, 肝胰腺的肌上皮层与上皮细胞有明显的分离, 部分个体内腔星形多边形结构消失, 此外, 还出现空泡化细胞和细胞溶解。在AFB1+HC-2中, 也有部分细胞内腔星型多边形结构消失, 肝胰腺肌上皮层与上皮细胞分离, 但同AFB1组相比, 肝胰腺的损伤程度较轻。

图1 凡纳对虾肝胰腺的组织形态学分析
注: a: 对照组; b: AFB1组; c: AFB1+HC-2组。其中BM: 基膜; R: 存储单元; B: 分泌细胞; 三角形: 多灶性坏死伴组织丢失
2.2 肝胰腺免疫相关基因表达
如图2所示, 同对照组相比, AFB1组和AFB1+ HC-2组的肝胰腺免疫基因的相对表达量均呈现显著下调。同AFB1组相比, AFB1+HC-2组的免疫相关基因的相对表达量下调的较少, 而两组的免疫相关基因的相对表达量无显著性差异。
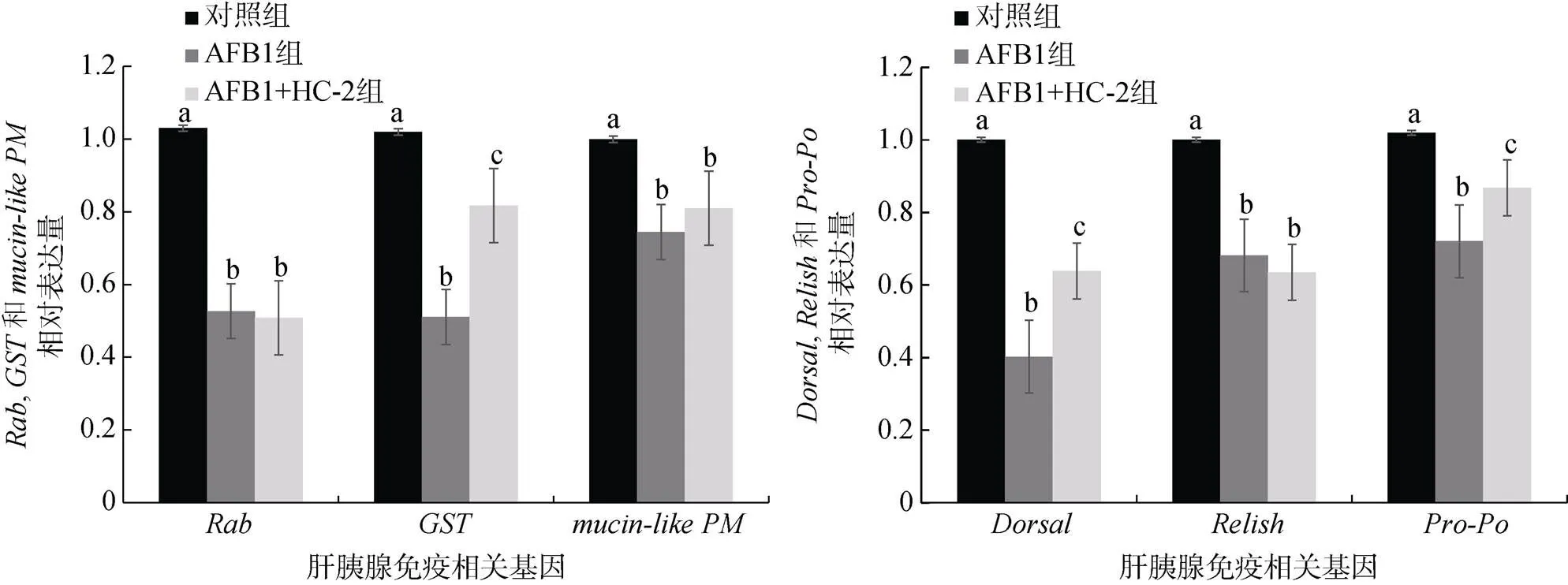
图2 肝胰腺相关免疫基因Rab、GST、mucin-like PM、Dorsal、Relish、Pro-PO的表达情况
注: 不同字母代表存在显著性差异(< 0.05)
2.3 肝胰腺酶活性变化
如图3所示, 同对照组相比, AFB1组和AFB1+ HC-2组的碱性磷酸酶活性(AKP)明显上升, 且AFB1+ HC-2组的活性要高于AFB1组。同对照组相比, AFB1组和AFB1+HC-2组中谷胱甘肽巯基转移酶(GST)活性明显升高, 而超氧化物歧化酶(SOD)活性同对照组相比没有显著性差异, 过氧化氢酶(CAT)活性同对照组相比明显下降, AFB1组和AFB1+HC-2组无显著性差异, 对照组和实验组的总抗氧化能力(T-AOC)没有显著性差异。
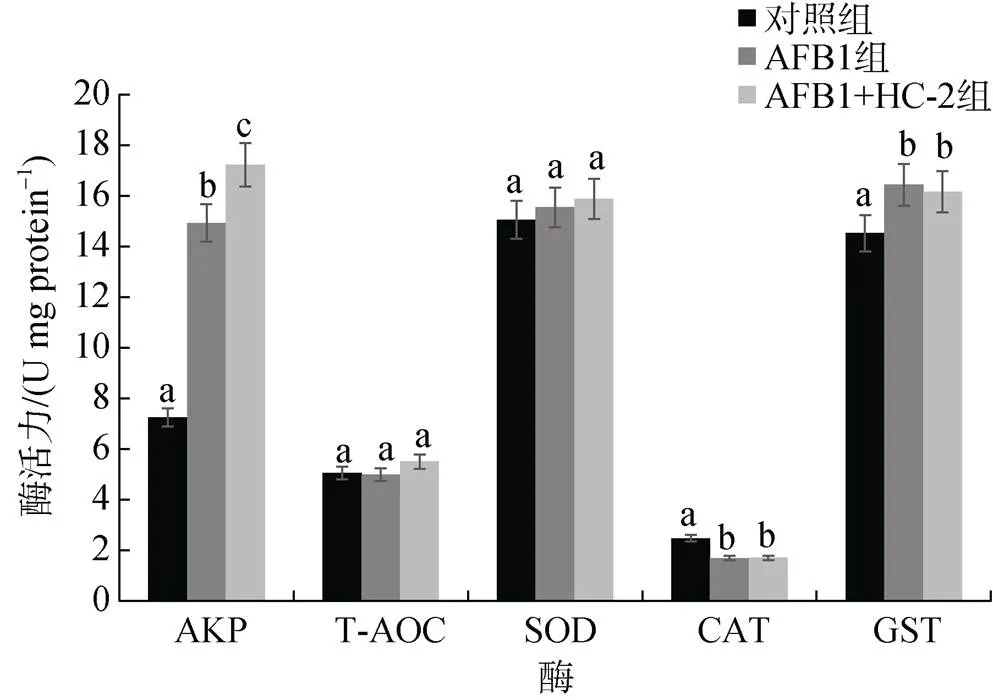
图3 肝胰腺酶活性变化
3 讨论
黄曲霉毒素B1在水产养殖中的影响是较为常见的, AFB1具有强致癌性、致畸性和免疫抑制作用, 往往会导致养殖生物产量和质量的下降, 摄入AFB1污染的食品, 对人类健康也构成潜在威胁[8-9]。目前, 关于AFB1在水产养殖方面的研究多集中在AFB1对养殖生物的毒性作用上, 但对如何降低AFB1对养殖生物的危害上研究较少。之前有研究表明, 戊糖乳杆菌HC-2可以在一定程度上增强凡纳对虾对病原菌的抵抗力[7], 但戊糖乳杆菌HC-2对在AFB1刺激下的水产生物是否有保护作用以及其作用机理尚未有研究。
肝胰腺是对虾主要的免疫器官, 也是黄曲霉毒素B1作用的靶器官, 在以往的研究中发现, 饲喂含AFB1(5 mg/kg)的饲料12天对凡纳对虾的肝胰腺组织有严重的损伤作用, 肝胰腺的肌上皮层与上皮细胞之间存在明显的分离, 腔内的储存细胞、分泌细胞和星形多边形结构均消失并坏死[10]。Yu等[11]发现饲喂AFB1(500 μg/kg)的饲料56天后, 凡纳对虾的肝胰腺分泌细胞的粗面内质网明显肿胀、囊泡化, 并且出现大液泡, 线粒体数量减少的现象。本研究发现AFB1破坏了肝胰腺组织结构, AFB1(500 μg/kg)组的凡纳对虾肝胰腺的肌上皮层与上皮细胞有明显的分离, 部分个体内腔星形多边形结构消失, 此外, 还出现空泡化细胞和细胞溶解。在AFB1(500 μg/kg)+HC-2 (5×108CFU/g)组中, 也有部分细胞内腔星型多边形结构消失, 肝胰腺肌上皮层与上皮细胞分离, 但损伤程度同AFB1组相比较轻, 说明戊糖乳杆菌HC-2在一定程度上减轻了AFB1所致的肝胰腺组织损伤。
Rab蛋白在细胞内转运、真核细胞外膜转运、吞噬体形成和成熟等过程中起重要作用[12]。Wu等[13]证明Rab蛋白可能在虾对病毒感染的免疫应答中发挥重要作用。Wang[10]等研究发现在饲喂AFB1(5 mg/kg) 后对虾的肝胰腺基因表达上调, 说明虾的免疫系统通过调节基因的表达来激活细胞吞噬过程。在本研究中, 同对照组相比,在AFB1(500 μg/kg)组和AFB1(500 μg/kg)+HC-2(5 × 108CFU/g)组中的表达量明显下调, 两组之间的表达量没有显著性差异, 与上述文献研究结果不同, 推测可能是由于本研究中投喂AFB1时间周期较长, 毒素的累积已经对对虾免疫系统造成损伤, 从而导致基因表达量下调。是一种围食膜因子, 是肠道化学屏障的重要组成部分[14]。是IMD通路下游的核转录因子, IMD通路是无脊椎动物用来抵御细菌和病毒的重要免疫通路[15]。Qi等[16]研究表明, 投喂凡纳对虾AFB1(15 mg/kg)后,基因表达量呈现先上升后下降的趋势。在本研究中, 同对照组相比, 肝胰腺和在AFB1(500 μg/kg)组和AFB1(500 μg/kg)+HC-2(5 × 108CFU/g)组中的表达量明显下调, 推测在长期投喂AFB1后, 对虾的部分免疫功能和IMD免疫通路受到损伤, 所以和表达量下调。
是Toll通路下游的核转录因子, 在某些特定条件下能够启动抗菌肽基因的转录[17]。Qi等[16]发现投喂AFB1(15 mg/kg)后, 凡纳对虾肠基因被显著诱导, 在第二天和第四天表达量最高, 并在之后出现回落的趋势。在本研究中, 同对照组相比,基因在AFB1(500 μg/kg)组和AFB1(500μg/kg)+ HC-2(5 × 108CFU/g)组中的表达量皆明显下调, 但相比较于AFB1+HC-2组, AFB1组的下调量较大, 推测在长期投喂AFB1后凡纳对虾的免疫通路Toll受到损伤, 因此基因表达量下调, 同时戊糖乳杆菌HC-2的添加对免疫通路Toll在一定程度上起到了保护作用。酚氧化酶原(Pro-PO)系统是一种包括模式识别蛋白、丝氨酸蛋白酶、丝氨酸蛋白酶抑制剂、酚氧化酶原等在内的酚化级联反应[18], 是甲壳动物的重要免疫防御系统, 在本研究中,基因基因在AFB1(500 μg/kg)组和AFB1(500 μg/kg)+HC-2(5×108CFU/g)组中的表达量皆明显下调, 但相比较于AFB1+HC-2组, AFB1组的下调量较大, 推测在长期投喂AFB1后凡纳对虾的酚氧化酶原系统受到损伤, 因此基因表达量下调, 同时戊糖乳杆菌HC-2的添加对酚氧化酶原系统在一定程度上起到了保护作用。由本实验结果推断, 在长期投喂AFB1后, 凡纳对虾的免疫系统受到了一定程度的损伤, 戊糖乳杆菌HC-2的添加对Toll通路和酚氧化酶原系统起到了一定的保护作用, 从而在一定程度上保护了对虾的肝胰腺组织。
机体的抗氧化能力依赖于机体的抗氧化酶系统, 当机体接触AFB1时, 在有氧代谢过程中会产生活性氧(ROS)的过表达, 造成氧化损伤, 氧化裂解是甲壳动物对抗产生大量ROS的入侵生物的重要防御机制, 活性氧在宿主防御中发挥重要作用[19], 但过量产生活性氧和残留活性氧会对细胞和组织造成严重损害, 为了保护自身免受ROS的伤害, 细胞已经形成了一套抗氧化防御系统, 几种重要的抗氧化酶包括SOD、CAT和GST等在保护细胞免受氧化应激和预防或修复氧化损伤方面具有重要作用[20-21]。Wang等[22]发现投喂凡纳对虾AFB1(5 mg/kg)30天内, 同对照组相比, 肝胰腺SOD、CAT和GST酶活性皆明显上升, 总体呈先上升后下降趋势, 原因可能是AFB1引发了凡纳对虾的抗氧化防御系统, 但随着AFB1的长期投喂引起了抗氧化系统的损伤。在本研究中, 对照组和实验组的SOD、T-AOC活性无显著性差异, 同对照组相比, 实验组CAT活性降低, 且AFB1组和AFB1+HC-2组CAT活性无显著性差异, AFB1组和AFB1+HC-2组的GST活性相较于对照组上升, 且两组间无显著性差异, 推测原因是AFB1激发GST抗氧化系统, 使得GST活性升高, 同时引起细胞内ROS含量增加, 当细胞内H2O2浓度超过CAT的清除能力时, CAT的构象转变为非活性稳定状态, 酶活性逐渐降低[23], 且戊糖乳杆菌HC-2的添加没有对受AFB1刺激下的凡纳对虾肝胰腺总抗氧化能力产生明显影响。碱性磷酸酶(AKP)是一种在碱性环境中催化磷酸酯水解, 参与转移磷酸集团, 同时作为动物溶酶体的重要组分, 在免疫反应中发挥重要作用[24]。当病毒感染对虾组织细胞后, 胞内肌质网膨大扩张甚至断裂, AKP阳性颗粒和AKP阳性反应的髓样小体在细胞质中被检测到[25]。何亚男等[26]研究表明, 半乳甘露寡糖、半乳甘露寡糖+乳酸菌能显著增加大鼠十二指肠及肠黏膜内AKP的活性, 碱性磷酸酶活性的增强表明小肠对营养物质吸收功能的增强。在本研究中, 同对照组相比, AFB1组和AFB1+HC-2组的碱性磷酸酶(AKP)活性明显升高, 且AFB1+HC-2组的活性要明显高于AFB1组, 推测原因可能是AFB1感染对虾后引发肝胰腺细胞免疫反应从而导致AKP活性升高, 同时戊糖乳杆菌HC-2的添加也增加了AKP的活性, 反映出戊糖乳杆菌HC-2可能主要通过激活免疫反应保护凡纳对虾的肝胰腺。
4 结论
本实验首次探究在饲料中添加戊糖乳杆菌HC-2对在AFB1刺激下的凡纳对虾肝胰腺组织、免疫基因及肝胰腺酶活性的影响。实验结果表明, 戊糖乳杆菌HC-2对在AFB1刺激下的凡纳对虾肝胰腺组织结构具有一定程度的保护作用, 并对某些免疫相关通路的基因进行调控, 对肝胰腺总抗氧化能力没有明显影响, 但对肝胰腺碱性磷酸酶活性有显著影响。由此推断: (1) 戊糖乳杆菌HC-2降低黄曲霉毒素AFB1对养殖对虾的毒害作用与其对肝胰腺的保护作用相关。(2) 该保护作用主要通过激活或保护肝胰腺的免疫应答而非抗氧化机能实现。本研究的结果为利用益生菌降低饲料及原料中AFB1对对虾的危害提供理论依据。
[1] Hathout A S, Aly S E. Biological detoxification of mycotoxins: a review[J]. Annals of Microbiology, 2014, 64(3): 905-919.
[2] Wingham G, Hawkins L, Williams W. Aflatoxin accumulation and kernel infection of maize hybrids inoculated withand[J]. World Mycotoxin Journal, 2010, 3(1): 89-93.
[3] Zhao W, Wang L, Liu M, et al. Transcriptome, antioxidant enzyme activity and histopathology analysis of hepatopancreas from the white shrimpfed with aflatoxin B1(AFB1)[J]. Developmental and Comparative Immunology, 2017, 74: 69-81.
[4] Wang A, Ran C, Wang Y, et al. Use of probiotics in aquaculture of China—a review of the past decade[J]. Fish & Shellfish Immunology, 2019, 86: 734-755.
[5] Zhang C, Zhang J, Fan W, et al. Effects of dietaryon growth performance, body composition, digestive and absorptive capacity, and gene expression of common carp (Huanghe var)[J]. Aquaculture Nutrition, 2019, 25(1): 166-175.
[6] Du Y, Zhou S, Liu M, et al. Understanding the roles of surface proteins in regulation ofHC-2 to immune response and bacterial diversity in midgut of[J]. Fish & Shellfish Immunology, 2019, 86: 1194-1206.
[7] Sha Y, Wang L, Liu M, et al. Effects of lactic acid bacteria and the corresponding supernatant on the survival, growth performance, immune response and disease resistance of[J]. Aquaculture, 2016, 452: 28-36.
[8] Deng S X, Tian L X, Liu F J, et al. Toxic effects and residue of aflatoxin B1 in tilapia (×) during long-term dietary exposure[J]. Aquaculture, 2010, 307(3-4): 233-240.
[9] Gon Alves R A, Do Cam T, Tri N N, et al. Aflatoxin B1 (AFB1) reduces growth performance, physiological response, and disease resistance in Tra catfish ()[J]. Aquaculture International, 2018, 26(3): 921-936.
[10] Wang Y, Wang B, Liu M, et al. Comparative transcriptome analysis reveals the different roles between hepatopancreas and intestine ofin immune response to aflatoxin B1(AFB1) challenge[J]. Comparative Biochemistry and Physiology Toxicology & Pharmacology: CBP, 2019, 222: 1-10.
[11] Yu Y Y, Niu J, Yin P, et al. Detoxification and immunoprotection of Zn(II)-curcumin in juvenile Pacific white shrimp () feed with aflatoxin B1[J]. Fish & Shellfish Immunology, 2018, 80: 480-486.
[12] Zong R, Wu W, Xu J, et al. Regulation of phagocytosis against bacterium by Rab GTPase in shrimp[J]. Fish & Shellfish Immunology, 2008, 25(3): 258-263.
[13] Wu W, Zhang X. Characterization of a Rab GTPase up-regulated in the shrimpby virus infection[J]. Fish & Shellfish Immunology, 2007, 23(2): 438-445.
[14] Kim Y S, Ho S B. Intestinal goblet cells and mucins in health and disease: recent insights and progress[J]. Current Gastroenterology Reports, 2010, 12(5): 319-330.
[15] Li F, Xiang J. Signaling pathways regulating innate immune responses in shrimp[J]. Fish & Shellfish Immunology, 2013, 34(4): 973-980.
[16] 齐灿灿, 王宝杰, 刘梅, 等. 黄曲霉毒素B1(AFB1)的短期投喂对凡纳滨对虾肠道黏膜屏障的影响[J]. 水产学报, 2017, 12(41): 1936-1945.Qi Cancan, Wang Baojie, Liu Mei, et al. Effects of short term addition of aflatoxin B1(AFB1) on the intestinal mucosal barrier of[J]. Journal of Fisheries of China, 2017, 12(41): 1936-1945.
[17] 刘甜, 罗开珺. 果蝇Toll和IMD信号通路中的功能结构域[J]. 环境昆虫学报, 2011, 3(33): 388-395.Liu Tian, Luo Kaijun. Immunity-related domains of Toll and IMD signaling pathways in[J]. Journal of Environmental Entomology, 2011, 3(33): 388-395.
[18] Sritunyalucksana K, Soderhall K. The proPO and clotting system in crustaceans[J]. Aquaculture, 2000, 1-3(191): 53-69.
[19] Liu Y, Wang W. Aflatoxin B1 impairs mitochondrial functions, activates ROS generation, induces apoptosis and involves Nrf2 signal pathway in primary broiler hepatocytes[J]. Animal Science Journal, 2016, 87(12): 1490-1500.
[20] Bandyopadhyay U, Das D, Banerjee R. Reactive oxygen species: Oxidative damage and pathogenesis[J]. Current Science, 1999, 77(5): 658-666.
[21] Wang W N, Zhou J, Wang P, et al. Oxidative stress, DNA damage and antioxidant enzyme gene expression in the Pacific white shrimp,when exposed to acute pH stress[J]. Comparative Biochemistry and Physiology Toxicology & Pharmacology: CBP, 2009, 150(4): 428-435.
[22] Wang Y, Wang B, Liu M, et al. Aflatoxin B1(AFB1) induced dysregulation of intestinal microbiota and damage of antioxidant system in pacific white shrimp ()[J]. Aquaculture, 2018, 495: 940-947.
[23] Pasquali M A B, Gelain D P, Oliveira M R, et al. Vitamina supplementation induces oxidative stress and decreases the immunocontent of catalaseand superoxide dismutase in rat lungs[J]. Experimental Lung Research, 2009, 35(5): 427-438.
[24] Yukio Y, Eizo N et al. Comparative studies on particulate acid phosphatases in sea urchin eggs[J]. Comparative Biochemistry and Physiology, 1982, 71B: 563-567.
[25] 孙静秋, 许燕, 张慧绮, 等. 凡纳对虾体内ACP、AKP酶的细胞化学定位[J]. 复旦学报(自然科学版), 2007, 46(6): 947-951.Sun Jingqiu, Xu Yan, Zhang Huiqi, et al. Study on cytochemical location of acid phosphatase and alkaline phosphatase of[J]. Journal of Fudan University (Natural Science), 2007, 46(6): 947-951.
[26] 何亚男, 佘锐萍, 吴襟, 等. 半乳甘露寡糖和壳寡糖对大鼠肠黏膜结构、碱性磷酸酶活性影响的动态观察[J]. 科学技术与工程, 2006, 2(6): 131-135.He Yanan, She Ruiping, Wu Jin, et al. Effects of Galactomanno oligosaccharides and oligochitosan on the structure of gut mucosa and the activity of AKP in rats[J]. Science Technology and Engineering, 2006, 2(6): 131-135.
Effects ofHC-2 on the morphology of hepatopancreas, immunity-related genes, and enzyme activity ofaffected by aflatoxin B1
FANG Han1, 3, LIU Mei1, 2, 4, WANG Bao-jie1, 2, 4, JIANG Ke-yong1, 2, 4, WANG Lei1, 2, 4
(1. CAS Key Laboratory of Experimental Marine Biology, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China; 3. University of Chinese Academy of Sciences, Beijing 100049, China; 4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China)
To explore effects ofHC-2 on the hepatopancreas morphology, immune-related genes, and enzyme activity ofaffected by aflatoxin B1 (AFB1), shrimps were fed with formulated feeds containing AFB1 (500 μg/kg), AFB1 (500 μg/kg) +HC-2 (5 × 108CFU/g), and a basal commercial diet (control group) respectively. At the end of the experiment, the morphology of the hepatopancreas, expression of immune-related genes, and activity of hepatopancreas enzymes were detected. The hepatopancreas morphology of the AFB1 +HC-2 group suffered less damage than that of the AFB1 group. The relative expression of immune-related genes (Rab, glutathione S-transferase [GST], mucin-like PM, Dorsal, Relish, and Pro – PO) in the AFB1 and AFB1 + HC-2 groups was significantly lower than in the control group (<0.05), and the relative expression of immune-related genes (GST, Dorsal, and Pro – PO) in the AFB1+HC-2 group was higher than in the AFB1 group (<0.05). The activity of alkaline phosphatase (AKP) increased significantly in the AFB1 and AFB1+HC-2 groups compared with that in the control group, and the activity of AKP in the AFB1+HC-2 group was higher than in the AFB1 group. The activity of GST increased in the AFB1 and AFB1+HC-2 groups compared with that in the control group, and there was no significant difference in the AFB1+HC-2 and AFB1 groups. The activity of superoxide dismutase and catalase has no significant difference between the AFB1 and AFB1+HC-2 groups, and the total antioxidant capacity (T-AOC) has no significant difference between the control and experimental groups. We concluded thatHC-2 had a positive effect on the hepatopancreas structure of shrimps stimulated by AFB1 and induced a significant effect on some immune genes and AKP activity but had no significant effect on the T-AOC of the hepatopancreas.
HC-2aflatoxin B1; gene expression; enzyme activity of hepatopancreas
Mar. 12, 2020
S968.22
A
1000-3096(2020)11-0065-07
10.11759/hykx20200312002
2020-03-12;
2020-03-18
国家重点研发计划课题(2019YFD0900401);山东省重大科技创新工程专项课题(2018SDKKJ0502-2)
[Supported by National Key R&D Program of China, No. 2019YFD0900401; Major Scientific and Technological Innovation Project, Shandong Province, China, No. 2018SDKJ0502-2]
房涵(1994-),女,山东潍坊人,硕士研究生,主要从事水产养殖病害防控的研究,电话:0532-82898723,E-mail:fanghana163@ 163.com;王雷(1966-),通信作者,E-mail:leiwang@qdio.ac.cn
(本文编辑: 杨 悦)
