不同紫外波段对中肋骨条藻光合生理特性的影响
2020-02-07朱镕军高嘉钰吴亚平徐军田
朱镕军, 高嘉钰, 吴亚平, 徐军田, 2, 3
不同紫外波段对中肋骨条藻光合生理特性的影响
朱镕军1, 高嘉钰1, 吴亚平1, 徐军田1, 2, 3
(1. 江苏海洋大学 江苏省海洋生物资源与环境重点实验室, 江苏 连云港 222005; 2. 江苏省海洋生物技术产业协同创新中心, 江苏 连云港 222005; 3. 江苏海洋大学 江苏省海洋生物技术重点实验室, 江苏 连云港 222005)
人类活动导致臭氧层变薄和混合层变浅, 迫使混合层的浮游植物暴露在更高的紫外辐射下。实验以中肋骨条藻()为研究对象, 在自然光照条件下, 通过在暗盒上方覆盖不同的截止型滤光板, 获得不同波段紫外辐射, 探讨不同紫外波段对其生理特性的影响。本实验通过在室外培养, 模拟赤潮爆发状态, 对中肋骨条藻进行7种不同紫外波段的处理(分别使用280、300、320、340、360、380、400 nm截止型滤光板)。实验结果表明: 紫外辐射会显著抑制中肋骨条藻的光合固碳速率, 随着紫外波段逐步被滤除, 光合固碳速率越来越高; >280 nm和>300 nm波段下的比生长率显著低于>400 nm波段处理; 280 nm~300 nm波段紫外对叶绿素有显著的漂白效应, 同时也会显著减少类胡萝卜素的含量;这表明紫外辐射对中肋骨条藻的抑制效应主要是紫外辐射B导致的, 而紫外辐射A的作用不显著。在估测浮游植物海洋初级生产力的过程中, 紫外辐射的作用往往被忽视。
光合固碳速率; 生长; 色素; 中肋骨条藻(); 紫外波段
紫外辐射(100 nm~400 nm)是太阳光谱的重要组成部分, 然而能够到达地球表面的紫外辐射只有UV-A(320 nm~400 nm)和UV-B(280 nm~320 nm)。尽管太阳辐射中UV-A和UV-B所占的比例较小, 但由于其单位光子具有更高的能量, 仍然对地球上的生物和生态环境产生了巨大影响[1]。人类活动导致的臭氧层破坏, 使到达地球表面的紫外辐射强度增加[2]。而全球变暖会导致海水混合层变浅, 将使得浮游植物暴露于更高的紫外辐射下[3]。紫外辐射对自然水域的穿透力取决于辐射强度、反射率和水体固有的光学特征等因素。在近岸海域, 紫外辐射可以照射到几十米深的水体中; 在清澈的远海, 紫外辐射甚至到达水下几百米。在这一区域的大多数生物都会暴露于紫外辐射下, 特别是在太阳辐射剧烈的中午。
大量研究表明, 紫外辐射对浮游植物具有多重胁迫作用。其会抑制浮游植物的碳同化[4], 破坏浮游植物DNA和蛋白质结构[5, 6], 甚至会改变浮游植物的形态[7]。紫外辐射还会使藻体产生更多的自由基[8, 9], 降低细胞活性, 甚至导致细胞死亡[10]。然而, 适当强度的UV-A(315 nm~400 nm)可以促进浮游植物群落和大型海藻的光合固碳[11, 12], 并提高硅藻中碳酸酐酶的活性, 有助于硅藻对碳酸氢盐的利用。另外, 低剂量的UV-A还可以促进DNA的损伤修复[13]。
不同波长的紫外辐射对生物的影响也不尽相同。波长越短, 具有的能量越高, 对生物体的损伤越大[14]。在一天当中, 紫外辐射的强度在不同时间也不相同。前期研究主要关注浮游植物对UV-A、UV-B和PAR 3个波段的响应, 而将紫外辐射细分成不同波段进行研究的目前较少。因此, 作者以中肋骨条藻()为实验材料, 通过覆盖不同光学特性的滤光板, 探究不同波段紫外辐射对中肋骨条藻光合生理的影响。
1 材料与方法
1.1 实验材料
本实验所用的中肋骨条藻来自江苏省连云港市高公岛(34°42′36″N, 119°29′24″E), 在实验室分离纯化后用过滤灭菌的自然海水(f/2培养基)培养至对数期用于实验。
1.2 实验设计
实验在实验室楼顶实验区进行。通过7种截止型滤波板(ZJB280、ZJB300、ZJB320、ZJB340、ZJB360、ZJB380和JB400), 分别滤除280、300、320、340、360、380和400 nm前的太阳光波段(图1), 获得不同波段的辐射处理。滤波板覆盖于周围和底部不透光暗盒上方, 暗盒中放置35 mL石英管, 每种紫外波段处理设置3个平行。所有处理的暗盒置于控温水槽中, 温度控制在20℃左右。为避免高光强的影响, 也同时模拟中肋骨条藻在近海水域中接受的实际光强, 水槽上方覆盖一层黑色中性网, 让藻细胞接受50%的自然光强。中肋骨条藻采用过滤灭菌的自然海水(f/2培养基)培养, 在实验区预先培养1周, 然后将藻稀释到5 000 个/mL, 开始正式实验。

图1 不同截止型滤光板(从左至右依次为ZJB280, ZJB300, ZJB320, ZJB340, ZJB360, ZJB380, JB400)的透光特性
1.3 生长速率测定
在培养期间每天取样测定藻细胞的浓度变化, 通过下列公式计算中肋骨条藻比生长率:
=(lnN– ln0)/
公式中N即培养数天后藻液的浓度;0即藻液初始浓度;即培养天数。
1.4 太阳辐射测定
利用太阳能辐射记录仪(SOLAR-1, 天诺环能, 中国)测定每天的日辐射变化, PAR(400 nm~700 nm)、UV-A(320 nm~400 nm)和UV-B(280 nm~320 nm)。仪器每秒取一个UV-A、UV-B 和PAR值, 然后将1 min内取得的值平均并记录到电脑。
1.5 光合固碳速率测定
中肋骨条藻的光合固碳速率由密闭石英管中无机碳浓度变化的差值计算得到。具体过程为: 在中午时段开始实验, 在不同辐射处理下照射1 h, 通过无机碳分析仪(multi N/C 3100, Yena, Germany)测定实验前后的无机碳含量。利用以下公式[15]计算藻的碳固定速率:
碳固定速率=Δ×/(×)
其中, Δ是初始藻液无机碳含量与照射处理之后藻液中无机碳含量之差(mg);是海水量( mL);是藻细胞数目;是辐射时间。
1.6 叶绿素含量的测定
从每个处理中取出15 mL藻液, 过滤到GF/F膜上, 放入离心管中, 加入5 mL甲醇, 4 ℃下黑暗提取24 h, 离心(4 000, 20 min)取上清, 用分光光度计测定吸光值, 计算色素含量。通过下列公式计算叶绿素(Chl)[16]和类胡萝卜素()[17]的含量:
Chl(μg/mL)=16.29×A665–8.54×A652
(μg/mL)=4×A480
公式中A665、A652、A480为665、652、480 nm处的吸光值减去750 nm处的值。
1.7 数据处理
紫外辐射单位相对抑制率:
In(%)=(PAR–UVx)/PAR×100%
其中,PAR代表在PAR下的光合固碳速率;UVx代表在不同UV辐射下的光合固碳速率。不同紫外波段的抑制率是通过相邻滤光板下的抑制率相减得到。
在网站(http: toms.gsfc.nasa.gov)上查询实验期间当地臭氧浓度, 使用STARSci[18]软件积分不同波长(280~300, 300~320, 320~360, 360~380, 380 nm~ 400 nm)的紫外辐射得到理论值。然后, 根据太阳能辐射记录仪(SOLAR-1, 天诺环能, 中国)记录得UV-A和UV-B辐射强度, 得出实际UV-A、UV-B与理论值的比例, 从而将不同波段的紫外辐射校正得到实际值。最后, 将不同紫外辐射波段下的抑制率除以该波段下的紫外辐射强度(mW/m2), 得到该波段紫外辐射得加权抑制率(单位光强相对抑制率)。
以不同波段的中值为横坐标, 加权抑制率为纵坐标, 拟合公式:=aX+bX+c+d, 拟合得到单位光能抑制率。
所有实验数据利用Microsoft Excel、OriginPro9.0、PASWStatistics18等软件进行数据分析, 利用检验、方差分析、重复性度量分析、非线性拟合等方法对实验数据进行处理并制作图表, 设显著性水平为0.05。
2 结果
2.1 太阳辐射
实验期间大部分时间为少云天气。一天当中, 太阳辐射的强度如图2所示: UV-B、UV-A和PAR的强度在中午时达到最大值, 分别为5.16、126.34、1 172.97 μmol/(photons/(m2·s))。试验期间UV-B、UV-A和PAR的平均强度分别为2.13、52.98、531.34 μmol/(photons/ (m2·s))。

图2 实验期间平均日辐射量(UV-A、UV-B、PAR)变化
2.2 光合固碳速率
从图3中可以看出, 滤光板每滤除一部分紫外辐射, 中肋骨条藻的光合固碳速率都会显著升高(<0.05), 说明每个波段的紫外辐射都显著抑制了中肋骨条藻的光合固碳速率。波长较短的UV-B对中肋骨条藻光合固碳抑制明显高于UV-A。覆盖ZJB280滤光板(280 nm~700 nm)的处理光合固碳速率只有3.95 pg/(cell·h), 然而覆盖JB400滤光板(400 nm~ 700 nm)的处理光合固碳速率达到28.29 pg/(cell·h)。
2.3 比生长速率
波长越短, 能量越高。虽然UV-B强度较低, 但是其显著降低了中肋骨条藻的比生长速率。如图4所示, 280、300和400 nm处理下的比生长率差异显著(<0.05), 280 nm处理下的比生长率为1.72/d, 300 nm处理下的比生长率为1.73/d, 400 nm处理下的比生长率为1.81/d。
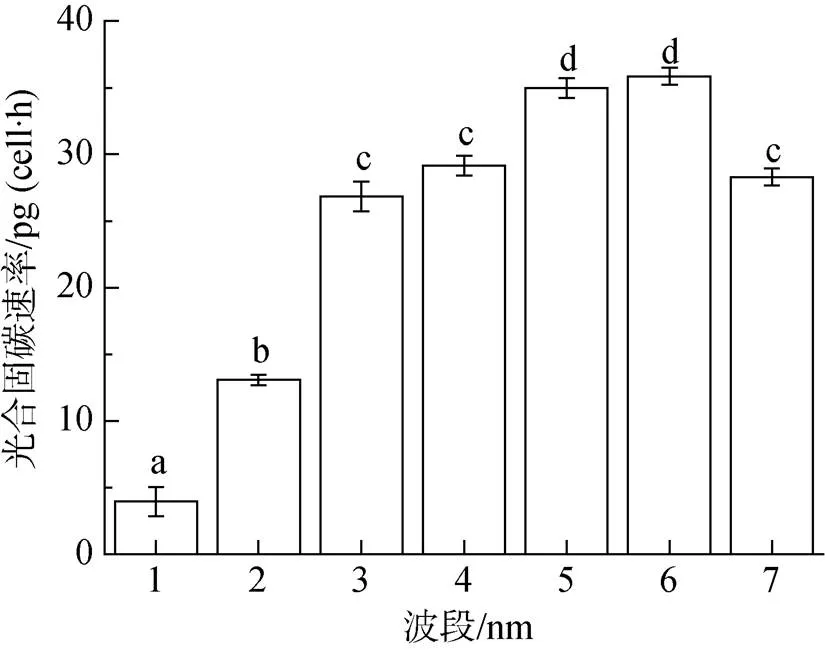
图3 不同太阳辐射处理(分别接受大于280、300、320、340、360、380、400 nm)下中肋骨条藻光合固碳速率
竖线代表标准偏差,=3;图4~图6同
The vertical line represents the standard deviation,= 3, the same as figs.4-6

图4 不同太阳辐射处理(分别接受大于280、300、320、340、360、380、400 nm的光谱)下, 中肋骨条藻比生长率
2.4 紫外辐射作用光谱
通过紫外辐射作用光谱(Biological weighting function, BWF)可以看出(图5), 不同波段的紫外辐射对中肋骨条藻的影响差异很大, 波长越短的紫外辐射对中肋骨条藻的光合固碳抑制能力越强。280~300、300~320、320~360、360~380、380 nm~400 nm波段的平均单位光能抑制率分别为0.009、2.29×10–5、6.15×10–5、1.81×10–5、2.58×10–5。通过拟合发现, 280 nm的紫外辐射对中肋骨条藻的光合固碳抑制率最高。随着波段的增加, 紫外辐射的抑制率迅速降低, 随后变的稍微平坦, 380 nm之后继续降低。最大抑制率与最小抑制率相差达到约4 000倍。

图5 单位波长的紫外辐射对中肋骨条藻光合固碳速率的抑制作用
虚线表示95%的置信度,=3
The dotted line represents 95% confidence level,= 3
2.5 叶绿素含量
不同波段处理对中肋骨条藻细胞色素含量也产生明显影响(图6)。280、340处理与400 nm处理的叶绿素含量差异显著(<0.05), 280 nm处理下叶绿素的含量为0.148 pg/cell, 为所有处理中的最低值; 340 nm处理下叶绿素的含量为0.155 pg/cell; 400 nm处理下叶绿素的含量为0.192 pg/cell, 为所有处理中的最高值, 其余处理之间无显著性差异(>0.05)。280、300、320、340、360与400 nm下类胡萝卜素的含量也具有显著性差异(<0.05), 280 nm处理下类胡萝卜素的含量为0.090 pg/cell,为所有处理中的最低值; 400 nm处理下类胡萝卜素的含量为0.128 pg/cell, 为所有处理中的最大值。
3 讨论
本研究发现紫外辐射对中肋骨条藻的叶绿素含量、生长和光合固碳均起到负面效应, 这主要是由于天气晴朗(可见光和紫外辐射较强), 紫外辐射较高有关[19]。实验期间, UV-A的强度约是UV-B的25倍。尽管UV-B强度远小于UV-A, 但是UV-B依然对中肋骨条藻的生理产生了显著的影响。在不同季节水体中, UV-A和UV-B对的抑制率也不相同。在冬春季节, UV-A的抑制率要大于UV-B; 在太阳辐射剧烈的夏季, 在海水表层UV-B抑制率大于UV-A[20]。中肋骨条藻对UV-B敏感, 但是对UV-A的作用不显著, 这是由于短波长的UV-B具有更高的能量。UV-B比UV-A更能损伤DNA和蛋白质, 这些生物大分子在UV-B处有强烈的吸收峰。
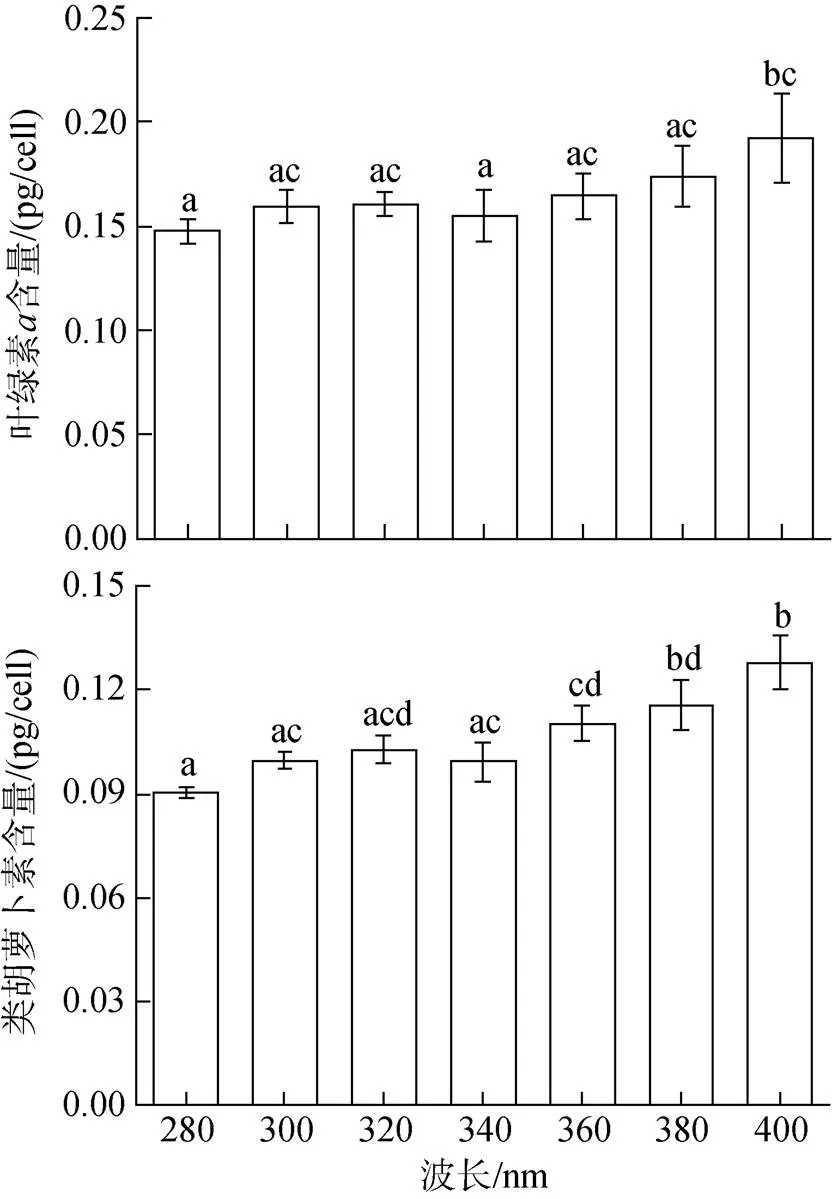
图6 不同太阳辐射处理(分别接受大于280、300、320、340、360、380、400 nm)下中肋骨条藻色素含量
UV-A的强度是UV-B的24.86倍, 但是UV-B对中肋骨条藻光合固碳的抑制率显著大于UV-A。280 nm~300 nm波段紫外辐射的抑制率最高, 随着波段的增加, 紫外辐射对中肋骨条藻的抑制作用明显降低, 这表明长波段的紫外辐射对中肋骨条藻的抑制作用较低。通过拟合发现, 短波长(280 nm)的紫外辐射对中肋骨条藻的光合固碳抑制率是长波长(400 nm)的4 000多倍。臭氧层是大气中唯一能够吸收部分UV-B辐射(280 nm~320 nm)的气体[21], 臭氧浓度的降低最有可能导致地球表面的UV-B辐射增加, 尤其是波长短于290 nm的紫外辐射。在未来, 臭氧层破坏导致UV-B辐射量的增加, 全球变化导致的海水混合层变浅, 迫使中肋骨条藻暴露在更加强烈的UV-B下, 这会加剧影响赤潮藻的规模和爆发频率。
室外紫外实验中UV-B和UV-A对叶绿素均有抑制作用[22]。在室内利用太阳模拟器的短期紫外实验中UV-B对叶绿素有显著的损害, 而UV-A能够提高类胡萝卜的含量[23]。UV-B中的280 nm~300 nm波段和UV-A中的340 nm~360 nm波段抑制了叶绿素的合成, 这可能与微藻对紫外的响应机制有关。UVR尤其是UV-B会破坏光系统Ⅱ的D1蛋白, 从而影响光反应电子传递, 叶绿素吸收光而激发的高能电子无法顺利传递出去, 积累的高能量使叶绿素卟琳环发生光氧化-开环, 从而破坏叶绿素。实验中UV-B和UV-A中的320 nm~380 nm波段对类胡萝卜素均有抑制作用。类胡萝卜素在光合作用中帮助微藻细胞抵抗过高的光强, 起到光保护作用。短期实验中类胡萝卜素提高可能是因为短期的强光诱发了微藻的光保护机制, 促进了类胡萝卜素的合成。而长期实验中微藻在晴天时对紫外的适应使细胞不需要合成大量的类胡萝卜素, 甚至抑制它的合成。
人类活动加剧了全球变化, 尽管臭氧层破坏得到了有效控制, 但是全球变化过程中, 臭氧从平流层到对流层的加速运动导致紫外辐射强度变化。据预测, 本世纪末, 高纬度地区的紫外辐射(特别是北极地区)将减少5%~10%, 低纬度地区(特别是热带地区)的紫外辐射将增加3%~8%[24]。因此, 地球上的生物受到的紫外辐射的胁迫将增加。在实验中, 紫外辐射对中肋骨条藻的生长、叶绿素含量和光合固碳造成了明显的抑制作用。室外培养和自然界的中肋骨条藻, 甚至其他浮游植物, 对紫外辐射具有一定的抗性, 室内培养的中肋骨条藻对短波长的紫外辐射将更加敏感[24]。
目前, 绝大多是实验都是在实验室中完成的, 但是, 由于光源和透光材料的限制, 大多数实验研究都忽略了紫外辐射对光合作用的影响。有研究发现, 使用不同材质的培养容器, 透光性各不相同, 使得测得的光合固碳速率的可比性降低, 无法还原原位真实的情况[25]。紫外辐射影响的不仅仅是藻类的光合作用, 它还影响藻类的基因表达和蛋白质合成等一系列复杂的生理生化反应。在自然界中, 紫外辐射会随着水的深度降低, 尤其是短波长的UV-B衰减的更快, 因此还需要结合光强和光合作用的关系, 以此来估测初级生产力[25]。通过研究紫外不同波段对中肋骨条藻生理特性的影响, 结合水体中光谱分布, 可以估测紫外辐射对不同水层中中肋骨条藻生理特性的影响, 为更加准确地估测其初级生产力提供可能[26]。
[1] Hader D, Kumar H, Smith R, et al. Effects of solar UV radiation on aquatic ecosystems and interactions with climate change[J]. Photochemical & Photobiological Sciences, 2007, 6(3): 267-285.
[2] Shanklin J. Reflections on the ozone hole[J]. Nature, 2010, 465(7294): 34-35.
[3] Doney S C. Oceanography: Plankton in a warmer world[J].Nature, 2006, 444(7120): 695-696.
[4] Lai J, Lim P, Wong C, et al. Photosynthetic response and DNA mutation of tropical, temperate and polar Chlorella under short-term UVR stress[J]. Polar Science, 2019, 20(1): 35-44.
[5] Wang X, Niu X, Chen Y, et al. Transcriptome sequencing of a toxic dinoflagellate,subjected to stress from solar ultraviolet radiation[J]. Harmful Algae, 2019, 88: 23-30.
[6] Wu H, Gao K, Wu H. Responses of a marine red tide alga(Bacillariophyceae) to long- term UV radiation exposures[J]. Journal of Photochemistry and Photobiology B: Biology, 2009, 94(2): 82-86.
[7] Wu H, Gao K, Villafane V, et al. Effects of solar UV radiation on morphology and photosynthesis of filamentous cyanobacterium[J]. Applied and Environmental Microbiology, 2005, 71(9): 5004-5013.
[8] 唐学玺, 杨震, 王悠, 等. 紫外辐射诱发三角褐指藻自由基伤害的研究[J]. 海洋通报, 1999, 18(4): 95-98. Tang Xuexi, Yang Zhen, Wang You, et al. The damage of free radical tounder UV-B radiation[J]. Ocean Bulletin, 1999, 18(4): 95-98.
[9] Garcia G, Mata M, Breusegem F, et al. Low-steady- state metabolism induced by elevated CO2increases resilience to UV radiation in the unicellular green-algae[J]. Environmental and Experimental Botany, 2016, 132: 163-174.
[10] Bouchard J, Candela G, Lorenz M, et al. Differential effect of ultraviolet exposure (UVR) in the stress response of the Dinophyceasp. and the Chlorophyta: mortality versus survival[J]. Marine Biology, 2013, 160(10): 2547-2560.
[11] Gao K, Wu Y, Li G, et al. Solar UV radiation drives CO2fixation in marine phytoplankton: a double-edged sword[J]. Plant Physiology, 2007, 144(1): 54-59.
[12] Xu J, Gao K. UV-A enhanced growth and UV-B induced positive effects in the recovery of photochemical yield in(Rhodophyta)[J]. Journal of Photochemistry and Photobiology B: Biology, 2010, 100(3): 117-122.
[13] Buma A, Boer M, Boelen P. Depth distributions of DNA damage in Antarctic marine phyto-and bacterioplankton exposed to summertime UV radiation[J]. Journal of Phycology, 2001, 37(2): 200-208.
[14] Cullen J, Neale P, Lesser P. Biological weighting function for the inhibition of phytoplankton photosynthesis by ultraviolet radiation[J]. Science, 1992, 258(5082): 646-650.
[15] Xu J, Gao K. Photosynthetic contribution of UV-A to carbon fixation by macroalgae[J]. Phycologia, 2016, 55(3): 318-322.
[16] Porra R J. The chequered history of the development and use of simultaneous equations for the accurate determination of chlorophyllsand[J]. Photosynthesis Research, 2002, 73: 149-156.
[17] Strickland J, Parsons T. Discussion of spectrophotometric determination of marine plant pigments, with revised equation for ascertaining chlorophylls and carotenoids[J]. Journal of Marine Research, 1963, 21(3): 155-163.
[18] Ruggaber A, Dlugi R, Bott A, et al. Modelling of radiation quantities and photolysis frequencies in the aqueous phase in the troposphere[J]. Atmospheric Environment, 1997, 31(19): 3137-3150.
[19] Gao K, Li G, Helbling E, et al. Variability of UVR effects on photosynthesis of summer phytoplankton assemblages from a tropical coastal area of the South China Sea[J]. Photochemistry & Photobiology, 2007, 83(4): 802-809.
[20] Wu Y, Gao K, Li G, et al. Seasonal Impacts of Solar UV Radiation on Photosynthesis of Phytoplankton Assemblages in the Coastal Waters of the South China Sea[J]. Photochemistry & Photobiology, 2010, 86(3): 586-592.
[21] 胡耐根. 臭氧层破坏对人类和生物的影响[J]. 安徽农业科学, 2010, 38(11): 6068-6069. Hu Naigen. Effects of destruction of the ozone layer on human biology[J]. Anhui Agricultural Sciences, 2010, 38(11): 6068-6069.
[22] Wang X, Feng X, Zhuang Y, et al. Effects of ocean acidification and solar ultraviolet radiation on physiology and toxicity of dinoflagellate[J]. Harmful Algae, 2019, 81: 1-9.
[23] 刘伟. 紫外辐射对硅藻中肋骨条藻无机碳利用机制的影响[D]. 汕头: 汕头大学, 2009: 33-49. Liu Wei. Effects of ultraviolet radiation on inorganic carbon utilization mechanism of[D]. Shantou: Shantou University, 2009: 33-49.
[24] Williamson C, Zepp R, Lucas R, et al. Solar ultraviolet radiation in a changing climate[J]. Nature Climate Change, 2014, 4(6): 434-441.
[25] 李刚. 中国南海浮游植物光合固碳与阳光紫外辐射关系的研究[D]. 汕头: 汕头大学, 2009: 37-56. Li Gang. Study on the relationship between phytoplankton carbon fixation and sunlight ultraviolet radiation in the South China Sea[D]. Shantou: Shantou University, 2009: 37-56.
[26] Wangberg S, Kristin I, Kristine G, et al. Inhibition of primary production by UV-B radiation in an arctic bay -model calculations[J]. Aquatic Sciences, 2006, 68(2): 117-128.
Effects of different ultraviolet wavelength bands on the photosynthetic physiological characteristics of
ZHU Rong-jun1, GAO Jia-yu1, WU Ya-ping1, XU Jun-tian1, 2, 3
(1. Jiangsu Key Laboratory of Marine Bioresources and Environment, Jiangsu Ocean University, Lianyungang 222005, China; 2. Co-Innovation Center of Jiangsu Marine Bio-industry Technology, Jiangsu Ocean University, Lianyungang 222005, China; 3. Jiangsu Key Laboratory of Marine Biotechnology, Jiangsu Ocean University, Lianyungang 222005, China)
Since the Industrial Revolution began around 1750, human activities have contributed substantially to climate change. Stronger short-wave ultraviolet (UV) radiation reaches the ground through depleted ozone layer existing in the earth’s atmosphere. At the same time, global warming has resulted in shallower and mixed seawater layers, thereby exposing phytoplankton to higher UV radiation. Red tide caused by algae blooms frequently occurs in coastal waters, andis one of the typical algae species responsible for red tide. Studying the effects of different ultraviolet wavelengths on its physiological characteristics are of great significance. In this experiment, the specieswas cultured outdoors, and the state of red tide was simulated. Then they were treated with UV bands of seven different wavelengths (using 280, 300, 320, 340, 360, 380, and 400 nm cut-off filters, respectively). The experimental results showed that UV radiation could considerably reduce the rate of photosynthetic carbon fixation of. The photosynthetic carbon fixation rate was increased as the UV bands were gradually filtered out; the specific growth rates of treatments at >280 nm and >300 nm were considerably lower than that of treatment at >400 nm; 280 nm–300 nm had a significant bleaching effect on chlorophyll a, and it also considerably reduced the content of carotenoids; this study indicated that the inhibitory effect of UV onis mainly caused by UV whereas the effect of ultraviolet A is not considerable. In the process of estimating the primary productivity of phytoplankton in the ocean, the role of ultraviolet radiation is often overlooked. Therefore, in the context of global warming, this study provides a certain reference value for accurately estimating the daily productivity of phytoplankton.
Photosynthetic carbon fixation rate; growth; pigments;; UV band
Mar. 7, 2020
Q89
A
1000-3096(2020)11-0045-07
10.11759/hykx20200307001
2020-03-07;
2020-05-31
国家自然科学基金资助项目(41476097); 江苏省“六大人才高峰”项目(JY-086); 江苏省研究生培养创新工程项目(KYCX19-2254)
[Chinese National Natural Science Foundation, No. 41476097; The Six Talents Peaks in Jiangsu Province, No. JY-086; Postgraduate Research & Practice Innovation Program of Jiangsu Province, No. KYCX19-2254]
朱镕军(1992-), 男, 山东临沂人, 硕士, 主要从事海洋藻类光生物学研究, E-mail: zrj804394110@163.com; 徐军田,通信作者, E-mail: jtxu@jou.edu.cn
(本文编辑: 谭雪静)
