姜黄素调节β-catenin/TCF4通路对胃癌细胞体内外生长和转移的影响①
2020-01-13陈锦萍林鸿悦黄书荣吴伟岗
陈锦萍 林鸿悦 曾 杨 黄书荣 吴伟岗
(福建医科大学附属泉州市第一医院胃肠外科,泉州 362000)
胃癌(Gastric cancer,GC)是来源于胃黏膜上皮的恶性肿瘤,目前仍是世界范围内发病率和死亡率最高的肿瘤之一;因发病快、早期诊断困难,多数患者确诊时已为转移性胃癌,5年生存率不足30%[1-3]。使用细胞毒性药物进行化疗虽然对胃癌发展起到一定的抑制作用,但也带来较大的副作用,给患者造成巨大的身心痛苦,且在此过程中,胃癌细胞易产生耐药性,故综合效果欠佳[4]。因此,寻找具有抑制胃癌转移能力的活性物质非常必要。植物提取物是天然的抗癌药物,副作用较小,姜黄素(Curcumin,CM)就是从传统中药姜黄根茎中提取得到的多酚类化合物,在亚洲国家作为化妆品、食品添加剂和传统草药的应用已有数千年的历史[5,6]。大量研究发现,姜黄素生物学活性广泛,包括降血脂、抗癫痫、抗抑郁、抗癌等[7-10]。近年来,姜黄素的抗肿瘤生物学活性受到了国内外学者的重视,其机制主要与改变肿瘤微环境、诱导肿瘤细胞凋亡及抑制肿瘤细胞耐药性有关[11-13]。而姜黄素对胃癌MGC-803细胞的体内外生长和转移作用研究还较少。本文以人胃癌MGC-803细胞为研究对象,探讨黄素对细胞增殖、凋亡、侵袭和上皮间质转化的影响及其可能机制。
1 材料与方法
1.1材料
1.1.1试剂 姜黄素(纯度为98.7 %,批号110823-201706)购自中国食品药品检定研究院,使用前用二甲基亚砜(Dimethylsulfoxide,DMSO)配成母液,-20℃保存;RPMI1640细胞培养液、0.25%胰酶和胎牛血清均购自美国Gibco公司;DMSO购自Sigma公司;膜联蛋白V(Annexin V)-异硫氰酸荧光素(Fluorescein isothiocyanate,FITC)/碘化丙啶(Propidium iodide,PI)凋亡检测试剂盒、末端脱氧核苷酸转移酶介导的dUTP生物素缺口末端标记法(Terminal deoxynucleotidyl transferase-mediated dUTP-biotin nick end labeling assay,TUNEL)细胞凋亡检测试剂盒、结晶紫染色液、二喹啉甲酸(Bicinchoninic acid,BCA)蛋白浓度测定试剂盒购自北京索莱宝科技有限公司;基质胶(Matrigel)购自美国Invitriogen公司;放射免疫沉淀法(Radio-Immunoprecipitation Assay,RIPA)裂解液购自南京碧云天生物技术公司;Ki67(ab16667)、增殖细胞核抗原(Proliferating cell nuclear antigen,PCNA)(ab92552)、半胱氨酸天冬氨酸蛋白酶3(Cysteine aspartic protease 3,Caspase-3)(ab32351)、Bax(ab32503)、Bcl-2(ab182858)、波形蛋白(Vimentin)(ab92547)、神经钙黏蛋白(Neural cadherin,N-cadherin)(ab76011)、Snail(ab216347)、上皮钙黏蛋白(Epithelial cadherin,E-cadherin)(ab40772)、β-catenin(ab32572)、T细胞因子(T cell factor 4,TCF4)(ab217668)、c-Myc(ab32072)和β-actin(ab213262)一抗和二抗(ab150077)均购自英国Abcam公司;溴脱氧核苷尿嘧啶(Bromodeoxyu-ridine,BrdU)和免疫组化试剂盒均购自广州锐博生物有限公司。
1.1.2仪器 超净工作台、低温高速离心机、酶标仪、细胞恒温培养箱购自美国Thermo公司;电泳仪、半干转膜仪、FACS Calibur流式细胞仪购自美国Bio-Rad公司;Gel View 6000化学发光凝胶成像系统购自广州云星仪器有限公司;倒置光学显微镜购自日本Olympus公司。
1.1.3细胞株 人胃癌MGC-803细胞株购自美国典型培养物保藏中心(American Type Culture Collection,ATCC)。用含有10% 胎牛血清和1%双抗的RPMI1640培养基,于37℃、5%CO2培养箱中培养,根据细胞生长情况进行换液,融合率达到85%以上进行传代培养,取对数生长期细胞用于后续实验。
1.2方法
1.2.1BrdU染色检测细胞增殖 接种胃癌MGC-803细胞于6孔板内,每孔1×106个细胞,待细胞融合率达80%时,用含0.4 %FBS的培养液同步化孵育72 h,每组设3个重复孔。将细胞随机分为4组,分别为Control(对照)组、CM(10 μmol/L)组、CM(20 μmol/L)组和DM(40 μmol/L)组[14],用对应终浓度药液处理24 h,加入终浓度为0.03 μg/ml的BrdU继续孵育40 min。磷酸盐缓冲液(Phosphate buffer,PBS)洗涤细胞3次,用多聚甲醛固定10 min,严格按照说明书进行细胞增殖检测。镜下观察并计数BrdU阳性细胞数。
1.2.2克隆形成实验检测细胞存活情况 接种细胞于6孔板内,每孔1×106个细胞,待细胞融合率达80%,分组方法同1.2.1,加入对应终浓度药物处理24 h。收集各组细胞,每组取1 000个细胞接种到6孔板中,培养10 d。用20%乙醇固定克隆后,0.4%结晶紫染色,镜下观察并计算克隆数。
1.2.3流式细胞术检测细胞凋亡水平 接种细胞于6孔板内,每孔1×106个细胞,待细胞融合率达80%时,分组方法同1.2.1,加入对应终浓度药物处理24 h。用胰酶收集各组细胞,调整密度至1×106个/ml。严格按照凋亡检测试剂盒说明书操作,取100 μl加入5 μl的Annexin V-FITC和10 μl的PI染色液,室温避光孵育15 min后,上机检测。
1.2.4Transwell检测细胞侵袭能力 接种细胞于6孔板内,每孔1×106个细胞,待细胞融合率达80%,分组方法同1.2.1,加入对应终浓度药物处理24 h。收集各组细胞,调整密度至3×105个/ml,接种于提前用Matrigel包被的Transwell小室上层,并加入不含胎牛血清的培养液培养,在Transwell小室下层加入正常细胞培养液,继续培养48 h。结晶紫染色,镜下随机选取5个视野对染色细胞进行计数。
1.2.5划痕闭合实验检测细胞迁移能力 接种细胞于12孔板内,每孔1×105个,待细胞融合率达80%时,用10 μl枪头作横线划痕,PBS清洗去除脱落细胞。分组方法同1.2.1,加入10 μg/ml终浓度的丝裂霉素C抑制细胞增殖[15],同时加入对应终浓度药物处理24 h。镜下拍照并计算划痕闭合率。划痕闭合率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
1.2.6异种移植瘤模型建立、小鼠存活率及肿瘤体积测定 5周龄SPF级雄性BALB/c小鼠,体质量18~20 g,购自北京维通利华实验动物技术有限公司,许可证号为SCXK(京)2014-0001。小鼠饲养于无菌环境,温度26~28℃,湿度50%~60%,光照时间10 h,自由采食饮水,适应性3 d后进行实验。将胃癌MGC-803细胞调整至2×107ml-1,于小鼠腋下皮下接种0.2 ml。将小鼠随机分为Control(对照)组、CM(0.5 mg/kg)组、CM(1 mg/kg)组和CM(2 mg/kg)组[16],每组5只,分别灌胃生理盐水、0.5、1和2 mg/kg的CM溶液,每天1次,连续14 d。每天观察并记录小鼠存活情况,每5 d测量一次肿瘤体积,于第30天摘取肿瘤组织保存备用。体积:V=长×宽2/2。
1.2.7TUNEL检测肿瘤组织凋亡情况 取1.2.6保存的肿瘤组织,将各组肿瘤组织制作成4 μm厚度的石蜡切片,严格按照TUNEL染色试剂盒操作进行肿瘤组织的染色。镜下随机选取5个不同视野,计算每个视野凋亡小体率=凋亡小体数/总细胞数×100%,取平均数。
1.2.8免疫组化检测肿瘤组织内Ki67表达水平 取1.2.6保存的肿瘤组织,将各组肿瘤组织制作成4 μm厚度的石蜡切片,严格按照试剂盒说明书进行操作。Ki67表达阳性细胞核内有棕色颗粒沉着。镜下随机选取5个不同视野,每个视野Ki67阳性率=阳性细胞/总细胞数×100%,取平均数。
1.2.9蛋白印迹检测细胞增殖、凋亡、上皮间质转化(Epithelial-mesenchymal transition,EMT)及通路蛋白的表达 冰上提取各组胃癌细胞总蛋白,用BCA法检测各组蛋白浓度并调成一致。每组取20 μg蛋白质用10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白后,转到聚偏氟乙烯(PVDF)膜。用5%脱脂牛奶室温封闭蛋白质2 h,加入Ki67、PCNA、Caspase-3、Bax、Bcl-2、Vimentin、E-cadherin、N-cadherin、β-catenin、TCF-4、c-Myc和β-actin一抗(1∶500),4℃孵育过夜。第二天弃去一抗,用缓冲液清洗PVDF膜后,加入对应二抗(1∶1 000),室温封闭1 h后,滴加电化学发光(Electrochemiluminescent,ECL)液于暗室曝光显影。以β-actin为内参,根据灰度值,以β-actin灰度值来表示目的蛋白表达量。

2 结果
2.1CM抑制MGC-803细胞增殖 BrdU染色和克隆形成实验检测MGC-803细胞增殖能力,结果显示:与对照组相比,CM组BrdU阳性细胞数量、细胞克隆数量降低(P<0.05或P<0.01,图1A、B),且呈CM浓度依赖性;Western blot检测细胞增殖相关蛋白表达情况,结果显示:与对照组相比,CM组MGC-803细胞中Ki67和PCNA相对蛋白表达水平降低(P<0.05或P<0.01,图1C),且呈CM浓度依赖性。
2.2CM促进MGC-803细胞凋亡 流式细胞术检测MGC-803细胞凋亡水平,结果显示:与对照组相比,CM组MGC-803细胞凋亡增加(P<0.05或P<0.01,图2A),且呈CM浓度依赖性;Western blot检测细胞凋亡相关蛋白表达情况,结果显示:与对照组相比,CM组MGC-803细胞中Caspase-3、Bax相对蛋白表达水平降低,Bcl-2则增加(P<0.05或P<0.01,图2B),且呈CM浓度依赖性。
2.3CM抑制MGC-803细胞侵袭迁移能力 Transwell实验和划痕闭合实验检测MGC-803细胞侵袭迁移能力,结果显示:与对照组相比,CM组侵袭细胞数量、划痕闭合率降低(P<0.05或P<0.01,图3A、B),且呈CM浓度依赖性;Western blot检测细胞EMT相关蛋白表达情况,结果显示:与对照组相比,CM组MGC-803细胞中Vimentin、N-cadherin和Snail1相对蛋白表达水平降低,E-cadherin则增加(P<0.05或P<0.01,图3C),且呈CM浓度依赖性。
2.4CM抑制MGC-803细胞通路蛋白表达 Western blot检测MGC-803细胞中通路蛋白表达水平,结果表明:与对照组相比,CM组MGC-803细胞中β-catenin、TCF4和c-Myc的相对蛋白表达水平降低(P<0.05或P<0.01,图4),且呈CM浓度依赖性。
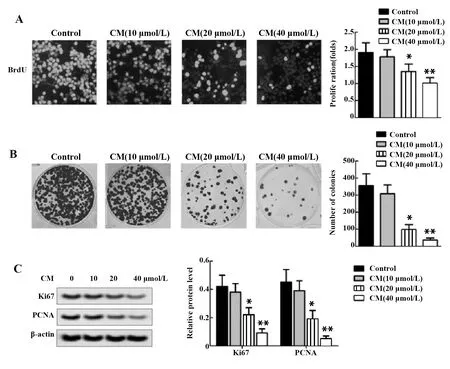
图1 MGC-803细胞增殖情况Fig.1 Proliferation of MGC-803 cellsNote:A.Cell proliferation was detected by BrdU;B.Colony formation of MGC-803 cells;C.Protein expression of Ki67 and PCNA were tested by Western blot.*.P<0.05,**.P<0.01 versus Control group.
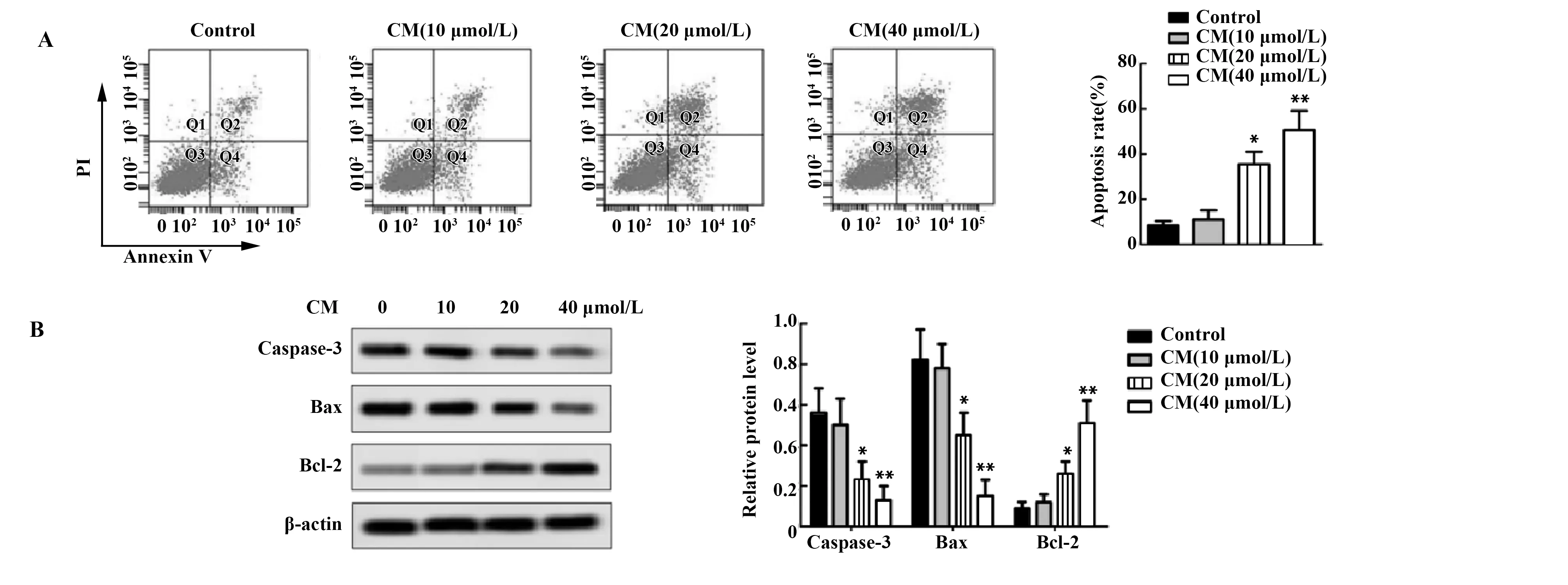
图2 MGC-803细胞凋亡检测Fig.2 Apoptosis detection of MGC-803 cellsNote:A.Apoptosis of MGC-803 cells were detected by flow cytometry;B.Protein expression of Caspase-3,Bax and Bcl-2 were tested by Western blot.*.P<0.05,**.P<0.01 versus Control group.
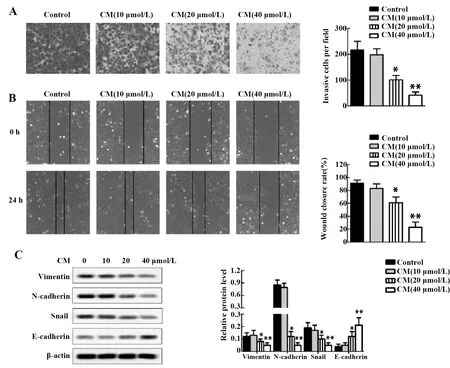
图3 MGC-803细胞侵袭迁移能力检测Fig.3 Invasion and migration ability of MGC-803 cells were detectedNote:A.Cell invasion ability was detected by transwell assay;B.Cell migration ability was detected by scratch closure test;C.Protein expression of Vimentin,N-cadherin,Snail1 and E-cadherin were tested by Western blot.*.P<0.05,**.P<0.01 versus Control group.
2.5CM对MGC-803细胞移植瘤生长及肿瘤组织中相关蛋白表达的影响 统计各组移植瘤小鼠存活率和移植瘤体积,结果表明:与对照组相比,CM组小鼠存活率增加,肿瘤体积减小(P<0.05或P<0.01,图5A、B),且呈CM浓度依赖性;TUNEL检测肿瘤组织凋亡水平,结果表明:与对照组相比,CM组肿瘤组织凋亡率增加(P<0.05或P<0.01,图5C),且呈CM浓度依赖性;免疫组化检测肿瘤组织中Ki67蛋白表达水平,结果显示:与对照组相比,CM组肿瘤组织中Ki67阳性细胞数减少(P<0.05或P<0.01,图5D),且呈CM浓度依赖性。

图4 MGC-803细胞通路蛋白表达情况Fig.4 Expression of signaling pathway protein in MGC-803 cellsNote:*.P<0.05,**.P<0.01 versus Control group.
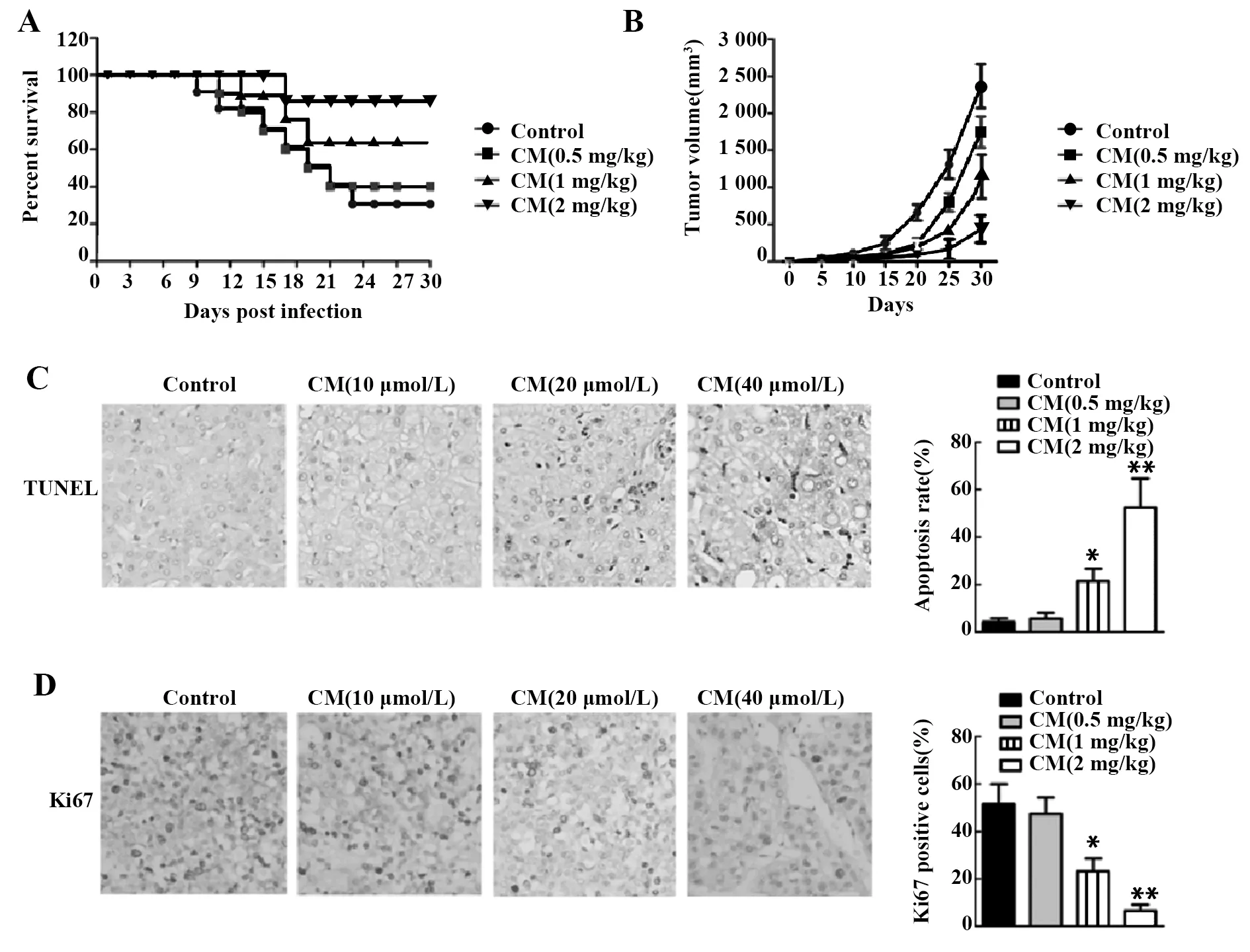
图5 CM对移植瘤生长及肿瘤组织中相关蛋白表达的影响Fig.5 Effects of CM on growth of transplanted tumor and expression of related proteins in tumor tissuesNote:A.Percent survival of transplanted tumor mouse;B.Tumor volumes of each group were measured on day 30;C.Apoptosis level of tumor tissue was detected by TUNEL assay;D.Positive cells of Ki67 were tested by immunohistochemical method.*.P<0.05,**.P<0.01 versus Control group.
3 讨论
胃癌是中国第三大最常见的癌症相关死亡原因之一,全球胃癌的死亡率高达50%[17]。随着人们生活方式的改变,幽门螺旋杆菌感染、环境改变等因素导致了胃癌的年轻化趋势[18]。目前,控制胃癌细胞转移是胃癌治疗亟待解决的问题,这将直接决定患者的预后状况。中药因其低毒、高效、来源广泛、价格较低等优点,在近年来的肿瘤治疗中表现出应用价值[19]。研究表明,姜黄素通过调节癌基因和抑癌基因及多种信号通路对多种肿瘤细胞的生长、侵袭和转移具有抑制作用,如颈部鳞癌、乳腺癌、前列腺癌、肺癌和胰腺腺癌等[20-23]。基于此,本文以人胃癌MGC-803细胞为研究对象,研究姜黄素对体内外增殖、凋亡和转移的影响及其可能机制。
细胞增殖能力增强和凋亡抵抗是癌症发生发展的两大特点。Zhang等[24]研究表明,在膀胱癌中,姜黄素抑制膀胱癌细胞增殖和侵袭,并诱导细胞凋亡发生。Liu等[25]采用CCK-8法和Ki67染色法流式细胞术检测细胞增殖,结果发现姜黄素呈时间和浓度依赖性抑制了胃癌细胞SGC-7901的增殖能力。Ki67是一种细胞增殖关键蛋白,可作为癌症无限增生的标志物,而PCNA在DNA复制、修复、细胞周期及凋亡等方面起着重要作用[26,27]。另外,Caspase-3、Bax和Bcl-2是细胞凋亡的关键调控因子,可影响肿瘤发展进程[28,29]。在本文中,姜黄素剂量依赖性减少胃癌MGC-803细胞的BrdU阳性率和克隆形成数量、侵袭细胞数量和划痕闭合率,增加细胞凋亡率,其机制与影响增殖(Ki67、PCNA)和凋亡(Caspase-3、Bax和Bcl-2)相关蛋白的表达有关,从而影响胃癌MGC-803细胞的增殖和凋亡能力。
EMT对器官发育、创伤修复等意义重大,在增强肿瘤细胞凋亡抵抗、促进肿瘤细胞干样特性获得和降解细胞外基质中也起着重要作用,其有利于肿瘤细胞侵袭转移,在癌症的发展进程中发挥着重要作用[4]。E-cadherin是一种重要的细胞黏附因子,其表达下调或缺失是肿瘤EMT的关键步骤,伴随着间充质标志物Vimentin和N-cadherin的表达上调,通过与β-catenin连接形成复合物维持上皮细胞稳定性,促进细胞间的相互作用;Snail是EMT的重要转录因子,当结合到E-cadherin的启动子上时可抑制后者的基因转录,从而参与EMT进程[30,31]。本研究表明,姜黄素剂量依赖性降低N-cadherin、Snail、Vimentin,增加E-cadherin蛋白表达,维持细胞间的黏附,降低细胞间的极性丧失,进而抑制胃癌MGC-803细胞EMT进程。
既往研究表明,姜黄素可以通过多种信号通路影响肿瘤细胞耐药性、增殖和凋亡等,如调控CXC趋化因子/NF-κB信号途径逆转直肠癌细胞的奥沙利铂耐药[13],Wnt3a/β-catenin/EMT 信号通路抑制胃癌细胞的增殖、迁移及侵袭[4]。C-Myc是一种重要的癌基因,通过调节许多基因靶点,参与包括细胞增殖、转移、血管生成和凋亡的多个生物学过程,其高表达与多种不同种类癌症预后不良相关[25]。当β-catenin转移到核内时,可竞争性结合TCF4形成β-catenin/TCF4复合物,激活TCF4下游的转录因子,包括癌基因cycD和c-Myc,最终导致细胞异常增殖和肿瘤发生[32]。本研究发现,姜黄素处理细胞后,β-catenin、TCF4和下游的c-Myc蛋白表达均受到抑制,说明姜黄素有效下调β-catenin/TCF4信号通路,进而抑制人胃癌MGC-803细胞增殖、侵袭和EMT的发生。
此外,本文在胃癌异种移植瘤中发现,姜黄素增加了小鼠存活率和肿瘤细胞凋亡水平,降低了肿瘤体积和肿瘤组织中Ki67的表达量。实验结果表明,姜黄素抑制了人胃癌MGC-803细胞的体内外增殖、侵袭转移,并诱导其凋亡,其机制可能与抑制β-catenin/TCF4信号通路密切相关,但在体内实验中缺少证明。但有研究已表明[33],在膀胱癌原位移植瘤模型中,姜黄素制剂显示出膀胱癌治疗的前景。
综上所述,本文初步探讨了姜黄素对人胃癌MGC-803细胞体内外增殖、凋亡、侵袭和间质转化的作用。结果发现,姜黄素对人胃癌MGC-803细胞的调节作用可能与抑制β-catenin/TCF4通路活化有关。本文的研究为姜黄素在胃癌治疗中的应用提供了实验数据,下一步计划研究β-catenin/TCF4信号通路在胃癌移植瘤模型中的作用及对肿瘤细胞干样特性的影响。
