连翘酯苷A通过p38 MAPK/NF-κB信号抑制哮喘气道炎症①
2020-01-13李俊峰李良昌
林 星 李俊峰 车 楠 李良昌③ 李 莉③
(延边大学附属医院胸外科,延吉 133000)
过敏性哮喘(Allergic asthma)通常由过敏原吸入引起,是一种异质性炎症性疾病。哮喘主要病理特征包括嗜酸性粒细胞浸润为主的气道炎症,气道高反应性及后期的气道重塑[1,2]。现在普遍认为慢性炎症在哮喘的发生发展中具有重要的作用,但具体机制尚不清楚。哮喘治疗通常使用皮质类固醇药物,但常伴有一系列不良反应,例如抑制下丘脑-垂体轴,减少骨生长和增加机会性感染的风险[3]。因此,迫切需要寻求安全有效的治疗哮喘的治疗药物。
连翘酯苷A(Forsythiaside A,FSA)是一种从中草药连翘中分离出来的活性成分,具有抗炎作用[4]。据报道,FSA抑制BV2小胶质细胞中LPS诱导炎性细胞因子的产生[5]。然而,目前尚不清楚FSA是否对哮喘有保护作用。在这里,我们建立了OVA诱导的哮喘模型,观察FSA对OVA哮喘炎症的影响并对其机制进行探讨。
1 材料与方法
1.1材料
1.1.1实验动物 BALB/c小鼠购自延边大学实验动物中心,合格证号为:SCXK(吉)2018-0007。将小鼠饲养在温度受控的室内,12 h光照/黑暗循环,随意提供食物和水。所有动物实验均按照延边大学医学院的实验动物护理和使用指南进行。遵循相关动物保护法,实验中尽量减少动物痛苦。
1.1.2试剂 连翘酯苷A(Forsythiaside A,FSA,纯度>98%)购自国家药品和生物制品控制研究所(北京)。OVA、氢氧化铝凝胶购自美国Sigma公司(St.Louis,MO,USA)。小鼠IL-4、IL-5、IL-13和IFN-γ的ELISA试剂盒购自R&D Systems(Minneapolis,MN)。IL-4、IL-5、IL-13、IFN-γ、p-p38 MAPK、p38 MAPK、NF-κB p65和β-actin抗体均购自Santa Cruz公司(Santa Cruz,CA,USA)。
1.2实验方法
1.2.1OVA哮喘小鼠模型建立 40只小鼠随机分为5组:正常组(CON),哮喘模型组(OVA),FSA低剂量组(FSA 15),高剂量组(FSA 30)和地塞米松组(DEX)。在第1天和第14天通过腹腔注射2% OVA和氢氧化铝的PBS混合液200 μl致敏,CON组小鼠注射相同体积的PBS。在第21至23天,以1% PBS OVA溶液15 ml雾化激发30 min。每次OVA激发前,FSA 15组和FSA 30组分别按15和30 mg/kg,DEX组按照10 mg/kg剂量进行灌胃。
1.2.2BALF细胞分类计数 参照文献方法[6],最后一次OVA激发后24 h处死小鼠,1 ml的PBS气管灌洗后收集BALF,细胞计数板计数细胞总数,4℃条件下3 000 r/min离心10 min,收集上清液用于细胞因子检测。将细胞沉淀涂片后Diff-Quik染色,高倍镜下进行细胞分类计数。取小鼠左肺上叶10%甲醛固定,石蜡包埋。右肺剪碎后放入液氮中速冻,保存于-80℃冰箱,待用。
1.2.3BALF中细胞因子测定 根据生产商的说明,采用ELISA试剂盒(R&D Systems,Minneapolis,MN)检测BALF中IL-4、IL-5、IL-13、IFN-γ的含量。
1.2.4小鼠肺切片组织学染色 石蜡包埋的肺组织切片后,用二甲苯脱蜡,梯度乙醇脱水,进行HE、PAS和Masson染色后,每只小鼠随机选3张切片,在光学显微镜下观察。
1.2.5免疫组织化学染色 切片60℃熔蜡,柠檬酸盐修复抗原,3% H2O2孵育10 min,血清封闭后p-p38 MAPK和NF-κB p65抗体4℃过夜,第2天,二抗孵育30 min后DAB显色,苏木素复染,乙醇脱水、二甲苯透明后中性树胶封片。
1.2.6Western blot免疫蛋白印迹 参照文献方法[7],蛋白提取后BCA方法测定蛋白浓度。12%胶分离蛋白质样品,半干法转移到PVDF膜上。用5%脱脂乳封闭后,IL-4、IL-5、IL-13、IFN-γ、p38 MAPK、p-p38 MAPK、NF-κB p65和β-actin一抗(1∶1 000稀释)4℃过夜。第2天,TBST洗涤膜3次,并与HRP标记的二抗室温孵育2 h。ECL发光后美国GE AI600凝胶成像仪进行摄像分析。

2 结果
2.1FSA对哮喘小鼠BALF中炎症细胞的影响 计数各组小鼠BALF炎症细胞总数(Total cells)后进行Diff-Quik染色(如图1所示)。对BALF中炎症细胞进行分类计数(如表1所示),结果显示,OVA组小鼠炎症细胞总数、嗜酸性粒细胞、中性粒细胞和淋巴细胞数量明显高于CON小鼠,然而,FSA及地塞米松处理可显著抑制各炎症细胞及炎症细胞总数的增加(P<0.05)。
2.2FSA对哮喘小鼠BALF中Th1/Th2因子的影响 与CON组小鼠比较,OVA组小鼠BALF中IL-4、IL-5、IL-13的含量显著升高,IFN-γ含量显著降低(P<0.05),经过FSA及地塞米松处理后,IL-4、IL-5、IL-13含量降低而IFN-γ含量显著升高,与OVA组比较,差异具有统计学意义(P<0.05),见表2。
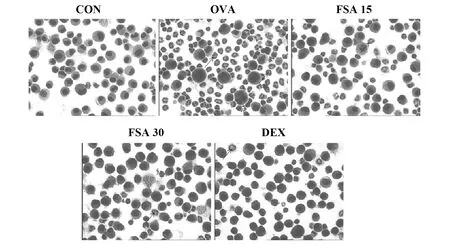
图1 小鼠BALF中细胞Diff-quik染色(×200,箭头所示为嗜酸性粒细胞)Fig.1 Diff-quik staining of cells in BALF of mice(×200,the arrow shows eosinophils)
2.3FSA对小鼠肺组织病理学改变的影响 HE染色结果显示,CON组小鼠气道壁及其周围软组织结构完整,无炎症细胞浸润。OVA激发小鼠可见气道壁增厚,黏膜水肿,小血管及细支气管周围炎症细胞广泛浸润,部分黏膜上皮可见损伤及脱落。而FSA及地塞米松处理后,小血管及细支气管周围炎症细胞浸润减少,气道平滑肌增生不明显,气道结构较为完整。PAS染色显示OVA组中PAS阳性细胞显著增多,但可被FSA及地塞米松抑制。Masson染色显示OVA组小鼠气道下胶原沉积较CON组小鼠明显增多,而FSA处理可对这种胶原沉积发挥抑制作用,如图2所示。
2.4FSA对哮喘小鼠肺组织中IL-4、IL-5、IL-13及IFN-γ表达的影响 Western blot结果表明,与CON组小鼠比较,OVA组小鼠肺组织中IL-4、IL-5、IL-13表达增多,IFN-γ表达减少(P<0.05),经过FSA及地塞米松处理后,OVA诱导哮喘小鼠肺组织中IL-4、IL-5、IL-13表达降低,IFN-γ表达升高,与OVA组比较,差异具有统计学意义(P<0.05),如图3所示,与ELISA结果相符。
2.5FSA对p38 MAPK磷酸化及NF-κB活化的影响 如图4A所示,免疫组化结果显示,OVA组小鼠肺组织中p-p38 MAPK和NF-κB p65阳性细胞较CON组小鼠增加,而在不同剂量FSA组及地塞米松组中阳性细胞数较OVA组明显减少。同时Western blot结果表明,与CON组比较,OVA组小鼠肺组织中p-p38 MAPK和NF-κB p65水平明显升高,而不同剂量FSA及地塞米松处理后,其含量降低,与OVA组比较,差异具有统计学意义(P<0.05),如图4B、C所示。

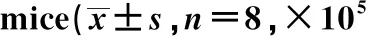
GroupsTotal cellEOSNEULYMCON2.32±0.230.07±0.040.11±0.080.48±0.12OVA7.65±0.551)5.23±0.361)0.39±0.101)1.42±0.361)FSA 156.36±0.582)4.34±0.422)0.32±0.092)1.36±0.122)FSA 304.26±0.312)3.36±0.222)0.18±0.082)0.98±0.152)DEX3.19±0.252)0.98±0.182)0.14±0.062)0.75±0.172)
Note:Vs CON group,1)P<0.05;vs OVA group,2)P<0.05.



GroupsIL-4IL-5IL-13IFN-γCON78.65±7.49 70.45±7.4939.46±7.3273.21±4.59OVA292.48±12.691)456.41±18.291)89.62±6.321)23.49±2.391)FSA 15251.24±10.412)421.28±17.212)76.36±7.362)46.47±3.282)FSA 30174.69±9.122) 275.69±14.982)65.78±6.252)52.38±4.512)DEX126.27±8.912) 149.78±10.262)43.52±5.162)69.47±5.842)
Note:Vs CON group,1)P<0.05;vs OVA group,2)P<0.05.

图2 FSA对小鼠肺组织病理改变的影响(×200)Fig.2 Effect of FSA on pathological changes of lung tissue(×200)
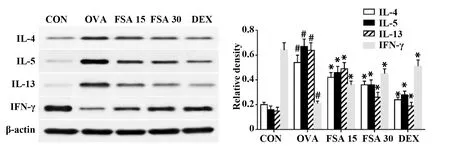
图3 FSA对小鼠肺组织中IL-4、IL-5、IL-13及IFN-γ表达的影响Fig.3 Effect of FSA on expression of IL-4,IL-5,IL-13 and IFN-γ in lung tissue of miceNote:Vs CON group,#.P<0.05;vs OVA group,*.P<0.05.
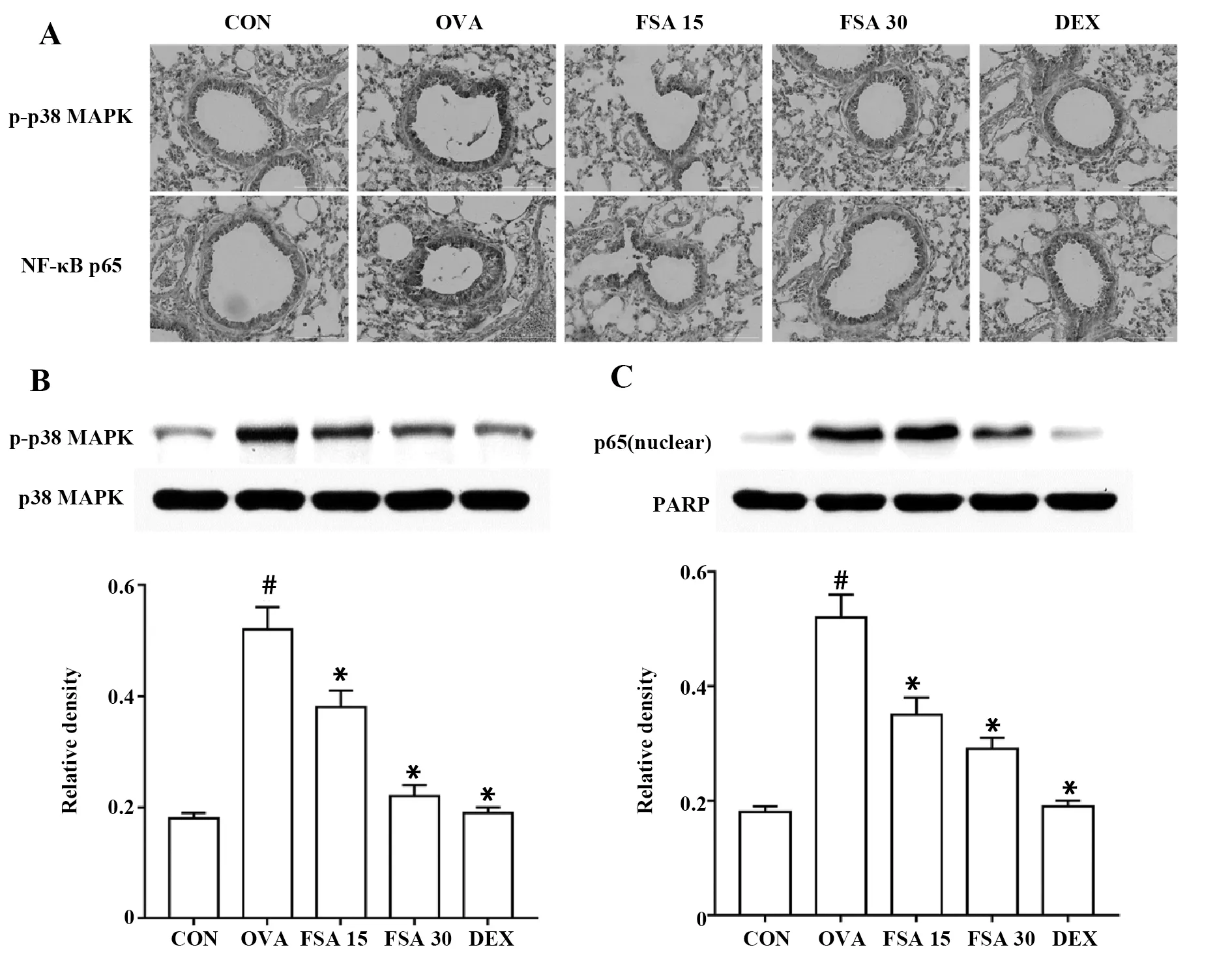
图4 FSA对OVA诱导哮喘小鼠肺组织中p-p38 MAPK和NF-κB p65表达量的影响Fig.4 Effect of FSA on expression of p-p38 MAPK and NF-κB p65Note:A.Immunocytochemistry staining for p-p38 MAPK and NF-κB p65 in lung tissue(×200);B.Western blot of p-p38 MAPK in lung tissue.C.Western blot of NF-κB p65 in lung tissue.Vs CON group,#.P<0.05 ;vs OVA group,*.P<0.05.
3 讨论
支气管哮喘是一种常见的呼吸系统慢性炎症性疾病,其病理特征包括炎症细胞广泛浸润、杯状细胞增生并过量分泌黏液、气道下胶原沉积等。在哮喘的发病过程中,炎症细胞显著增多并广泛浸润到气道周围是哮喘最主要的特征,其中,浸润细胞以嗜酸性粒细胞为主,也包括中性粒细胞、淋巴细胞等[8]。本实验中HE染色结果表明,FSA有效改善了OVA诱导哮喘小鼠支气管及血管周围炎症细胞的浸润。此外,对各组小鼠BALF中炎症细胞进行分类计数后发现,FSA显著减少了哮喘小鼠模型BALF中各炎症细胞及总炎症细胞数量的增加。气道上皮中杯状细胞增生并分泌过量黏液也是哮喘的重要特征,本实验的PAS染色结果表明,FSA可有效缓解OVA诱导哮喘小鼠气道上皮中杯状细胞的增生,并可抑制气道黏液的过量分泌。此外,Masson染色结果表明,FSA可抑制气道下胶原沉积。因此,FSA可有效改善OVA诱导哮喘小鼠模型的气道炎症反应。
在哮喘的发生、发展中,除了炎症细胞的参与,细胞因子也发挥着重要作用。IL-4、IL-5和IL-13主要由Th2细胞产生并分泌,Th2细胞的分化与聚集是哮喘炎症反应加重的重要原因,而Th1细胞可产生IFN-γ等,据研究表明,提高Th1反应可抑制哮喘的发展[9]。因此,本实验分别检测了各组小鼠BALF和肺组织中IL-4、IL-5、IL-13及IFN-γ水平。结果表明,FSA处理可显著减少哮喘小鼠BALF及肺组织中IL-4、IL-5、IL-13水平,提高IFN-γ水平,因此,FSA可通过降低Th2细胞因子,提升Th1细胞因子而纠正OVA诱导的哮喘小鼠Th1/Th2失衡。
为了探究FSA缓解哮喘炎症的可能机制,我们研究了p38 MAPK/NF-κB信号通路。p38 MAPK是MAPK(丝裂原活化蛋白激酶)家族的成员之一,在受到刺激时发生磷酸化而激活,从而参与多种生物学效应,如调控炎症反应等[10]。本次实验中免疫组化及Western blot结果表明,FSA可以减少哮喘小鼠肺组织中p38 MAPK磷酸化水平。NF-κB是一种转录因子,与包括哮喘等多种炎症反应密切相关。通常情况下,NF-κB与其抑制蛋白IκBα结合存在于细胞质中,当细胞受到相关因子刺激时,IκBα发生磷酸化并被降解,而将NF-κB活化、分解为p50和p65并转移至核内,与调控基因的启动子序列结合并调节其转录[11]。目前已有大量研究表明,支气管哮喘的气道炎症反应与NF-κB活化密切相关。本次研究中,通过免疫组化及Western blot发现,FSA可显著降低NF-κB p65表达水平并阻碍其入核。大量研究结果发现,p38 MAPK在受到刺激时可发生磷酸化,磷酸化的p38 MAPK可使有丝分裂原和应激活化蛋白激酶1(MSK1)发生磷酸化,继而激活NF-κB[12]。活化的NF-κB可调控多种炎症分子表达,如IL-4、IL-5、IL-13、IFN-γ等,调控Th1/Th2细胞因子水平,发挥其炎症调控作用[13]。
综上所述,FSA可以显著改善OVA诱导哮喘小鼠模型气道炎症细胞的浸润,抑制气道上皮中杯状细胞增生及黏液分泌,减少气道下胶原沉积,同时,FSA可通过影响IL-4、IL-5、IL-13及IFN-γ等细胞因子水平而纠正哮喘小鼠模型的Th1/Th2失衡,并且其机制可能与p38 MAPK/NF-κB信号通路有关。
