大黄酚抑制自噬改善HIBI新生大鼠脑组织病理损伤和炎症反应①
2020-01-13邴小三望燕妮肖惠玲黄亚萍
邴小三 望燕妮 赵 申 肖惠玲 黄亚萍
(湖北文理学院附属襄阳市中心医院儿科,襄阳 441000)
缺氧缺血性脑损伤(Hypoxic-ischemic brain injury,HIBI)是围产期常见的脑损伤形式,是导致新生儿和儿童死亡的主要原因,也可导致终身的神经功能损害,如认知和记忆障碍、脑瘫和癫痫等[1,2]。新生儿窒息是导致HIBI最常见的原因,它导致了脏器的缺血和再灌注行为,从而致使机体重要器官发生缺氧缺血性损伤[3]。缺氧缺血引发的炎症是导致大脑损伤的关键因素,增加了后期神经疾病的发病风险,因此,减轻炎症对大脑的病理损伤成为改善HIBI的方法之一[4]。大黄(Rhubarb)具有广泛的生物学活性,包括治疗发热、腹泻和中毒,蒽醌类化合物是其主要活性成分,大黄酚(Chrysophanol,CP)是蒽醌类化合物的一种,已被证实具有多种功能,包括抗氧化应激、神经保护、抗癌等,而大黄酚发挥生物活性与其强大的抗炎作用相关[5-10]。但尚未见大黄酚对HIBI中炎症水平的作用报道,因此,本文采用改良的Rice法建立HIBI新生大鼠模型,研究大黄酚对模型大鼠脑组织病理损伤和炎症反应的调节作用及其可能机制。
1 材料与方法
1.1材料
1.1.1主要试剂 大黄酚(纯度≥98 %,货号:01542)购自美国SIGMA公司;尼莫地平(30 mg/片,国药准字H37022796,批号:20171026)购自天津市中央药业有限公司;雷帕霉素(Rapamycin,RAP)(货号:S1039)购自Selleck公司;LC3Ⅱ、Beclin1、P62/SQSTM1、Bcl-2、Bax、p-mTOR、mTOR、p-p70S6K和β-actin抗体(货号:bs-2912R、bs-1353R、bs-2951R、bs-4563R、bs-0127R、bs-3495R、bs-1992R、bs-1426R和bs-0061R)购自北京博奥森生物技术有限公司;TNF-α、 IL-4、IL-10和iNOS试剂盒(货号:F26260、F3742、F3745和F01544)购自上海西唐生物科技有限公司。
1.1.2主要仪器 QuantStudio3荧光定量PCR仪,美国ThermoFisher公司(美国);SMART行为视频记录和分析系统,东乐自然基因生命科学公司(西班牙);ChemiDoc XRS化学发光成像系统,美国伯乐公司(美国);CX31光学显微镜,日本奥林巴斯公司(日本);Thermo 900超低温冰箱,美国Thermo公司(美国);ELx800全自动酶标仪,美国Bio-Tek仪器有限公司(美国)。
1.2方法
1.2.1实验动物及分组 7日龄清洁级SD大鼠,体质量(17.3±1.9)g,购自北京维通利华实验动物公司,许可证号为SCXK (京) 2014-0001,每笼10只饲养于标准笼内,由亲代大鼠喂养,亲代大鼠自由采食和饮水,饲养温度26℃~28℃,湿度60%~80%,光照12 h/12 h。
分组情况:①检测脑组织含水量、HE染色、炎症因子和蛋白表达,大鼠随机分为6组:假手术组(Sham)、模型组(HIBI)、尼莫地平(nimodipine,NIM)模型组(HIBI+NIM)、模型给药组(HIBI+CP 2.5、5、10)[11,12],每组12只。②检测学习和记忆能力,大鼠随机分为6组:假手术组(Sham)、模型组(HIBI)、RAP模型组(HIBI+RAP)、模型给药组(HIBI+CP)[6],每组6只。
1.2.2HIBI模型制备 造模前大鼠禁食12 h,但不禁水。采用改良的Rice法造模[13],简而言之:大鼠麻醉后,仰卧固定,消毒后于颈正中切口,分离暴露颈总动脉,作双重结扎,缝合皮肤。术后恢复3 h,将大鼠置于含8%氧气和92%氮气的自制缺氧箱中,气体流量保持1 L/min,缺氧2 h。假手术组除不结扎动脉和进缺氧箱中外,其余操作相同。模型大鼠缺氧处理后,大鼠出现烦躁不安、呼吸加快、震颤、不愿活动,旋转等行为,假手术组大鼠行为无明显异常。
1.2.3给药方法 将NIM配制成10 mg/ml的甲醇储备液,CP配制成50 mg/ml的生理盐水储存液,RAP配制成0.5 mg/ml的DMSO储备液,实验时根据需要进行稀释。①HIBI+NIM组灌胃给予10 ml/kg NIM(10 mg/kg)[14]、HIBI+CP组腹腔注射给予CP(2.5、5和10 mg/kg)溶液,Sham组和HIBI组腹腔注射给予10 ml/kg生理盐水。文献报道,HIBI诱发的脑水肿常发生在早期[15],本文拟检测造模24 h时的脑水肿程度,因此设计给药时间为:造模后立即、8 h和16 h,共给药3次。②HIBI+RAP组和HIBI+CP组分别腹腔注射给予0.5 mg/kg的RAP溶液和2.5、5和10 mg/kg的CP溶液10 ml/kg,Sham和HIBI组腹腔注射给予10 ml/kg生理盐水。给药时间[6,16]:造模后立即给药记为day 1,以后每天1次,直至day 28。
1.2.4脑组织含水量检测 造模完成后24 h,每组取6只大鼠断头处死,取脑。采用干湿重法检测大鼠脑组织含水量。称取右脑重量(湿重),之后将其放入
1.2.5HE染色检测大鼠脑组织病理改变 造模完成后24 h,每组取6只大鼠,麻醉后打开胸腔,用生理盐水充分灌洗心脏直至液体澄清,再用4%中性福尔马林继续灌注,后迅速取出脑组织,放入4 %中性福尔马林固定,经脱水、常规石蜡包埋、切片后,行HE染色,于光学显微镜下观察脑组织病理改变。
1.2.6ELISA检测脑组织中炎症因子含量 造模完成后24 h,每组取6只大鼠,断头处死并摘取脑组织,-80℃保存备用。称取适量脑组织,加入9倍量的预冷生理盐水,制成10%匀浆,3 000 r/min离心20 min,取上清。严格按照试剂盒说明书测定TNF-α、iNOS、IL-6和IL-10,设置3个复孔。
1.2.7Western blot法检测相关蛋白表达水平 取1.2.6所述大鼠脑组织适量,等比例加入含蛋白抑制剂的裂解液,提取大鼠脑组织总蛋白。用BCA法进行蛋白定量,取样进行SDS-PAGE电泳并转至PVDF膜上,脱脂牛奶室温封闭2 h,加入一抗(1∶1 000),4℃孵育过夜,洗膜,次日加入辣根过氧化物酶标记的相应二抗(1∶10 000),室温孵育1 h,洗膜,滴加ECL发光液,于凝胶成像仪上曝光显影,Image J图像分析软件分析条带灰度值。
1.2.8Morris水迷宫实验检测大鼠学习和记忆能力 自造模后第25天开始为期3天的实验训练,每天训练4次。定位航行实验:平台固定于某一象限,水面高于平台1 cm,温度设为25℃。将大鼠面向水池壁从四个象限放入水池,由采集系统记录大鼠的运动情况,自入水开始计时,大鼠找到平台后,此时间为潜伏期,之后可在平台上停留10 s;若60 s仍未找到平台,则记录为60 s,并将大鼠引至平台停留10 s。从四个象限放入水池为一次训练,两次训练间隔时间在30 s以上。正式试验在造模后第28天进行。空间探索实验:定位航行实验完成结束后,撤除平台,从相同象限将大鼠放入水池,记录60 s 内大鼠穿越平台的次数。

2 结果
2.1大黄酚对HIBI大鼠脑组织含水量和病理学改变的影响 采用结扎颈总动脉结合低氧环境法建立HIBI新生大鼠模型,术后24 h检测大鼠脑组织含水量,结果如图1A所示:HIBI组大鼠脑组织含水量显著高于Sham组(P<0.01);与HIBI组相比,HIBI+NIM组和HIBI+CP各剂量组大鼠脑组织含水量均降低(P<0.05或P<0.01)。另外,术后24 h进行HE染色检测大鼠脑组织病理损伤,结果如图1B所示:Sham组大鼠脑组织结构清楚,神经元细胞形态、数量正常、排列紧密有序,未见明显病理改变。HIBI组大鼠脑组织正常结构被破坏,神经元细胞出现空泡、肿胀变性甚至坏死,排列紊乱稀疏,并伴有炎性细胞浸润。HIBI+NIM组、HIBI+CP (5 mg) 组和HIBI+CP (10 mg)组大鼠脑组织上述病理改变均得到不同程度的改善。
2.2大黄酚对HIBI大鼠脑组织炎性细胞因子含量的影响 ELISA检测大鼠脑组织中炎性细胞因子表达,结果如图2所示:与Sham组相比,HIBI组大鼠脑组织中TNF-α、iNOS和IL-6炎症细胞因子含量增加(P<0.01),抗炎因子IL-10含量降低(P<0.01);但经NIM和CP治疗后,TNF-α、iNOS和IL-6表达水平显著低于HIBI组(P<0.01),IL-10则高于HIBI组(P<0.01)。
2.3大黄酚对HIBI大鼠脑组织自噬蛋白表达水平的影响 造模后24 h,蛋白印迹检测大鼠脑组织中自噬标记蛋白的表达水平,结果如图3所示:HIBI组大鼠脑组织中LC3II/LC3I比值、Beclin1和Bax蛋白表达显著高于Sham组(P<0.01),P62/SQSTM1比值和Bcl-2蛋白表达则显著低于Sham组(P<0.01);与HIBI组相比,HIBI+NIM组和HIBI+CP各剂量组大鼠脑组织中上述蛋白表达水平均得到逆转(P<0.05或P<0.01)。
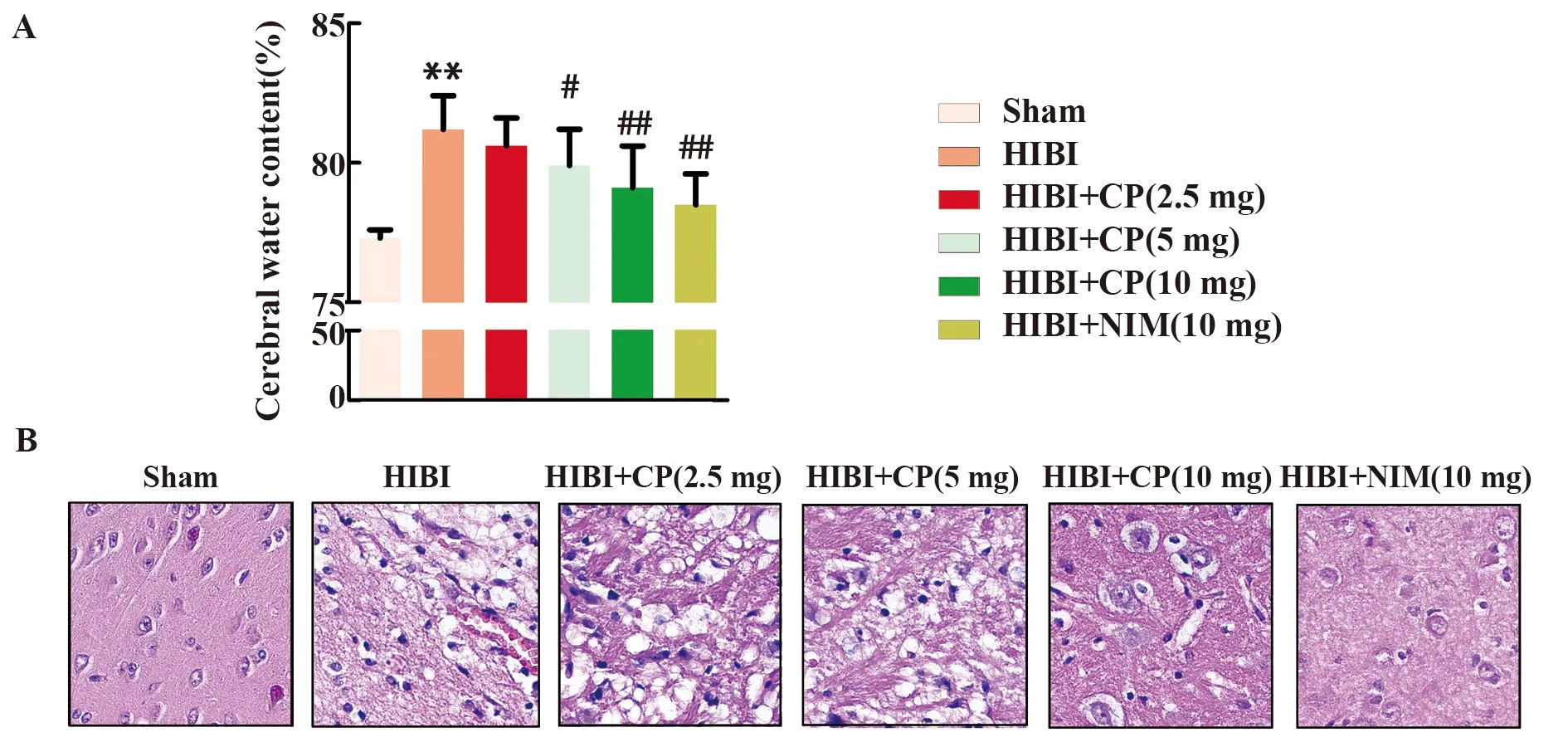
图1 大黄酚对HIBI大鼠脑组织含水量和病理学改变的影响Fig.1 Effects of chrysophanol on cerebral water content and pathological changes in HIBI ratsNote:A.The water content of brain tissue was detected by dry-wet weight method;B.The pathological damage of brain tissue was detected by HE staining (×400).**.P<0.01 versus Sham group;#.P<0.05,##.P<0.01 versus HIBI group,n=6.

图2 大黄酚对HIBI大鼠脑组织炎症因子含量的影响Fig.2 Effects of chrysophanol on content of inflammatory factors in brain tissue of HIBI ratsNote:The levels of inflammatory factors in rat brain tissue were detected by ELISA.**.P<0.01 versus Sham group;##.P<0.01 versus HIBI group,n=6.
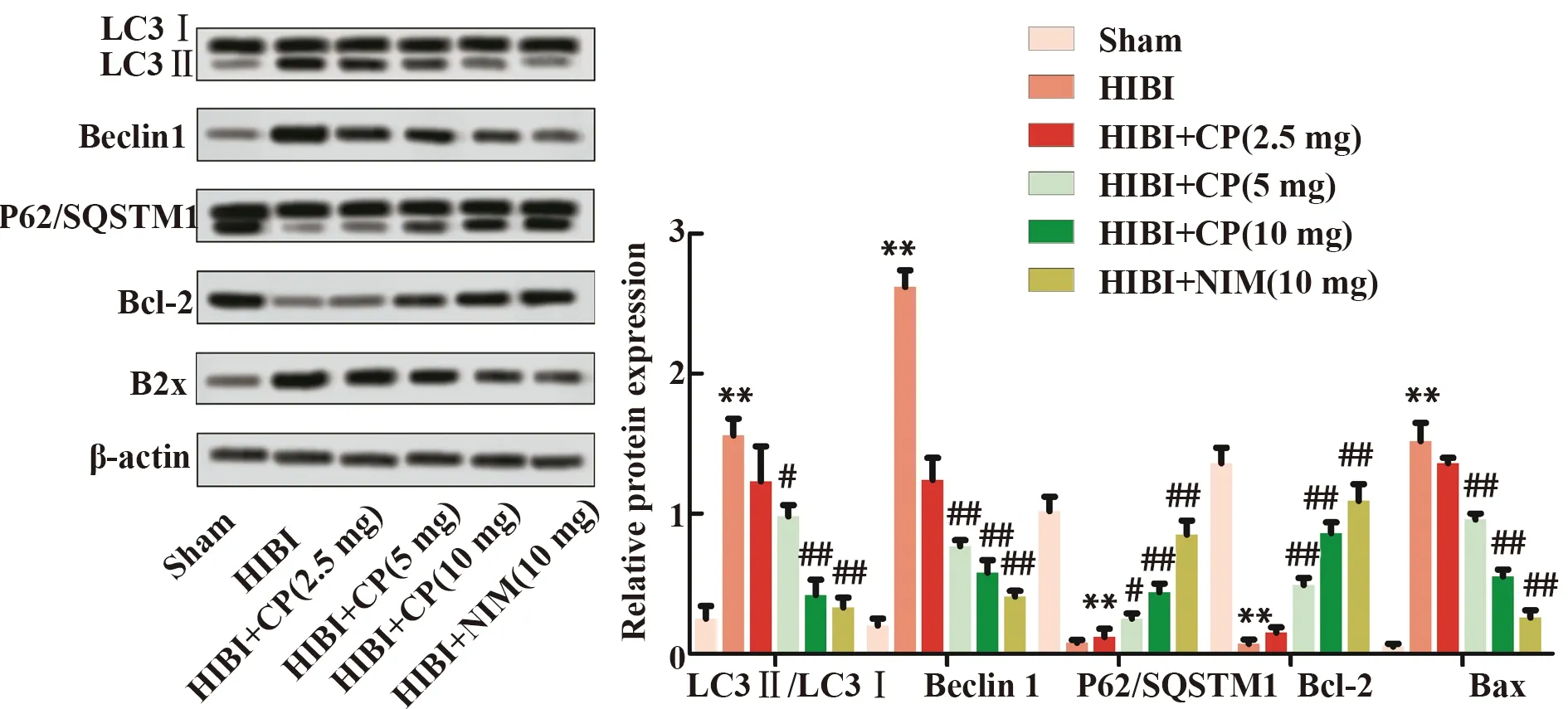
图3 大黄酚对HIBI大鼠脑组织自噬蛋白表达水平的影响Fig.3 Effect of chrysophanol on expression of autophagic protein in brain tissue of HIBI ratsNote:Protein expression levels were detected by Western blot.**.P<0.01 versus Sham group;#.P<0.05,##.P<0.01 versus HIBI group,n=6.

图4 大黄酚对HIBI大鼠脑组织mTOR/p70S6K信号通路磷酸化的影响Fig.4 Effects of chrysophanol on phosphorylation of mTOR/p70S6K signaling pathway in brain tissue of HIBI ratsNote:Protein expression levels were detected by Western blot.**.P<0.01 versus Sham group;#.P<0.05,##.P<0.01 versus HIBI group,n=6.

图5 大黄酚对HIBI大鼠学习和记忆能力的影响Fig.5 Effects of chrysophanol on learning and memory ability in HIBI ratsNote:A.Escape latency;B.Number of crossing platforms.**.P<0.01 versus Sham group;##.P<0.01 versus HIBI group,n=6.
2.4大黄酚对HIBI大鼠脑组织mTOR/p70S6K信号通路磷酸化的影响 造模后24 h,蛋白印迹检测大鼠脑组织mTOR/p70S6K信号通路激活情况,结果如图4所示:HIBI组p-mTOR/mTOR和p-p70S6K/p70S6K显著低于Sham组(P<0.01);HIBI+NIM组和HIBI+CP各剂量组大鼠脑组织中mTOR/p70S6K信号通路磷酸化水平均高于HIBI组(P<0.05或P<0.01)。
2.5大黄酚对HIBI大鼠学习和记忆能力的影响 Morris水迷宫实验检测造模后第28天时大鼠的学习和记忆能力,结果如图5所示:与Sham组相比,HIBI组大鼠的逃避潜伏期明显延长(P<0.01),而穿越平台次数明显减少(P<0.01);自噬激活剂雷帕霉素治疗组(HIBI+RAP)大鼠逃避潜伏期较HIBI组延长(P<0.01),穿越平台次数较HIBI组减少(P<0.01);而大黄酚治疗组(HIBI+CP) 大鼠逃避潜伏期较HIBI组也延长(P<0.01),穿越平台次数较HIBI组也减少(P<0.01)。
3 讨论
HIBI 是新生儿最常见的中枢神经系统疾病,是新生儿死亡的主要原因,寻找有效的预防或治疗方式是非常迫切的要求。建立HIBI模型是研究的基础,目前造模方法较多,包括亚硝酸钠法、静脉注射氯化镁法等[17],但经典Rice法却是近年来研究HIBI的最常用建模方法。研究表明,脑组织水肿和坏死是缺氧缺血性脑病(Hypoxic-ischemic encephalo-pathy,HIE)的早期病理变化,也是导致病情恶化的重要因素[18,19]。尼莫地平是一种电压依赖性、选择性的二氢吡啶型(L型)Ca2+通道的亲脂拮抗剂,它能穿过心脑屏障,引起脑血管扩张,3周龄高岭土诱导的脑积水大鼠连续给药尼莫地平两周,能有效改善大鼠行为学和脑组织结构完整性[20]。因此,本文根据文献[14]选择尼莫地平作为阳性药,10 mg/kg为给药剂量,且保留尼莫地平给药途径(灌胃给药);但因大黄酚在治疗脑组织相关疾病时多采用腹腔给药方式[12,21],故本文也沿用此方式,这可能与大黄酚的理化性质有关。本文研究发现模型组大鼠脑组织含水量显著增加,且HE染色也直观的表明,模型大鼠脑组织发生了早期的组织水肿和病理性坏死,与上述文献报道的HIBI病理变化一致。综合实验结果证明,本实验中HIBI模型建立成功。此外,经造模后立即、8 h和16 h的3次给药后发现,10 mg/kg剂量的大黄酚能有效改善HIBI造模引起的新生大鼠脑组织水肿程度,减轻脑神经元细胞发生空泡化、坏死及炎症浸润等病理改变,且可能与改变脑组织血管通透性有关。
TNF-α和IL-6等是HIBI诱导的炎症反应早期的炎性细胞因子,在HIBI病理损伤中发挥着重要作用[22],TNF-α是全身炎症反应的初始物质,能促进IL-6和IL-1等因子释放,导致炎性损伤的级联反应[23]。为了证明HIBI导致了新生大鼠脑组织发生炎症反应,本文采用ELISA方法检测各组大鼠脑组织匀浆中炎症因子表达的水平差异,结果发现,在HIBI模型大鼠脑组织中TNF-α、iNOS、IL-6炎症因子存在高表达和抗氧因子IL-10的低表达,而大黄酚有效调节了上述炎症因子在HIBI大鼠脑组织的表达水平,从而有利于减轻炎症造成的脑组织损伤。
自噬水平对维持细胞稳态必不可少,但自噬的异常激活常对细胞产生负面影响。研究表明,在HIBI新生大鼠模型中,自噬通常表现被过度激活[2,16],从而消耗选择性底物SQSTM1(Sequesto-some1),即在细胞内的SQSTM1水平受到自噬水平的调节,且蛋白表达水平与细胞自噬呈负相关[24]。而Bcl-2可与Beclin1结合降低自噬水平,进而减少缺氧引起的脑组织损伤[25]。本文研究也证实,自噬标记蛋白LC3II/LCI、Beclin1和Bax在HIBI模型中高表达,p62/SQSTM1和Bcl-2则表达减少,与上述研究结果一致。此外,大黄酚治疗能负向调节上述蛋白在HIBI模型大鼠脑组织的表达水平,进而有效降低脑组织的异常自噬水平,从而降低脑组织损伤。
mTOR是靶向哺乳动物细胞中重要的信号调节因子,参与机体多种细胞生物学,包括自噬、细胞周期和代谢等[26],mTOR表达异常与多种疾病进程相关,而激活其下游p70S6K靶点是自噬的必要途径[24]。Wang等[16]认为,新生儿时期经历HIBI可能导致青少年时期的学习和记忆能力的损伤,雷帕霉素作为mTOR信号激活剂加剧了脑神经损伤,具体表现为空间学习和记忆能力的下降。提示,自噬抑制可能是减轻脑组织损伤,改善后期空间学习和记忆能力的有效途径。为了明确mTOR/p70S6K信号通路在HIBI模型新生大鼠脑组织的表达情况,本文通过蛋白印迹实验检测了该通路磷酸化水平,结果发现,HIBI模型大鼠低表达p-mTOR和p-p70S6K,大黄酚能上调两者的蛋白表达。实验结果证明,大黄酚能通过抑制mTOR/p70S6K信号通路磷酸化激活而降低HIBI模型大鼠的自噬水平。此外,本文通过Morris水迷宫实验检测HIBI对新生大鼠的学习和记忆能力的影响,结果发现大黄酚改善了mTOR特异性自噬激活剂对HIBI造成的学习和记忆能力下降。综合实验结果证明,大黄酚对HIBI模型大鼠脑组织的损伤保护作用与增加mTOR/p70S6K信号通路活化有关。
本文研究表明,在HIBI新生大鼠模型中,大黄酚成功降低了模型大鼠脑组织含水量,减轻了脑组织病理损伤,调节脑组织中炎性细胞因子水平和自噬相关蛋白表达水平,且能逆转自噬激活剂对模型大鼠学习和记忆能力的影响。综上所述,大黄酚能改善HIBI新生大鼠脑组织病理损伤并降低脑组织炎症反应,其机制可能与降低脑组织过度自噬有关。这为大黄酚在HIBI的临床治疗上提供了一定的实验数据。
