调节抑制对单色光中豚鼠眼屈光发育的作用
2020-01-09钱一峰陈志刚肖艳辉陆培荣
钱一峰,陈志刚,肖艳辉,陆培荣
(苏州大学附属第一医院眼科,江苏 苏州 215006)
由于不同波长光线进入眼内时发生折射角度不同,因此每一种波长光线各自形成焦点。不同光线间波长相差越大,其焦点相距越远,即纵向色像差[1-2]。视觉调控下发生的眼球正视化过程是使光线焦点落在视网膜上。但由于纵向色像差的存在,自然光中不同波长光线的焦点不可能同时落在视网膜上,由此造成眼球视网膜上不同视锥细胞接受对应敏感波长光线的刺激时具有不同的模式、不同的偏好,即短波长敏感视锥细胞偏好于接受处于近视离焦状态的短波长光的刺激,长波长敏感视锥细胞偏好于接受处于远视离焦状态的长波长光的刺激[3-4]。
以上是在具有混合波长光线的自然光中的情况,但在波长单一的单色光中上述视锥细胞接受光刺激时的偏好是否仍会保留尚待探讨。有研究[3,5-6]显示在短波长光中受试者会发生调节过度的现象,此时短波长光因过度调节作用其焦点会位于视网膜前,使得短波长敏感视锥细胞仍然保留原来的感光偏好。单色光中豚鼠屈光发育研究[7-9]显示豚鼠眼球出现远高于单色光间色像差的屈光补偿。而鱼类和鸡在单色光中的屈光补偿程度与色像差大小相当[2,4,10-16]。豚鼠视网膜上主要分布有短波长敏感和中波长敏感两型视锥细胞,光谱吸收峰值分别为430 nm和530 nm[17]。当饲养一种单色光中时,豚鼠眼视网膜感光模式如果为达到原来偏好,其必须借助眼调节反应。因此假设在短波长单色光中豚鼠眼发生过度调节使光线聚焦于视网膜前,形成近视离焦;在中波长单色光中豚鼠眼仍可发生调节反应使得单色光物像呈远视离焦状态。本研究中豚鼠一眼行连续阿托品滴眼液点眼抑制调节,另一眼不做处理进行对照,观察在单色光中眼球屈光发育情况,以研究调节在单色光诱导豚鼠眼球屈光发育中的作用。
1 材料与方法
1.1 实验动物和实验设计
本研究使用约2周龄的英国短毛三色种豚鼠,共24只,随机平分成3组,分别置于蓝光(波长430 nm)、绿光(波长530 nm)和白光(色温5 000 K)中饲养6周。每组豚鼠右眼在实验开始后每天上午8:00使用1%阿托品滴眼液(复旦大学附属眼耳鼻喉科医院)1次,直至实验结束。实验前后进行眼屈光发育相关检查,包括屈光度、角膜曲率半径、眼轴长度及其组成成分测量。
1.2 饲养和光照条件设置
3个独立放置于暗室中的木箱用作不同光照场所,相互间用遮光布隔开。木箱长宽高约200 cm×100 cm×120 cm,四面开窗通风,一面开门取放饲养笼子。饲养豚鼠的钢丝笼子置于木箱中央。木箱内面涂装白色反光涂料且每面安装4~6支约1 m长LED灯管(底面除外)。蓝光LED灯管提供短波长准单色光照,波峰为430 nm,半波宽20 nm。绿光LED灯管提供中波长准单色光照,波峰530 nm,半波宽30 nm。白光LED灯管提供宽光谱照明,色温5 000 K。经光谱分析仪检测,本研究两种单色光波峰分别对应豚鼠视网膜两种视锥细胞(仅两种)光谱吸收峰值,且波宽范围不会相互交叉[17]。实验使用的白光光谱覆盖这两种视锥细胞的光谱吸收范围[17],且组成均衡。每组光照设置相同光照条件,使用ILT1700科研用辐射仪(美国International Light Technologies公司)进行检测,德力西TDGZ-50调压器进行调节。本研究取豚鼠饲养笼子中央底面为检测点,测量光量子数,均调整为每秒3×10-4μmol/cm2。具体光照设置参考已有研究方法[7,9]。每一组光照时间均为12 h,开始时间为每天早上8:00。饲养室内保持恒温(22~26 ℃)恒湿(55%~65%),豚鼠排泄物每天定时清除。
1.3 眼球参数测量
豚鼠屈光度和眼球参数测量由两位研究者配合进行,并使用单盲法。为避免使用过强睫状肌麻痹剂对实验结果产生影响,实验开始时使用1%盐酸环戊通滴眼液(ALCON)麻痹豚鼠双眼睫状肌,方法为每5 min一次共滴4次,1 h后于暗室行检影验光。实验结束时为使左右眼达到相当的睫状肌麻痹效果,采用双眼点1%阿托品滴眼液,每天3次,连续3 d,第4天行检影验光。本研究使用Topcon OM-4角膜曲率计检测豚鼠角膜曲率半径。因豚鼠角膜曲率较大,直接测量无法进行。参考文献方法将+8.0 D球镜片贴于曲率计检测镜前,测得读数再换算成豚鼠实际角膜曲率半径[18-19]。记录时取两条垂直子午线曲率的平均值。上述检测完成后,豚鼠在0.4% 盐酸奥布卡因(日本Santen公司)表面麻醉后行A超眼轴生物参数测量,测量由Optikon Hiscan A超仪完成。测量参数包括眼轴长度、玻璃体腔长度、前节长度和晶状体厚度。上述具体检测方法参考已有文献[20-21]进行。
1.4 统计学处理
各实验组左右眼及单眼前后参数比较采用配对t检验或Wilcoxon配对秩和检验。组间同侧眼参数比较采用方差分析,两两比较采用Bonferroni法。所有统计分析使用STATA 15.0统计软件进行数据分析,以P<0.05为差异有统计学意义。
2 结果
2.1 眼球屈光度的变化
实验开始时各组双侧眼屈光度差异无统计学意义(P>0.05,约4.25 D,表1)。6周时,绿光组右眼屈光度约为3.47 D,左眼约为4.17 D,左右眼屈光度比较差异有统计学意义(P=0.0280,表2)。同样,此时蓝光组双眼屈光度差异有统计学意义(P=0.0003,表2),左右眼屈光度分别为6.31 D和5.53 D。但是,6周时白光组左右眼屈光度差异无统计学意义(P=0.7486,表2),分别为4.88 D和4.81 D。
实验开始时各组间同侧眼屈光度差异无统计学意义(P>0.05,表3)。实验结束时3组同侧眼屈光度组间比较差异有统计学意义(P<0.0001,表4)。其中3组左眼屈光度两两比较差异均有统计学意义(P<0.05,表4)。绿光组和蓝光组以及绿光组和白光组右眼屈光度比较差异有统计学意义(P<0.05,表4)。而蓝光组和白光组右眼屈光度比较差异无统计学意义(P=0.072,表4)。
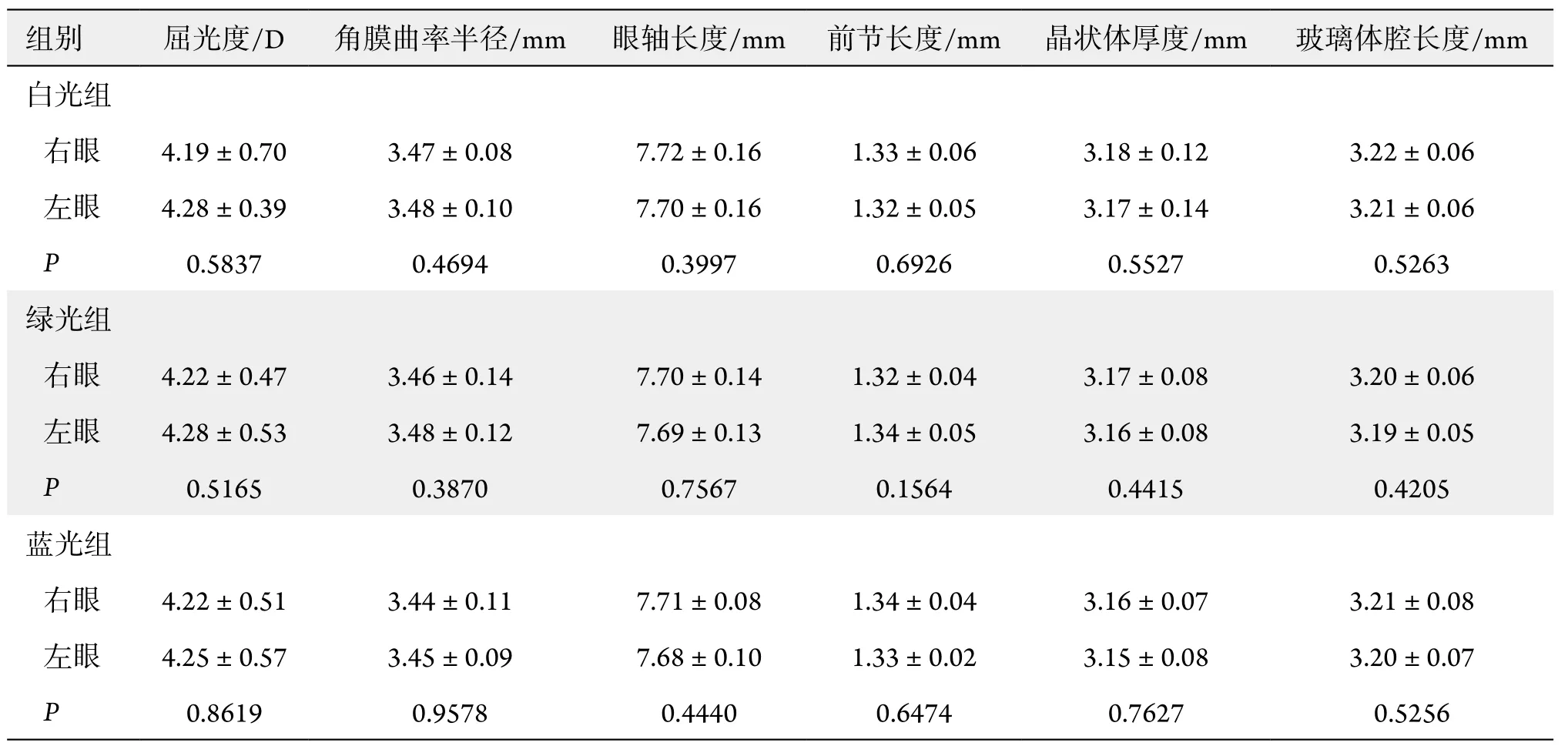
表1 实验开始时各组双眼参数及左右眼比较结果(左右眼参数比较采用配对t检验或Wilcoxon配对秩和检验)Table 1 Binocular mean biometric results from guinea pigs in three groups and the comparison between two eyes in each group at the beginning of the experiment (A paired t-test or Wilcoxon matched-pairs signed-ranks test was used for comparison)

表2 实验结束时各组双眼参数及左右眼比较结果(左右眼参数比较采用配对t检验或Wilcoxon配对秩和检验)Table 2 Binocular mean biometric results from guinea pigs in three groups and the comparison between two eyes in each group at the end of the experiment (A paired t-test or Wilcoxon matched-pairs signed-ranks test was used for comparison)

表3 实验开始时各组间同侧眼参数及比较结果(组间同侧眼参数比较采用方差分析,两两比较采用Bonferroni法)Table 3 Comparison of the results of unilateral eye parameters of guinea pigs among three groups at the beginning of the experiment (A one-way ANOVA was used for inter-group comparison)

表4 实验结束时各组间同侧眼参数及比较结果(组间同侧眼参数比较采用方差分析,两两比较采用Bonferroni法)Table 4 Comparison of the results of unilateral eye parameters of guinea pigs among three groups at the end of the experiment(A one-way ANOVA was used for inter-group comparison and the Bonferroni procedure with type-I error adjustment was performed for multiple group comparison)
绿光组右眼屈光度实验前后比较差异有统计学意义(0.75 D,P=0.0344),而左眼屈光度实验前后比较差异无统计学意义(0.12 D,P=0.6591)。蓝光组右眼屈光度实验前后比较差异有统计学意义(-1.31 D,P=0.0007),左眼屈光度实验前后同样差异有统计学意义(-2.06 D,P=0.0003)。白光组右眼屈光度实验前后差异无统计学意义(-0.63 D,P=0.1232),而左眼差异有统计学意义(-0.59 D,P=0.0234)。
2.2 眼轴长度的变化
各组双眼眼轴长度在实验开始时均约为7.7 mm,组内及组间差异无统计学意义(P>0.05,表1,表3)。实验结束时,绿光组右眼眼轴约为8.33 mm,左眼为8.24 mm,双眼间差异有统计学意义(P=0.0038,表2)。此时蓝光组右眼眼轴约为8.05 mm,左眼为7.99 mm,双眼间差异有统计学意义(P=0.0106,表2)。但6周时白光组双眼眼轴长度差异无统计学意义(P=0.2359,表2),右眼为8.16 mm,左眼为8.15 mm。
实验结束时同侧眼组间眼轴长度比较差异有统计学意义(P<0.0001,表4)。其中各组右眼眼轴长度两两比较差异均有统计学意义(P<0.05,表4)。绿光组和蓝光组以及蓝光组和白光组左眼眼轴长度比较差异有统计学意义(P<0.01,表4)。而绿光组和白光组左眼眼轴长度比较差异无统计学意义(P>0.05,表4)。
各组单侧眼实验前后眼轴长度比较差异均有统计学意义(P<0.05)。
2.3 玻璃体腔长度的变化
实验开始时各组双眼玻璃体腔长度均约为3.2 mm,组内及组间差异无统计学意义(P>0.05,表1,3)。实验结束时,绿光组右眼玻璃体腔长度约为3.40 mm,左眼为3.32 mm;蓝光组右眼玻璃体腔长度约为3.18 mm,左眼为3.11 mm,差异均有统计学意义(P=0.0113,0.0017,表2)。但6周时白光组双眼玻璃体腔长度均约3.25 mm,差异无统计学意义(P=0.9371,表2)。
6周时同侧眼玻璃体腔长度差异有统计学意义(P<0.01,表4)。与绿光组相比,白光组及蓝光组右眼玻璃体腔长度差异均有统计学意义(P<0.01,表4);而蓝光组和白光组右眼玻璃体腔长度差异无统计学意义(P=0.182,表4)。与蓝光组比较,绿光组、白光组左眼玻璃体腔长度差异均有统计学意义(P<0.01,表4);而绿光组和白光组左眼玻璃体腔长度差异无统计学意义(P=0.242,表4)。
白光组双眼实验前后玻璃体腔长度差异无统计学意义(右眼P=0.1006,左眼P=0.0714)。绿光组双眼实验前后玻璃体腔长度差异有统计学意义(右眼-0.20 mm,P=0.001;左眼-0.13 mm,P=0.0138)。蓝光组右眼玻璃体腔长度实验前后差异无统计学意义(0.03 mm,P=0.4199),而左眼差异无统计学意义(0.09 mm,P=0.0635)。
2.4 角膜曲率半径、前房深度和晶状体厚度的变化
实验开始时各组角膜曲率半径约3.46 mm(表1),实验结束时增长到约3.74 mm(表2);各组前房深度从实验开始时约1.33 mm(表1)增加到实验结束时约1.42 mm(表2);各组晶状体厚度从实验开始时约3.16 mm(表1)增加到实验结束时约3.48 mm(表2);眼球生物学参数实验前后差异均有统计学意义(P<0.05),但实验开始及结束时组间和组内差异均无统计学意义(P>0.05,表1~4)。
3 讨论
实验开始时各组双侧眼间各项参数均无显著差异。但实验结束时绿光组和蓝光组双侧眼间屈光度、眼轴长度和玻璃体腔长度出现显著差异,而角膜曲率半径、前房深度和晶状体厚度却没有差异。不同的是白光组双眼间各项参数始终无差异。这提示阿托品影响绿光组和蓝光组中豚鼠右眼在各自单色光中眼轴和玻璃体腔的延长;而阿托品对白光组中豚鼠右眼屈光发育无显著影响。参考前期研究[7-9]各单色光中预测的屈光补偿幅度可知,本研究中1%阿托品能够强化530 nm单色光对豚鼠眼的作用,促进了530 nm单色光中右眼眼轴和玻璃体腔的延长并产生大于左眼对照的近视;1%阿托品能抑制430 nm单色光对豚鼠眼的作用,减弱了430 nm单色光抑制豚鼠右眼玻璃体腔延长(实验中出现缩短现象)的作用产生相对于左眼较少的远视;而对于白光中的豚鼠,1%阿托品不能显著影响眼轴和玻璃体腔长度,双眼间未产生屈光差异。
3组右眼参数比较提示不同单色光即使在阿托品干预下仍可诱导豚鼠眼产生不同的屈光发育过程。即530 nm单色光可诱导阿托品化的豚鼠眼出现玻璃体腔延长和近视漂移;430 nm单色光能诱导阿托品化的豚鼠眼出现显著眼轴生长抑制和远视漂移。530 nm和430 nm单色光组右眼在阿托品的干扰下仍可诱导出现显著的玻璃体腔长度差异(0.22 mm)和屈光差异(约2 D)。此时单色光组右侧眼间屈光度差异仍大于这两种波长间约1.5 D的纵向色像差[7]。参考已有豚鼠单色光作用研究[7]显示:6周时这两种波长光照后豚鼠眼屈光度差值约为3.8 D,玻璃体腔长度差异为0.29 mm。由此可见,在本研究结束时两组单色光导致的屈光度差异受到阿托品的影响而低于预计度数。
各组中未滴阿托品的左眼在实验结束时出现显著的屈光度、眼轴长度和玻璃体腔长度的差异,而其他参数无显著差异。6周时,与白光组相比绿光组左眼具有显著降低的屈光度,但眼轴和玻璃体腔长度差异不显著。此时与白光组相比蓝光组左眼具有显著较短的眼轴与玻璃体腔,屈光度为相对远视。绿光组和蓝光组左眼间存在较大的屈光度、眼轴和玻璃体腔长度的显著差异。以上情况与单纯单色光研究结果一致[7-9]。
阿托品可对眼球睫状肌产生麻痹作用,影响调节。本研究中3个组右侧眼均受到调节抑制的影响,但是否完全麻痹尚不清楚。根据绿光组和蓝光组双眼结果的差异可以推测:两种单色光中豚鼠眼可以发生调节;调节反应可能参与了豚鼠眼对单色光的屈光补偿过程;不同调节水平可能会影响单色光中屈光补偿的幅度。
有研究[3,6]提示受试眼在短波长光中可出现调节过强的情况。结合已往研究[7-9]结果,本研究发现豚鼠可能在430 nm单色光中调节反应灵敏,并发生高于平常水平的过度调节,具有较好视力,同时能较好地调控眼球的生长,进行屈光补偿,结果导致屈光度变化量较大。这一推测的一个依据是豚鼠视网膜上具有广泛分布的高密度短波长敏感视锥细胞[17],并且与国外研究者[17,22]的观点一致。530 nm单色光中屈光度会随调节抑制发生变化,这也间接说明豚鼠在这一单色光中同样具有较好的调节功能,同时也能较好的调控眼球生长进行屈光补偿。这一推断的支持证据当然还有豚鼠视网膜上高密度分布的中波长敏感视锥细胞,其吸收峰值波长与530 nm非常接近[17]。
已往研究[7-9]并不能确定调节系统是否参与单色光对豚鼠眼屈光发育的影响过程,而本研究结果能明确提示。另外从本研究结果可以进一步推测:豚鼠在430 nm单色光中过度调节的作用使位于视网膜前的像平面更靠近晶状体,诱导产生高于单色像差的远视变化;当抑制调节时像平面向后远离晶状体从而导致屈光度远视化减少。豚鼠在530 nm单色光中发生调节反应使得原来位于视网膜后的像平面也向晶状体移动但仍旧远视离焦,诱导屈光度向近视发展;此时如果调节反应不存在也是同样的离焦结果,但这一推测成立的话其诱导变化量预计会高于研究结果,并且本研究阿托品的作用结果很难解释;因此推测,当阿托品作用后530 nm单色光中的调节反应受到抑制,此时的像平面较原来有更大程度的远视离焦,出现更快及幅度更大的近视化。
1%阿托品加强了530 nm单色光促进豚鼠眼玻璃体腔延长和近视形成的作用,但减弱430 nm单色光抑制豚鼠眼玻璃体腔延长和远视形成的作用。阿托品影响单色光中豚鼠眼屈光发育的作用很可能是通过抑制眼调节反应实现的。这进一步提示眼调节反应可能参与了单色光中豚鼠眼的屈光发育机制。
