乙草胺对蛋白核小球藻的毒性效应研究
2020-01-08庄航薛文王柳富曹清晟王假真张莹莹魏文志
庄航,薛文,王柳富,曹清晟,王假真,张莹莹,魏文志,*
1. 扬州大学动物科学与技术学院,扬州 225009 2. 江苏高邮湖生态渔业发展有限公司,扬州 225009
乙草胺(acetochlor)于1971年由美国孟山都公司开发成功,目前是世界上最重要的除草剂品种之一,也是我国使用量最大的除草剂之一。乙草胺属于氯乙酰胺类除草剂,主要用于防除一年生禾本科杂草和部分阔叶杂草,可通过单子叶植物的胚芽鞘或双子叶植物的下胚轴吸收,吸收后向上传导,阻碍杂草中的蛋白质合成,而使杂草在短时间内失绿死亡[1]。按我国农药毒性分级标准,乙草胺虽然属低毒除草剂,但是已有调查显示,乙草胺可对人和试验鼠造成长期和不可逆的影响。研究表明,职业性接触乙草胺显著降低男性精液量、精子活力,增加精子畸形率[2];并且与肺癌、直肠癌、胰腺癌及黑色素瘤的发生有一定关系[3]。在饲料中添加乙草胺,通过24周的饲喂,可导致小鼠肝脏和肾脏的损坏和抗氧化系统机能障碍[4]。此外,乙草胺还被证实在小鼠的P450s酶系的作用下形成具有致癌作用的中间产物二烷基醌亚胺,增加大鼠鼻癌、肝癌和胃癌的发生率[5]。
我国乙草胺制剂每年使用量大约为2~3万t[6],而有效利用率仅为36.1%,其余的均进入环境中[7],水体是诸多化学物质的汇集场所,乙草胺在我国的各大水体中的检出率达到70%以上,例如乙草胺在辽河的浓度为8.4~826.6 ng·L-1,在长江的浓度高达398.3 ng·L-1,在近岸海水中浓度可达1 054.9 ng·L-1[8]。当然,在其他国家水体中也有乙草胺的检出,例如美国的Yazoo河和Mississippi河的中乙草胺检出浓度为130~1 660 ng·L-1,其在排污沟中最大浓度达11 400 ng·L-1[9-10]。
由于乙草胺在水体中的广泛存在,其对水生动物的毒性也受到较多关注。研究表明,乙草胺暴露可以引起斑马鱼胚胎的存活率、孵化率下降,致畸率上升[11];下调稀有鮈鲫的甲状腺激素水平,抑制其幼体发育和大脑发育[12];延迟蝌蚪前肢出现和后肢发育,从而影响蝌蚪的变态与生长[13];此外,乙草胺还被发现具有雌激素作用,可引起非洲爪蟾的睾丸向卵巢发育[14]。目前,关于乙草胺对浮游植物影响的研究较少,王洪斌等[15]报道了乙草胺能够刺激塔胞藻、绿色巴夫藻的氧化还原相关酶如超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性,李薪芳等[16]报道了乙草胺能够刺激铜绿微囊藻SOD和过氧化物酶(POD)活性。2个研究均证明了乙草胺可对浮游植物产生氧化胁迫,影响其生长性能。但是除了氧化胁迫外,乙草胺是否对浮游植物还有其他影响尚不明确,因此需要更多的研究来探索。
蛋白核小球藻(Chlorellapyrenoidosa)是地球上最早出现的生命体之一,属于绿藻门中的一种,为球形单细胞淡水藻,直径为3~8 μm,在水体中分布极为广泛。蛋白核小球藻富含蛋白质和叶绿素等成分,是一种高效的光合植物,并且易于在实验室培养,是一种理想的毒理学模式生物[17]。因此,本实验以蛋白核小球藻为模型,研究不同浓度的乙草胺对蛋白核小球藻的生长性能、叶绿素和光合作用产氧的影响,并研究了藻类光合作用相关基因光合系统基因A(psbA)、核酮糖-l,5-二磷酸羧化/加氧酶(rbcS)和1,5-二磷酸核酮糖羧化/加氧酶(rbcL)在乙草胺作用下的表达情况,为乙草胺的对浮游植物的影响提供新的依据。
1 材料与方法(Materials and methods)
1.1 实验材料
蛋白核小球藻购自中国科学院水生生物研究所,乙草胺原药购自西亚试剂(95%原药)。
1.2 实验方法
1.2.1 小球藻的培养及乙草胺暴露实验
小球藻的培养在500 mL的锥形瓶中进行,培养前锥形瓶采用干热消毒,在烘箱中加热至120 ℃,时间维持到2 h。培养用水煮沸至95 ℃消毒。培养液使用BG11。每个锥形瓶中加入300 mL的培养液。接入藻种后于光照培养箱培养,蛋白核小球藻初始浓度为3 500 ind.·mL-1,培养温度28 ℃,光照强度3 000 Lx,间歇光周期13 h∶11 h,每6 h摇动一次,以防止藻细胞贴壁或沉淀。在锥形瓶中加入乙草胺,使得乙草胺的终浓度分别为0、1、10、100、1 000和10 000 μg·L-1,每个浓度设置3个重复,并在暴露后的1、3和7 d观察和检测各实验指标。
1.2.2 小球藻密度测定
用移液器从锥形瓶中取500 μL藻液,稀释至合适浓度,后使用血小球计数板于显微镜下计数。每个样品重复计数3次,取平均值计算藻密度。
1.2.3 小球藻叶绿素含量测定
每次每个样品取25 mL藻液,使用玻璃纤维滤膜抽滤收集藻细胞,使用90%丙酮匀浆溶解定容后,以4 000 r·min-1离心3 min收集上清液定容至10 mL。使用1 cm的比色皿和分光光度计分别在664、647、630和750 nm测光密度,用90%丙酮作为空白对照。
1.2.4 小球藻光合作用产氧测定
在每个测试时间点,每个样品分别加10 mL藻液于100 mL的碘量瓶中,之后加入培养液直到满瓶,封上瓶口,放置到光照培养箱中,一瓶光照(培养温度28 ℃、光照强度3 000 Lx),另一瓶完全遮光,24 h后,测定溶解氧含量,光照的条件下,溶解氧的增加量就是净光合作用下释放的量,黑暗条件下,藻类仅仅进行了呼吸作用,溶解氧含量的减少量就是呼吸消耗的量。
1.2.5 基因表达分析
采集25 mL藻液,以6 000 r·min-1离心10 min,弃上清液收集藻细胞,使用Trizol一步法进行样品总RNA提取。通过琼脂糖凝胶电泳和微量分光光度计检测RNA质量和浓度,使用去基因组反转录试剂盒(南京诺唯赞)进行反转录得到cDNA,最后用实时荧光定量法检测各基因在各个样品中的表达,每个样品设3个重复,以18S做内参。使用2-delta delta Ct法分析定量数据。定量引物由铂尚生物技术(上海)有限公司合成,扩增效率均为90%~110%,定量引物序列如表1所示。
1.3 数据分析
各指标均使用平均值±标准误(mean±SE)表示。使用单因素方差分析(one-way ANOVA)分析数据的显著性。在分析之前首先进行数据的正态性分布(Shapiro-Wilk)以及方差同质性(Levene’ s test)检验,不符合正态性分布或者方差同质的数据进行log转化,然后再进行单因素方差分析。对存在显著性差异的数据采用Tukey post-hoc test进行后续检验,分析使用SPSS Statistics 17.0进行。
2 结果(Results)
2.1 乙草胺对小球藻生长的影响
由图1可知,乙草胺浓度为1、10、100和1 000 μg·L-1时,暴露时间<7 d对小球藻的生长均无明显影响(P>0.05),在暴露时间为7 d时,10 000 μg·L-1乙草胺处理组中,小球藻的密度与对照组相比显著低3.17倍,10 μg·L-1乙草胺处理组中,小球藻的密度比对照组显著升高0.63倍。
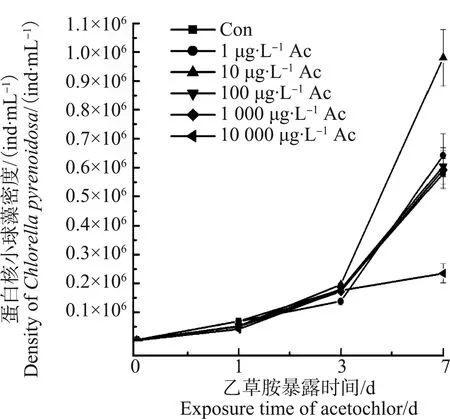
图1 乙草胺(Ac)对小球藻生长的影响Fig. 1 Effect of acetochlor (Ac) on the growth of C. pyrenoidosa
2.2 乙草胺对小球藻叶绿素含量的影响
如图2所示,在暴露1 d后,与对照组相比,10和100 μg·L-1乙草胺处理组中小球藻叶绿素a的含量分别显著降低了60%和32%(P<0.05),叶绿素b的含量分别显著降低了0.72倍和0.41倍(P<0.05);在暴露3 d后,10 μg·L-1乙草胺组中叶绿素b的含量显著提高了0.46倍(P<0.05),叶绿素a的含量与叶绿素b的含量变化相似,但是尚未达到显著水平(P>0.05);在暴露7 d后,10 μg·L-1乙草胺组中小球藻叶绿素a的含量显著增加了0.87倍(P<0.05),10 000 μg·L-1乙草胺组中叶绿素a的含量显著降低了1.14倍(P<0.05);小球藻叶绿素b的含量,在1和10 μg·L-1乙草胺作用下均显著上升了0.68倍(P<0.05),在1 000和10 000 μg·L-1乙草胺作用下分别显著降低了0.59倍和1.21倍(P<0.05)。

表1 定量引物序列Table 1 Primer sequences for qPCR
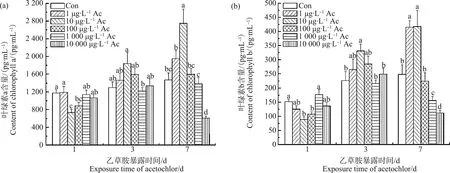
图2 乙草胺对小球藻叶绿素含量的影响注:不同小写字母表示差异显著(P<0.05);下同。Fig. 2 Effect of acetochlor on chlorophyll content of C. pyrenoidosaNote: Different lowercase letters indicate significant differences at P<0.05; the same below.
2.3 乙草胺对小球藻光合作用产氧量的影响
图3为乙草胺对小球藻光合作用产氧量的影响,在10 μg·L-1乙草胺中暴露1 d后,小球藻光合作用产氧量显著降低了76%(P<0.05);暴露7 d后,1和10 000 μg·L-1乙草胺组中小球藻产氧量分别显著降低了35%和42%(P<0.05)。
2.4 乙草胺对小球藻光合作用相关基因表达的影响
图4为小球藻光合作用相关基因在乙草胺的暴露下表达的变化。暴露1 d后,在所有浓度的乙草胺处理组中,psbA基因的表达均被显著诱导,其中以100 μg·L-1的诱导作用最为显著,psbA基因的表达与对照组相比显著上升了73.40倍(P<0.05)。随着暴露时间的延长,乙草胺对psbA的诱导作用减弱,在暴露的第7天,10和100 μg·L-1处理组中的psbA基因的表达,与对照组相比,分别显著下降至对照的16.9%和9.92%(P<0.05)(图4(a))。rbcL的表达变化与psbA表达变化相似,乙草胺在暴露1 d后显示出比较强烈的诱导效应,尤其是当浓度为100 μg·L-1时(升高133.01倍)(P<0.05),而在暴露3 d后,诱导效应显著减弱,在暴露7 d时,除了1 μg·L-1乙草胺显著提高了rbcL表达1.35倍(P<0.05),其余均无显著作用(P>0.05)(图4(b))。rbcS基因的表达在乙草胺的暴露下,变化不同于psbA和rbcL,除了在暴露3 d后,1和10 μg·L-1乙草胺对小球藻rbcS基因没有显著的作用(P>0.05)外,其余均表现出显著的诱导作用,尤其是较高浓度的诱导作用更为显著,10 000 μg·L-1乙草胺在暴露后的1、3和7 d,分别显著诱导rbcS基因表达升高39.86倍、192.52倍和44.85倍(P<0.05)(图4(c))。

图3 乙草胺对小球藻光合作用产氧量的影响Fig. 3 Effect of acetochlor on the oxygen production of C. pyrenoidosa

图4 乙草胺对小球藻光合作用相关基因表达的影响Fig. 4 Effects of acetochlor on the expression of photosynthesis-related genes in C. pyrenoidosa
3 讨论(Discussion)
乙草胺的大量使用导致了其在水环境中的广泛分布,给水域生态系统带来一定威胁。目前,关于乙草胺对水生动物影响的研究较多,而关于其对浮游植物影响的研究相对较少。浮游植物是水生态系统中的重要组成成分,因而评估乙草胺对浮游植物的毒性效应具有重要意义。蛋白核小球藻是一种重要的微藻资源,其繁殖快,分布广,容易在实验室条件下培养,并且对毒物较为敏感,因而是毒理学研究的理想材料。本实验中,笔者以蛋白核小球藻为模式生物,使用不同浓度的乙草胺作用1、3和7 d后,检测了小球藻的生长、叶绿素含量、光合作用产氧量以及光合作用相关基因表达这几个指标的变化,以对乙草胺对浮游植物的毒性有进一步认识。
小球藻的生长密度显示,在暴露1和3 d后,1~10 000 μg·L-1的乙草胺对小球藻的生长均无明显影响;至暴露的第7天,10 μg·L-1的乙草胺对小球藻的密度增长有显著的促进作用,而10 000 μg·L-1的乙草胺对小球藻的生长有显著抑制作用。梁卫玲等[18]以植物体内重要的过氧化物酶(POD)为指标,研究乙草胺对浮萍的毒性,结果显示,10~230 mg·L-1的乙草胺在暴露8 d后的毒性效应显著高于其暴露2、4和6 d后的毒性效应,并且在暴露8 d后,90 mg·L-1乙草胺对浮萍的POD活性有显著的诱导作用,而较高浓度(190~230 mg·L-1)对浮萍的POD活性有显著的抑制作用。这说明,首先,高浓度的乙草胺对水生生物的毒性具有一定的蓄积性,这可能与其在水环境中较长的半衰期有关,乙草胺水解半衰期通常是2 310 d (pH 7~10)[19];其次,乙草胺与许多其他毒物类似,低浓度时可通过激活生物的应激反应,来提高生物对不同程度胁迫作用的抵抗能力,比如萘、菲以及纳米氧化物对小球藻的毒性也表现出该效应[20-21]。
相对于小球藻的生长密度指标而言,叶绿素含量的变化更为敏感。在暴露的第1天叶绿素a和b的含量在100和1 000 μg·L-1处理组显著下降,在暴露第3天,叶绿素a的含量在100 μg·L-1处理组有显著上升趋势,叶绿素b含量也显著上升。值得注意的是,在暴露1和3 d后,小球藻的密度在各处理组并无显著变化,所以这2个时间点叶绿素含量的变化体现的是小球藻藻体内部含量的变化。因此,推测暴露刚开始时,在10 μg·L-1的较低浓度组,叶绿素对乙草胺的刺激比较敏感,含量迅速下降,但是机体很快表现出较强烈的应激机制,叶绿素的含量迅速上升。在暴露7 d后,小球藻叶绿素含量变化更为显著,但根据叶绿素变化倍数与藻密度变化倍数的关系可发现,在10和10 000 μg·L-1处理组中,藻密度的变化是叶绿素单位体积总量变化的主要原因。在暴露第7天,叶绿素b的含量在1 μg·L-1乙草胺处理组显著上升,而且这个变化不是因为藻密度,而是其自身含量上升,所以1 μg·L-1乙草胺对藻类同样具有毒性效应,只是相对于10 μg·L-1等较高浓度,需要累积更长时间。叶绿素含量的变化会直接影响光合作用产氧效率[22],所以本实验中在10 μg·L-1乙草胺处理1 d后以及10 000 μg·L-1乙草胺处理7 d后,光合作用产生氧气量变化可能是由于叶绿素含量下降所致。叶绿素a和叶绿素b的比值对植物的光合作用影响较大[23],在暴露3 d和7 d后,1 μg·L-1乙草胺处理组中叶绿素a和叶绿素b的含量上升幅度不同,叶绿素a和叶绿素b的比值必定发生变化,所以光合作用产氧量下降可能由于这个原因所致。
Dl蛋白是光系统Ⅱ(PSⅡ)反应中心的2个核心蛋白之一,在光合作用中介导电子传递(光能捕获)作用,由pbsA基因编码。因此,pbsA是高等植物和藻类叶绿体基因组中的一个重要光调控基因[24]。pbsA在乙草胺暴露1 d后表达显著上调,而随暴露时间延长上升幅度减小,至暴露第7天,pbsA在部分浓度组中下降。这说明,短时间乙草胺暴露可能对小球藻的光捕获能力有刺激作用,即小球藻对乙草胺毒害作用的反馈调节,而长时间的乙草胺暴露会逐渐减弱小球藻的光捕获能力。核酮糖-1,5-二磷酸羧化酶(Rubisco)是光合作用中催化碳固定的关键酶。Rubisco不仅催化卡尔文循环中CO2的固定,同时也参与植物光呼吸代谢过程,消耗植物光合作用合成的有机物,从而影响植物的净光合速率。常见Ⅰ型Rubisco酶由8个大亚基(RbcL)和8个小亚基(RbcS)组成。其中RbcL主要起催化作用,而RbcS主要起调节大亚基活性作用[25-26]。rbcL在乙草胺作用下表达模式与pbsA类似,rbcS基因的表达则是一直上升,但光合作用产氧量并未随基因表达的上升而上升,说明rbcL与rbcS的变化可能同样是小球藻对乙草胺对其光合作用损伤的反馈调节。
由此可见,乙草胺对蛋白核小球藻的毒性具有蓄积性,即较低浓度的乙草胺暴露可刺激其的生长,而较高浓度乙草胺则会抑制其生长;并且乙草胺会通过影响小球藻叶绿素的含量进而影响光合作用产氧量;光合作用相关基因pbsA、rbcL和rbcS在乙草胺暴露下变化显著,可能是小球藻对乙草胺毒害的反馈调节作用。
致谢:感谢高邮市科技项目(NO. GY201816)对本研究的资助。
