纳米材料对环境抗生素抗性基因污染扩散影响的研究进展
2020-01-08韩雪马晓琳晁韶良刘朝莹
韩雪,马晓琳,晁韶良,刘朝莹
江苏大学环境与安全工程学院,镇江 212013
抗生素滥用是发展中国家面临的一个威胁公共卫生安全的重要问题。抗生素的长期使用,已经迫使微生物不断进化出抗生素抗性基因(antibiotic resistance genes, ARGs)以抵御抗生素的胁迫。在这一矛与盾不断升级的过程中,抗生素和细菌耐药性之间总体呈现一种平衡状态。但是近年来,抗生素滥用及其引发的ARGs环境扩散,已经导致越来越严重的健康风险及生态破坏。因此,细菌耐药性进化与变异以及ARGs在环境研究领域的传播已日益受到高度关注。在众多促进ARGs环境扩散的因素中,纳米材料是近年来新出现并逐渐受到关注的一类新型环境效应物质。纳米材料作为一种新型环境污染物,正在不可避免地以多种方式被释放到环境中,因此,其对ARGs环境扩散的影响,已经开始受到研究者的关注。本文拟对近年来国内外在纳米材料促进ARGs环境扩散领域的相关研究进行概述,旨在为ARGs环境污染评估以及纳米材料非毒性环境效应评价等相关研究提供理论依据。
1 ARGs扩散的危害和影响因素(Harms and influencing factors of ARGs diffusion)
1.1 ARGs扩散的社会危害及产生机制
自然循环系统特别是水循环能使聚到一起的不同种类、不同来源的ARGs在不同细菌之间进行转移传播,从而增加环境细菌从低耐药性向高耐药性,从单一耐药向多重耐药甚至泛耐药转化,并最终形成超级细菌的潜在风险[1],而超级细菌的出现会导致目前使用的抗生素失效,使得人类将面临无药可用的境地。据世界卫生组织调查,耐药细菌甚至超级细菌所引起的全球死亡率每年已接近70万,预计到2050年将增加到每年1 000万[2-3]。ARGs扩散已然成为一个严重威胁全球公共卫生安全的重要问题[4]。另外,ARGs的扩散还能导致养殖业、水产业和种植业中病原微生物耐药性的增强,从而迫使抗生素的使用量不断增大。而这不但增加了生产成本,而且会进一步加剧ARGs的扩散。
细菌耐药性的提高主要有3种方式,一是来自于抗生素滥用所产生的抗生素选择压力引起细菌自身的抗生素抗性突变;二是亲代与子代之间基因垂直转移;三是细菌通过水平基因转移(horizontal gene transfer, HGT)的方式获得外源性ARGs,而这正是目前细菌获得耐药性的主要方式[5]。通常,细菌间发生HGT主要通过转化、转导和接合(图1)等3种方式进行[6]。转化是指处于感受态的细菌从环境中直接摄取游离状态的DNA,使其在细胞内进行整合表达。转导是基因借助病毒进行转移,即噬菌体攻击细菌细胞后,其携带的DNA等遗传物质进入细菌内部的过程。接合是借助质粒,通过细菌细胞间的接触发生DNA转移。
1.2 水环境中ARGs污染现状
2004年Rysz和Alvarez[7]首次提出ARGs已成为一个环境污染问题,而2006年Pruden等[8]明确提出将ARGs作为一种新型环境污染物。自此ARGs所导致的环境污染问题逐渐成为环境领域的研究热点。
作为一种环境污染物,ARGs能在环境细菌之间水平传播[9],并广泛出现于沉积物、湖泊、河流、土壤和污水处理厂废水等多种环境基质中。目前,已在不同的水环境中发现了多种抗生素抗性细菌,特别是在医疗实践中常见的大肠杆菌(Escherichiacoli)、克雷白氏杆菌(Klebsiellapneumoniae)和假单胞菌(Pseudomonades)等致病菌[10]。研究发现,在1940—2008年期间,荷兰采集的沉积物样品中包括大环内酯、青霉素和四环素在内的ARGs都呈逐年上升趋势[11]。而在我国长江三角洲地区的ARGs调查中,检测到了8种四环素ARGs(tetA、tetB、tetC、tetG、tetO、tetM、tetW和tetX)和2种磺胺类ARGs(sulΙ和sulⅡ)[12]。在北江水域也检测到四环素、红霉素和磺胺二甲嘧啶耐药细菌和基因,且含量显著高于美国科罗拉多州北部河流的研究结果[13]。在城市居民区、医院和城市污水中也检测到抗环丙沙星、磺胺甲恶唑、甲氧苄啶、喹诺酮、万古霉素和四环素的ARGs和细菌[14-17]。

图1 抗生素抗性基因(ARGs)水平转移方式分子机制示意图Fig. 1 Diagram of the molecular mechanism of horizontal transfer of antibiotic resistance genes (ARGs)
1.3 影响ARGs传播的因素
ARGs的HGT是在开放的自然环境中进行的,在此过程中,很多环境理化因素都能影响ARGs的HGT。例如,环境pH值和温度会影响ARGs的传播。Huang等[18]发现,酸性条件有利于四环素抗性基因的HGT,而碱性条件则会抑制转移过程的进行。这可能是由于酸性条件能增加携带ARGs的质粒数量,增强抗性菌株繁殖,从而促进ARGs的水平传播。Nagachinta和Chen[19]研究了不同温度条件下ARGs的接合转移过程,结果发现,接合转移发生在17~37 ℃之间,而低于该温度则检测不到接合转移子。这可能是由于F菌毛的表达受到环境温度调控,在25 ℃以下F菌毛基因不表达[20]。抗生素产生的选择压力是ARGs产生HGT的首要因素,即使低剂量的抗生素也能加快ARGs的HGT和扩散[21-22]。而氯气、双氧水及紫外线等消毒措施也能对ARGs转移产生影响。Ye等[23]发现,亚抑制浓度的游离氯、氯胺及双氧水可以促进含多种ARGs的质粒在属内和跨属细菌间的HGT。Lu等[24]证实环境相关浓度的三氯生能促进含多种ARGs的质粒在属内和跨属产生HGT。但是Chang等[25]发现UV254处理却能有效降解细菌胞外的ARGs。
另有许多研究证实,环境中的离子液体、重金属和有机化合物等环境污染物也能对ARGs的HGT具有不同程度的促进作用。Wang等[26]发现离子液体能显著促进质粒介导的ARGs的接合转移。Zhang等[27]研究了低浓度重金属对ARGs在细菌间的HGT的影响,证实亚抑制浓度的重金属可以提高ARGs的转移效率。而Jiao等[28]研究纺织印染废水中的6种代表性有机化合物对抗性质粒接合转移的影响,发现6种有机化合物均可提高ARGs接合转移效率。而纳米材料的广泛使用已导致其释放到环境中,成为一种新型环境污染物,并在环境中与ARGs不可避免地相遇,从而对ARGs的传播产生重要影响。
2 纳米材料对ARGs扩散的影响(Effects of nanomaterials on ARGs diffusion)
2.1 纳米材料应用及微生物环境效应
纳米材料因具有小尺寸效应、界面与表面效应、独特的化学性能,使其在电子、化工、医疗和环境保护等众多领域得到广泛的应用[29]。但是纳米材料的大量生产和使用,使其不可避免地被释放到环境中。纳米材料易扩散、难回收,进入环境后会对生态环境产生不利影响。
纳米材料常具有多种不同的途径对微生物产生毒性效应。例如通过吸附或者静电作用结合于微生物细胞膜表面,进而对细胞产生损伤[30]。纳米材料还能诱导细胞产生活性氧从而导致脂质过氧化、蛋白质变性和DNA损伤,最终导致细胞死亡[31]。另外光响应纳米材料还可以通过光激发产生活性氧,并进而诱发细胞氧化应激作用并产生毒性胁迫效应[32]。纳米材料对微生物细胞膜稳定性及氧化应激机制的冲击,能够影响ARGs的跨膜进入过程以及细菌相关基因的表达,进而影响ARGs的转移效率。
纳米材料除了会对微生物造成毒性损伤,还能产生其他的非毒性效应。有研究发现,低光强紫外线光催化处理下,纳米TiO2产生的低水平光生活性氧(ROS)虽不能导致细胞毒性,却能阻碍生物膜的正常发育[33]。而生物膜的形成能够缩短环境微生物细胞之间的空间距离,从而对ARGs的水平传播具有潜在影响。
2.2 纳米材料对ARGs环境扩散的影响
近些年来,随着纳米材料环境影响研究的不断深入,纳米材料的非毒性环境效应也逐渐进入人们的视野。其中,纳米材料对于ARGs在环境中水平扩散的影响尤为受到重视(表1)。
大部分纳米材料在纯菌体系中对ARGs扩散能起到促进作用。如Qiu等[34]研究了纳米Al2O3浓度、接合菌液密度、接合时间以及接合温度等因素对ARGs接合转移的影响,发现在最适宜的条件下纳米Al2O3能将RP4质粒跨属的转移效率提高200倍以上,并将属内的转移效率提高至250倍以上。Ding等[35]也发现纳米Al2O3可以显著促进革兰氏阴性菌E.coli携带的耐药性质粒跨属转移至革兰氏阳性菌Staphylococcusaureus。Qiu等[36]还发现纳米TiO2也能显著提高RP4质粒在大肠杆菌间的接合转移,在轻微抑制细菌生长的情况下,纳米TiO2可以将接合转移效率提高56倍。Guo和Zhang[37]的研究表明,氧化石墨烯(GO)对抗生素抗性细菌活性影响较小;高浓度GO (>10 mg·L-1)可损伤耐药性质粒,降低细菌对抗生素的耐药性,而低浓度GO (<1 mg·L-1)几乎不损伤质粒,且所有实验浓度的GO都能显著提高ARGs水平的转移效率。这些结果显示,对于不溶性的纳米材料,因其机械损伤对细菌所造成的胁迫较小。在此情况下,纳米材料优越的吸附性能促进ARGs和菌体的结合,从而能显著促进ARGs的转移效率。而对于能够释放有毒重金属离子的具有较高微生物毒性的纳米材料,其对ARGs转移的促进作用只能在低胁迫条件下体现出来。Wang等[38]发现,细菌暴露于亚致死浓度(1~10 mg·L-1)的ZnO纳米颗粒可显著提高抗生素抗性质粒RP4的接合频率,其中大肠杆菌间的接合转移效率可提高24.3倍,混合菌群的水平转移效率可提高8.3倍。此外,纳米ZnO还将大肠杆菌摄取裸质粒pGEX4T-1的转化效率提高3倍。在此过程中,除了纳米ZnO的吸附作用外,其毒理效应对细胞膜稳定性的降低,也可能是促进质粒转化的重要原因。

表1 纳米材料对ARGs转移的影响Table 1 Effects of nanomaterials on ARGs transfer
注:TSS表示总悬浮固体,GO表示氧化石墨烯,nZVI表示纳米零价铁。
Note: TSS stands fortotal suspended solid; GO stands for graphene oxide; nZVI stands for nanoscale zero-valent iron.
实际水体和废水处理中环境条件复杂且微生物也多为混合菌群。纳米材料对ARGs在实际环境传播的影响较为复杂。Ren等[39]研究了生物污水处理厂中抗生素抗性细菌和ARGs的去除,他们利用纳米TiO2修饰的聚偏氟乙烯超滤膜处理污水处理厂的二级出水,发现该膜上的纳米TiO2在紫外光激发下可以有效地去除98%的ARGs,从而有效控制ARGs的HGT。Karaolia等[40]利用TiO2修饰的还原性GO (TiO2-rGO)材料对城市污水中的抗性细菌及基因进行去除,结果发现,在太阳光照条件下实际污水中ampC、mecA和ecfX基因可被成功去除,但sulI和ermB基因在处理后仍然能检测到。这些研究应该都是基于纳米材料光激发所产生的活性氧可氧化降解DNA,进而实现了对实际环境中ARGs扩散的控制。另外,非光催化纳米材料也能通过其吸附能力抑制ARGs的传播。Zou等[41]研究GO和抗生素共存的条件下对湖水中细菌摄取抗生素和ARGs转移的影响,发现GO可以和胞外抗生素形成复合物从而抑制细菌摄取抗生素,并将ARGs丰度减少2~3个数量级,同时GO在最适条件下可将携带ARGs的整合子转移效率减低55倍。Yu等[42]研究GO纳米片去除实际水样中的ARGs,结果发现,GO可以高效地去除环状和双链DNA所携带的tetA、sulII、ermB以及ampC等抗性基因。但是陆贤等[43]研究了纳米零价铁(nZVI)对污水中耐四环素菌耐药特性的影响,发现nZVI能显著促进四环素耐药基因的转移,并且转移频率在nZVI浓度为50 mg·L-1时达到最大。而Huang等[44]研究了CuO和ZnO纳米颗粒对污泥厌氧消化过程中ARGs增殖的影响,发现CuO和ZnO可促进tetC、tetQ、sulI和sulII的环境传播。这些结果显示纳米材料对ARGs扩散的作用可能涉及多种因素和机制,其最终的影响可能取决于多因素协同作用的综合效果。
3 纳米材料对ARGs扩散的影响机制(Mechanisms of nanomaterials on ARGs diffusion)
目前,关于纳米材料对ARGs扩散影响机制的研究主要集中于纳米材料本身物理性质对细菌物理状态的影响以及纳米材料产生的ROS对细菌生理代谢的调控这2个方面(图2)。
3.1 物理作用
纳米材料因具有超大的比表面积而易于附着于细胞表面[30],甚至能最终被细菌内化[45]。这一特性使得纳米材料能促进细菌聚集,使得细菌菌体之间保持稳定的近距离接触,从而有效促进ARGs在菌体之间的HGT。已有报道证实,纳米Al2O3能吸附在游离菌体表面,缩短供体菌与受体菌间的空间距离以形成“接合桥”,从而促进耐药质粒RP4的接合转移,而大颗粒Al2O3却无类似效果[34]。但也有研究揭示,纳米材料的吸附作用能够抑制ARGs的HGT。Zou等[41]发现GO上不同的表面含氧基团可以有效地吸附DNA分子形成DNA-GO的复合物,同时GO还能插入到DNA的双链中,影响质粒上ARGs的生物特性并强烈抑制ARGs的复制,从而降低ARGs的丰度并控制ARGs的污染水平。进一步的研究显示,GO纳米片对于环状质粒ARGs的吸附去除效率要高于对线性基因组ARGs[42],而遗传分子的结构差异可能是导致去除差异的原因。
纳米材料除了对细菌有吸附作用,其较小的尺寸和形状也会对细菌产生物理损伤。Ding等[35]研究发现,涡旋能使细菌细胞与纳米Al2O3之间碰撞和相互作用的机率增加,并使细菌表面产生了更多的纳米孔。这些纳米孔可能是耐药质粒或其他DNA进入细胞质的通道,进而促进ARGs的传播。

图2 纳米材料对ARGs扩散的影响机制注:ROS表示活性氧。Fig. 2 Mechanisms of nanomaterials on ARGs diffusionNote: ROS stands for reactive oxygen species.
3.2 活性氧自由基
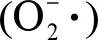
另外纳米材料诱导的ROS还能调控细菌接合转移相关基因的表达。研究发现,纳米TiO2能通过ROS抑制RP4质粒接合转移的负调控基因korA和korB的表达,从而促进DNA的转移和复制[36];纳米Al2O3则能在显著抑制3个负调控RP4接合转移基因表达的同时,激活正调控RP4接合转移的trfAp基因表达,进而促使RP4质粒的转移与复制[34]。
4 总结与展望(Summary and prospect)
本文全面阐述了纳米材料暴露对ARGs环境扩散的影响,以及纳米材料本身的物理性质和其诱发产生的ROS在ARGs水平转移中的作用机制,从而拓展对ARGs的环境扩散过程的理解,并对纳米材料非毒性环境效应的评估提供理论支持。但目前纳米材料对ARGs环境污染影响的研究中仍存在着一些不足并值得进一步深入探讨的问题:
(1) 环境中ARGs发生HGT的方式有3种:接合、转化和转导。目前的研究只探究纳米材料对接合和转化这2种方式的影响,而对转导扩散途径的影响还未见报道。因此下一步的工作应延伸至纳米材料对噬菌体介导的ARGs转导的研究。
(2) 纳米材料对ARGs扩散的影响,除了和材料自身的理化性质有关外,还和其对微生物的生物效应有重要关联。目前的研究多集中于纳米材料对ARGs扩散行为的研究,而忽视了转化过程中生物调控机制的解析。因此,下一步的工作应进一步探讨微生物对纳米材料响应机制及其对ARGs扩散的影响。
(3) 实际环境条件很复杂,纳米材料暴露于环境中,可能与其他环境物质共同对ARGs传播起作用。而目前的研究还仅限于纳米材料自身对ARGs扩散的影响。因此,需要从纳米材料的单因素影响拓展至复杂环境因素共同作用下的综合影响。
