QuEChERS/超高效液相色谱-串联质谱法同时测定香蕉中8种植物生长调节剂残留
2020-01-04吴学进王明月马晨张群庞朝海
吴学进 王明月 马晨 张群 庞朝海


摘 要:為了测定植物生长调节剂在香蕉中的残留,本研究建立了 QuEChERS 结合超高效液相色谱-串联质谱法同时测定香蕉中8种植物生长调节剂残留的分析方法。以1%乙酸-乙腈(V/V)为提取溶剂,样品前处理采用 QuEChERS 方法。以Agilent InfinityLab Poroshell 120 EC-C18柱为分离色谱柱,甲醇和5 mmol/L 乙酸铵-0.1%甲酸缓冲溶液为流动相,0.25 mL/min的流速梯度洗脱,10 min内可实现8种目标待测物分离。8种目标待测物经超高效液相色谱-串联质谱在选择反应监测模式下测定,基质匹配标准溶液外标法定量。结果表明,在5.0~100.0 μg/kg范围内线性良好,相关系数(r2)≥0.999;检出限(LODs)范围为0.03~0.6 μg/kg,定量限范围为0.10~2.0 μg/kg。在10、20、100 μg/kg 3个添加水平范围内,平均回收率在73.5%~107.2%之间,相对标准偏差(RSD)小于11%。本方法简便、快速、便捷、灵敏、准确,适用于香蕉中8种植物生长调节剂残留的测定。本方法的建立可为植物生长调节剂在其他果蔬中的残留检测提供参考。
关键词:QuEChERS;植物生长调节剂;超高效液相色谱-串联质谱;香蕉
中图分类号:S668.1 文献标识码:A
Simultaneous Determination of 8 Plant Growth Regulator Residues in Banana by Using Ultra High Performance Liquid Chromatography- Tandem Mass Spectrometry in Combination with QuEChERS Metho-
dology
WU Xuejin, WANG Mingyue*, MA Chen, ZHANG Qun, PANG Chaohai
Analysis and Testing Center, Chinese Academy of Tropical Agricultural Sciences / Hainan Provincial Key Laboratory of Quality and Safety for Tropical Fruits and Vegetables, Haikou, Hainan 571101, China
Abstract: In order to determine the residue of plant growth regulators in banana, a method was developed for the simultaneous determination of 8 plant growth regulators residues (PGRs) in banana by using QuEChERS (quick, easy, cheap, effective, rugged and safe) purification coupled with ultra high performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS). Using acetonitrile containing 1% acetic acid (V/V) as extraction solvent, the samples was prepared by the modified QuEChERS method. The chromatographic separation of 8 target compounds was accomplished in an Agilent InfinityLab Poroshell 120 EC-C18 column using methanol and 5 mmol/L ammonium acetate-0.1% formic acid buffer solution as mobile phase by gradient elution at a flow rate of 0.25 mL/min in 10 min. The 8 target compounds were analyzed by using UPLC-MS/MS in selective reaction monitoring (SRM) mode and then were quantified by the matrix matched standard calibration curve method. The method evaluation was done by matrix-matched calibration with linearity ranging from 5 to 100 ?g/kg with a correlation coefficient more than 0.999. The detection and quantification limit ranged from 0.03 to 0.6 ?g/kg and 0.10 to 2.0 ?g/kg, respectively. The average recoveries at three spiked concentration levels of 10, 20, 100 ?g/kg for all target compounds in the samples were in the range of 73.5% to 107.2%, with relative standard deviations (RSD) not more than 11%. The method is simple, quick, convenient, sensitive, and can be applied to analyze 8 plant growth regulators in banana. This method will provide a reference for the residue detection of plant growth regulators in other fruits and vegetables.
Keywords: QuEChERS; plant growth regulators; ultra high performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS); banana
DOI: 10.3969/j.issn.1000-2561.2020.11.022
植物生长调节剂(plant growth regulators, PGRs)是化学合成的与植物内源激素有相似生理作用的一类物质,在较低浓度下就能调节植物的生长发育和代谢过程,达到增产增效、改善品质等目的,在现代高效农业生产中得到广泛应用[1]。PGRs大部分属于无毒或低毒化学品,但近些年来,媒体对PGRs在果蔬中残留的问题炒作事件时有耳闻,引发公众对PGRs残留在食品安全问题上的关注和担忧。如前几年“乙烯利催熟香蕉”事件,不仅严重冲击了海南香蕉产业,也使部分消费者产生了恐慌心理。
香蕉(Musa spp.)属于芭蕉科(Musaceae)芭蕉属(Musa L.),由于其营养价值丰富,甘甜可口,是世界四大水果之一。根据现代农业产业(香蕉)技术体系抽样调查,2017年我国香蕉种植面积年总产量分别为393 333.3 hm2和1250万t[2],香蕉产业已成为我国海南、福建、广东、广西、云南等热区重要农业产业之一。植物生长调节剂作为高产优质高效农业的一项技术措施,也广泛应用用于香蕉的生产[3-4]。我国在GB 2763—2016《食品安全国家标准 食品中农药最大残留限量》中规定了乙烯利在香蕉残留限量值为2.0 mg/kg,但对其他PGRs在香蕉上并未规定残留限量值。目前国内外已有采用QuEChERS结合LC-MS/MS测定多种水果中植物生长调节剂残留的研究报道,但单独针对植物生长调节剂在香蕉中残留检测相关研究尚未见报道。研究开发快速、便捷、可靠的多组分植物生长调节剂在香蕉中残留的检测方法对于提高香蕉产品质量安全、保障香蕉产业健康发展具有重要意义。
本文采用QuEChERS结合超高效液相质谱联用技术,通过优化质谱参数和色谱条件,考察了色谱柱、流动相、提取方法、净化材料和基质效应等因素,建立超高效液相色谱–串联质谱法同时测定香蕉残留中8种PGRs残留的检测方法。本方法的建立可为香蕉及其他水果基质中多种PGRs的残留检测提供参考。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 香蕉样品购自海南省海口市当地水果市场。甲醇、乙腈、甲酸,均为HPLC级,美国Fisher公司;乙酸铵(HPLC级),美国TEDIA 公司;陶瓷均质子(货号:5982-9313)、QuEChERS 萃取盐包(货号:5982-6650)、QuEChERS 净化试剂盒(货号:5982-5022,5982-5122,5982-0028,5982-5421),美国Agilent公司;超纯水,经Milli-Q超纯水系统制备。
8种植物生长调节剂标准品:甲哌啶(mepiquat chloride)、矮壮素(chlormequat chloride)、氯吡脲(forchlorfenuron)、噻苯隆(thidiazuron),购自美国 Cato公司;6-苄基腺嘌呤(6-benzylaminopurine)、芸苔素内酯(brassinolide)、抑芽唑(triapentheno),购自德国 Dr. Ehrenstorfer 公司;多效唑(paclobutrazol,1000 mg/L)购自农业农村部环境质量监督检验测试中心。以上标准物质的质量浓度均大于97%。
1.1.2 仪器与设备 TSQ Quantum Access MAX 超高压液相–三重四极杆质谱仪,美国Thermo Scientific公司;L204型电子分析天平,瑞典梅特勒托利多公司;MS 3basic 圆周振荡器,德国IKA公司;Eppendorf 5415R小型冷冻离心机,艾本德中国有限公司;LXJ-ⅡB型离心机,上海安亭科学仪器厂;TXW-80A 微型涡旋混合仪,上海沪西分析仪器厂有限公司。
1.2 方法
1.2.1 标准溶液的配制 单标准储备液:将矮壮素等8种植物生长调节剂标准品分别用甲醇配制成为质量浓度为100 mg/L单标准储备溶液,将其置于–18 ℃避光密封储存备用(有效期为6个月)。
单标准工作溶液:分别吸取0.1 mL的上述单标准储备液于10 mL的容量瓶,用甲醇定容,配制成1.0 mg/L的单标准工作溶液,用于质谱检测条件优化使用(有效期为7 d)。
混合标准储备中间液:准确吸取8种单标准储备液各1.0 mL置于10 mL容量瓶,用甲醇定容,配制成10 mg/L标准储备中间液,将其置于4 ℃避光保存(有效期为30 d)。
混合标准上机溶液:分别移取一定量的混合标准储备中间液,用甲醇稀释配制成浓度为5、10、25、50、100 μg/L 系列混合标准上机溶液,现配现用。
混合香蕉标准上机溶液:分别移取一定量的混合标准储备中间液,用空白香蕉基质溶液稀释成浓度为5、10、25、50、100 μg/kg 系列混合标准上机溶液,现配现用。
1.2.2 样品前处理 香蕉樣品取全果切碎打浆混匀,制成待测样品,分装于洁净容器,置于–18 ℃备用。称取10.00 g (精确至0.01 g)样品于50 mL具塞离心管中,为了让样品与提取液充分混匀,在离心管内置有1个陶瓷均质子,加入10.0 mL含1%(V/V)乙酸-乙腈溶液,置于4 ℃冰箱内30 min;加入QuEChERS 萃取盐包,于1500 r/min振荡匀质2 min;然后以4000 r/min离心3min,取1.5 mL上清液置于QuEChERS 分散净化试剂管,涡旋混匀30 s后于10 000 r/min离心3 min;上清液用一次性注射器吸取,过0.22 μm有机滤膜,滤液按仪器优化工作条件进行测定。
1.2.3 提取溶剂的选用及提取操作 乙腈对于不同极性的物质均有较好的溶解性能,适用于萃取极性范围较宽的多种农药组分,且所提取的色素等干扰物质较少,适合于多组分同时检测的要求。是目前使用最广泛的提取溶剂。黄何何等[5]发现,选用含1%(V/V)乙酸的乙腈溶液作为提取溶剂时,带有羧基官能团的植物生长调节剂如赤霉素的萃取效率较高,这是由于在酸化乙腈条件下抑制了羧基在溶液中电离成离子形态。本研究也采用含1%(V/V)乙酸的乙腈溶液为提取剂。
1.2.4 提取体系的选用及提取操作 QuEChERS方法[6]于2003年被提出后,经过各国学者多年的优化和改进,目前形成了2种分析方法,即2007年美国发布的AOAC 2007.01法(醋酸盐缓冲体系)和2008年欧盟发布的EN 15662法(柠檬酸盐缓冲提取体系)。郝杰等[7]考察了原始的QuEChERS法、AOAC 2007.01法、EN 15662法等5种不同方法,结果表明,对于矮壮素等34种不同的PGRs在不同果蔬基质中,采用EN 15662法的提取效率最优,这可能是由于柠檬酸盐缓冲体系使得某些对pH敏感的植物生长调节剂能够被有效提取出来。因此,本研究也采用EN 15662法,所选取的QuEChERS 萃取盐包内含4 g MgSO4、1 g NaCl、1 g 柠檬酸钠和0.5 g柠檬酸二钠盐。萃取盐包内含的MgSO4、NaCl用于去除提取体系中的水分,促进待测物从水相转移到有机相;柠檬酸盐用于调节提取体系的pH,稳定提取体系的多组分成分。
1.2.5 净化方式的选用 QuChERS常用的吸附净化材料有N-丙基乙二胺(PSA)、C18、石墨化炭黑(GCB)等,其中PSA吸附剂可通过其乙二胺N-丙基官能团的极性作用,吸附样品中的有机酸、脂肪酸和糖等干扰物;C18吸附剂可通过其在硅胶上键合了十八烷基官能团的非极性作用,吸附极性较弱的脂肪酸、烯烃类及甾醇类、色素等大分子基;石墨化炭黑(GCB)对叶绿素、类胡萝卜素等色素以及固醇类杂质有很好的效果,但对含有平面结构的化合物具有强吸附作用[8]。
为了更好地净化检测液,减少干扰成分,提高分析准确度,本研究设计了4种净化方案:(1)50 mg PSA+150 mg MgSO4 ;(2)50 mg PSA+50 mg C18+150 mg MgSO4 ;(3)50 mg PSA+50 mg C18+7.5 mg GCB+150 mg MgSO4 ;(4)50 mg PSA+50 mg C18+50 mg GCB+150 mg MgSO4。取空白样品,配制成质量浓度为0.50 μg/mL的上述8种植物生长调节剂的混合标液;吸取1.5 mL混合标液加入上述4种净化材料体系中,每种方案做6个平行样品,通过其平均回收率考察不同方案的净化效果,最终选定优化方案。
1.2.6 基质效应评价 基质效应(matrix effect,ME)是指样品分析液中除分析物以外的共流出组分改变了目标分析物的响应值,从而影响定量分析的准确度和重现性的现象。基质效应可按下列公式计算:ME=(基质匹配标准曲线的斜率/试剂标准曲线的斜率)×100%[9]。若ME在80%~120%范围内,表明基质效应不明显;若ME>120%,表明基质增强效应显著;若ME<80%,表明基质抑制效应显著[10]。
1.2.7 液相条件 采用Agilent InfinityLab Poroshell 120 EC-C18柱(3.0 mm× 100 mm,2.7 μm);柱温为35 ℃;进样体积为2.0 μL;流速为0.25 mL/min;流动相A为5 mmol/L 乙酸铵-0.1%甲酸(V/V)水缓冲溶液,流动相B为甲醇。梯度洗脱程序:0~1.5 min,10% B;1~2.5 min,10%~60% B;2.5~4.0 min,60% B;4.0~5.0 min,60%~98% B;5.0~9.0 min,98% B;9.0~10.0 min,98%~100% B。
1.2.8 质谱条件 离子源:电喷雾离子源(elaectrospray ionization,ESI),采用ES+和ES-互切换模式;监测方式:选择反应监测(selective reaction monitoring,SRM);离子化温度:350 ℃;离子传输管温度:320 ℃;离子化电压:正极4000 V,负极–2700 V;鞘气压力:45.0 psi;辅助气压力:8.0 Arb。
1.3 数据处理
数据采集和定性分析使用仪器所配置软件Thermo Scientific Xcalibur 4.1;定量分析使用仪器所配置软件Thermo TraceFinder 4.1,采用外标法模式。
2 结果与分析
2.1 UPLC-MS/MS工作条件优化
采用电喷雾离子源(ESI),在正、负离子互切换监测模式下,将质量浓度为1.0 mg/L的8种植物调節剂单标准溶液以50 μL/min的流速分别持续注入离子源,通过一级全扫描(full scan)模式确定丰度较高且稳定的母离子。确定母离子后,采用Q1扫描模式,优化Tube Lens 电压值,使分子流顺利通过锥孔的母离子丰度达到最大值;在确定优化Tube Lens 电压值下,采用Q3扫描模式,对母离子给予一定的碰撞能量,全扫描二级子离子,选取丰度相对较高的2个子离子分别作为定量和定性离子。在8种植物生长调节剂中,6-苄基腺嘌呤、氯吡脲、噻苯隆、芸苔素内酯在正负离子模式下均有响应,但正离子模式下响应值较高,因此最终8种植物生长调节剂均采用正离子模式扫描。具体优化分析条件见表1。
2.2 色谱条件的优化
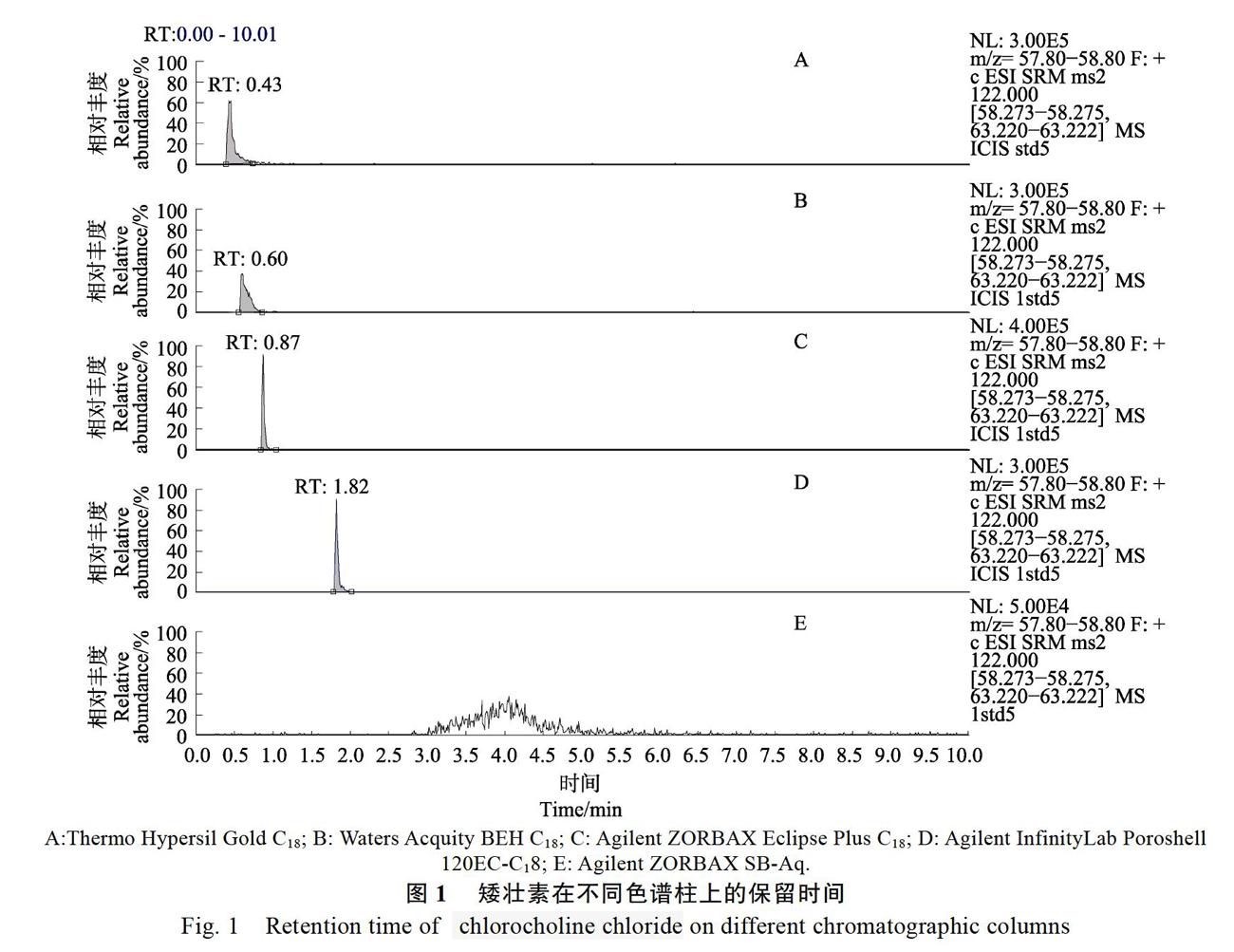
多组分分析方法的建立需要兼顾极性差异较大的各种化合物,选择合适的色谱柱是关键,因此本研究考察了Thermo Hypersil Gold C18柱(100 mm×2.1 mm, 1.9 μm)、Waters Acquity BEH C18柱(100 mm×2.1 mm, 1.7 μm)、Agilent ZORBAX Eclipse Plus C18柱(2.1 mm×150 mm, 1.8 μm)、Agilent InfinityLab Poroshell 120 EC-C18柱(3.0 mm×100 mm, 2.7 μm)和Agilent ZORBAX SB-Aq柱(2.1 mm×100 mm, 1.8 μm)色谱柱对上述8种植物生长调节剂待测组分分离的效果。在确定液相条件(见2.3节)下,经比较发现强极性的矮壮素在上述色谱柱的保留时间分别为0.43、0.60、0.87、1.82、4.00 min,但矮壮素在Agilent ZORBAX SB-Aq色谱柱的拖尾比较严重,见图1。由于矮壮素在Agilent Infinity Lab Poroshell 120 EC-C18色谱柱得到很好的保留,且其他7种植物生长调节剂待测化合物在全时间段上也可以均匀出峰,故最终选定Agilent Infinity Lab Poroshell 120 EC-C18柱作为后续研究用的色谱柱。
2.3 流动相的比较及选择
考察了乙腈-水、甲醇-水以及甲醇-0.1%甲酸溶液、甲醇-0.1%甲酸-乙酸铵4种缓冲溶液等作流动相时的分离情况。结果表明,乙腈-水和甲醇-水这2个体系中,乙腈和甲醇作为强洗脱的流动相都能使8种植物生长调节剂待测化合物实现分离,但其整体响应值在甲醇-水体系的相对要优于乙腈-水体系。此外还发现,在甲醇-水中加入0.1%甲酸能有效改善目标待测物的峰形;进一步考察发现,在水相中加入5.0 mmol/L的乙酸铵后,在正、负模式下均能促进各化合物电离的效果,这与张泸文等[11]考察不同流动相体系对残留于果蔬中26种不同PGRs的影响结果是一致的。综上考虑,本研究最终确定甲醇-水(内含0.1%甲酸和5.0 mmol/L乙酸铵)缓冲溶液体系作为流动相。图2是在香蕉空白基质中添加质量浓度为100 μg/kg 8种植物生长调节剂 SRM色谱图。
2.4 净化方案比较选择
本研究设计的4种净化方案结果表明,PSA和C18对上述8种植物生长调节剂均无明显吸附作用,但GCB对6-苄基腺嘌呤、芸苔素内酯、氯吡脲、噻苯隆均有吸附,并且随着GCB用量由7.5 mg增加至50 mg时,6-苄基腺嘌呤和芸苔素内酯的回收率均小于40%,而氯吡脲、噻苯隆的回收率则均小于10%(图3)。基于香蕉基质具有高糖、低脂、低色素的特点,结合上述4种净化方案的效果,本研究没有选择C18和GCB作为净化材料,只选择PSA用于去除香蕉基质中糖分和脂肪酸,其用量为50 mg,并加入150 mg MgSO4 用于去除提取液中的水分。
2.5 方法的线性范围、检出限及基质效应
以香蕉空白样品提取液配制成的质量浓度5、10、25、50、100 μg/kg系列基质混合标准工作溶液,在已优化的UPLC-MS/MS的条件下进行测定,以待测目标化合物定量离子的峰面积y为纵坐标,质量浓度x(μg/kg)为横坐标,绘制标准曲线,得到8种植物生长调节剂的线性方程及相关系数。结果表明,矮壮素等8种目标待测物在质量浓度为5~100 μg/kg范围内与对应的峰面积呈良好线性关系(r2 ≥0.999),线性回归方程和相关系数见表2。
在空白基质中添加混合标准溶液,上机检测,以3倍信噪比(S/N≥3)计算该方法的检出限(LOD),以10倍信噪比(S/N≥10) 计算该方法的定量限(LOQ),相关结果见表2。
研究结果还表明,6-苄基腺嘌呤和氯吡脲的基质效应ME<80%,存在基质抑制效应,其余6种植物生长调节剂的基质效应ME在80%~120% 范围内,基质效应不明显(表2)。为了校正基质效应的影响,提高定量的准确度和可靠性,本研究采用基质匹配外标校准曲线对样品残留的PGRs残留进行定量。
2.6 方法的回收率与精密度
准确称取10 g(精确至0.01g)空白样品,添加8种植物生长调节剂,分别配制成添加水平为10.0、20.0、100.0 μg/kg的样品各6份,进行加标回收率实验,计算平均回收率和相对标准偏差,考察方法的准确度和精密度,结果见表3。结果显示,8种植物生长调节剂回收率为73.5%~107.2%,相对标准偏差(RSD)为1.3%~10.4%,符合方法学要求。
2.7 实际样品检测
采用本研究建立的方法测定了采集于海口本地水果批发市场和超市的20份香蕉样品,均未检出上述8种植物生长调节剂。
3 討论
PGRs残留的现有检测方法有离子色谱法、气相色谱法、液相色谱法、气相色谱-串联质谱法、 液相色谱-质谱法[12-17]等,其中液相色谱–串联质谱法具有样品前处理无需衍生化反应、响应灵敏、可同时定性定量等优点,是目前PGRs残留检测分析的优选方法。QuEChERS(quick, easy, cheap, effective, rugged and safe)法因其快速、简单、有效等显著优点是当前多组分农药残留检测的前处理优选的方法。尽管目前已有采用QuEChERS法结合超高效液相色谱–串联质谱法(UPLC-MS/MS)同时测定多组分PGRs在莲雾、柑橘、葡萄等水果残留的相关研究报道。但香蕉与上述的水果基质成分不同,其含的色素、糖分、蛋白质以及其他其干扰物种类也不同,所需用净化材料也不同;另外所测定的多组分PGRs化合物结构不同,其极性不同,QuEChERS法净化材料也有所差异;此外不同极性化合物在不同的分离色谱柱的保留时间也不相同,同步测定极性差异较大的多组分PGRs化合物所选用的色谱柱也不同。如乐渊等[18]选用C18和MgSO4作为净化材料,选用ACQUITY BEH C18色谱柱,应用超高效液相色谱–串联质谱法(UPLC-MS/MS)同时测定氯吡脲等16种PGRs。夏虹等[19]选用PSA和MgSO4作为净化材料,选用ACQUITY BEH C18色谱柱,建立了柑橘中矮壮素等12种PGRs残留的测定方法。邱暑婷等[20]选用为PSA、C18和MgSO4作为净化材料,选用Phenomenex XB-C18色谱柱,建立了同时测定葡萄中18种PGRs残留的方法。本研究针对香蕉基质设计了4组净化方案,经过比较最终选用PSA和MgSO4为净化材料,并细致地比较了目标待测物在5种色谱柱分离和保留的效果,最终选用Agilent InfinityLab Poroshell 120 EC-C18作为本研究的分离柱。
本文通过优化色谱条件和质谱条件,考察提取和净化方法,建立了QuEChERS/超高效液相色谱-串联质谱同时测定香蕉中8种植物生长调节
剂残留的分析方法。该方法前处理简单、便捷、灵敏度高,经方法学验证,加标回收率、精密度、最低检出限和定量限均能满足农药残留检测要求,可用于香蕉中PGRs残留检测分析。该方法的建立,完善香蕉基质中多组分农药残留分析检测技术,进一步完善香蕉产业体系技术体系建设,对于提高香蕉产品质量安全、保障香蕉产业健康发展具有重要意义。
参考文献
[1] 张新中, 彭 涛, 李晓春, 等. 植物生长调节剂的残留与安全性分析[J]. 食品安全质量检测学报, 2019, 10(3): 614-619.
[2] 王 芳, 谢江辉, 过建春, 等. 2017年我国香蕉产业发展情况及2018年发展趋势与对策[J]. 中国热带农业, 2018, 83(4): 27-32.
[3] 魏守兴, 谢子四, 罗石荣, 等. 植物生长调节剂在香蕉生产中应用研究进展[J]. 中国热带农业, 2013, 54(5): 48-50.
[4] 赵 明, 邹 瑜, 何海旺, 等. 多效唑在粉蕉生产中的安全使用技术研究[J]. 中国果树, 2016(4): 48-51.
[5] 黄何何, 张 缙, 徐敦明, 等. QuEChERS-高效液相色谱-串联质谱法同时测定水果中21种植物生长调节剂的残留量[J]. 色谱, 2014, 32(7): 707-716.
[6] Anatassiades M, Lehotay S J, Stajnbaher D, et al. Fast and easy multiresidue method employing acetonitrile extraction/partitioning an “dispersivesolid-phaseextraction” for the determination of pesticide residues in produce[J]. Journal of AOAC International, 2003, 86(2): 412-431.
[7] 郝 杰, 姜 洁, 毛 婷, 等. QuEChERS-超高效液相色谱-串联质谱法同时测定蔬果中34种植物生长调节剂的残留量[J]. 食品科学, 2018, 39(8): 267-275.
[8] 胡晓科, 孙丹红, 罗晓飞. QuEChERS-超高效液相色谱法检测瓜果中14种植物生长调节剂残留量[J]. 中国食品卫生杂志, 2019, 31(1): 29-34.
[9] 曹 慧, 陈小珍, 祝 颖, 等. QuEChERS/超高效液相色谱-串联质谱技术同时测定食品中13种植物生长调节剂残
留[J]. 化学试剂, 2013, 35(11): 1005-1009.
[10] 胡胜杰, 李 优, 周 莹, 等. QuEChERS法结合液相色谱?串联质谱测定保健食品中50种非食用添加物[J]. 色谱, 2019, 37(7): 701-711.
[11] 张泸文, 焦广睿, 王 柯, 等. QuEChERS-高效液相色谱-串联质谱法同时测定果蔬中26种植物生长调节剂残留[J]. 食品安全质量检测学报, 2016, 7(7): 2677-2689.
[12] 郝 杰, 冯 楠, 姜 洁, 等. 水果蔬菜中常见植物生长调节剂分析检测方法研究进展[J]. 食品科学, 2015, 36(21): 303-309.
[13] 朱作艺, 张 玉, 王君虹, 等. 离子色谱法同时测定植物生长调节剂中氯化胆碱、甲哌鎓及N-甲基哌啶[J]. 浙江大学学报(理学版), 2019, 46(3): 333-338.
[14] 周艳明, 付 婷, 胡 睿, 等. 气相色谱法测定蔬菜中三碘苯甲酸残留量[J]. 食品科学, 2010, 31(12): 178-181.
[15] 蒋振晖, 应铁进. QuEChERS-高效液相色谱法测定马铃薯中α-萘乙酸甲酯残留[J]. 分析试验室, 2018, 37(2): 131- 135.
[16] 张文华, 谢 文, 侯建波, 等. 气相色谱-串联质谱法测定豆芽与番茄中6种植物生长调节剂[J]. 分析测试学报, 2016, 35(10): 1241-1247.
[17] 諸 力, 王 晨, 陈红平, 等. 超高效液相色谱-串联质谱法同时测定茶叶中11种植物生长调节剂及吡虫啉、啶虫脒的残留[J]. 分析化学, 2017, (4): 529-536.
[18] 乐 渊, 李春丽, 张振山, 等. QuEChERS 净化-超高效液相色谱-串联质谱法测定莲雾中植物生长调节剂[J]. 分析科学学报, 2018, 34(2): 234-238.
[19] 夏 虹, 彭茂民, 刘 丽. QuEChERS-超高效液相色谱-串联质谱法同时测定柑橘中12种植物生长调节剂残留[J]. 食品科技, 2018, 43(10): 340-344.
[20] 邱暑婷, 林学飞, 傅冰梦, 等. QuEChERS/高效液相色谱-串联质谱法同时测定葡萄中18种植物生长调节剂残留[J]. 中国卫生检验杂志, 2017, 27(4): 931-936.
收稿日期 2019-11-27;修回日期 2020-02-13
基金项目 现代农业产业技术体系建设专项资金项目(No. CARS-31-13);国家农产品质量安全风险评估项目“豇豆中典型农药残留风险评估”(No. GJFP2019006);中国热带农业科学院基本科研业务费专项资金(No. 1630082017003)。
作者简介 吴学进(1982—),男,硕士,助理研究员,研究方向:农产品质量安全。*通信作者(Corresponding author):王明月(WANG Mingyue),E-mail:hkwmy0815@vip.163.com。
