SPLUNC1负向调控肺炎克雷伯菌夹膜多糖诱导细胞因子分泌①
2019-12-27曹二龙刘选梅贺印旎
曹二龙 谭 潇 刘选梅 肖 非 马 婷 贺印旎
(邵阳学院医学检验学院医学检验技术教研室,邵阳 422000)
肺炎克雷伯菌是全世界社区获得性和医院感染最常见的革兰阴性细菌,常见于免疫功能低下人群。肺炎克雷伯菌的主要毒力因子包括细菌表面成分是荚膜多糖(CPS)和脂多糖(LPS)[1]。有研究表明,K1血清型肺炎克雷伯菌(K1-CPS)的CPS可通过Toll样受体4诱导巨噬细胞分泌TNF-α和IL-6。在机体固有免疫系统与各种病原微生物相互作用过程中,具备多种机制拮抗病原微生物感染。短腭、肺及鼻咽上皮克隆1(Short palate,lung,and nasal epithelium clone 1,SPLUNC1)是从软腭、肺、悬雍垂和鼻腔分泌的一种先天免疫蛋白,主要由大气道上皮细胞表达和分泌[2]。SPLUNC1具有杀菌/通透性增加蛋白功能,同时也可抑制细菌生物膜的形成,并是某些恶性肿瘤的负调控因子[3]。在慢性气道炎症患者中,SPLUNC1表达水平升高,并且过表达SPLUNC1的小鼠对对铜绿假单胞菌和肺炎支原体的耐受显著增高。此外,也有研究表明SPLUNC1与革兰氏阴性细菌细胞壁成分脂多糖结合[4]。因此,SPLUNC1可能是机体抵抗微生物感染的一种重要机制。在先前的研究中,Liu等[5]发现肺炎克雷伯菌感染后可引起SPLUNC1表达增高,后者可调节气道液表面张力而阻止肺炎克雷伯菌生物膜形成。但肺炎克雷伯菌诱导SPLUNC1表达的机制目前仍不明确。本研究旨在观察肺炎克雷伯菌CPS对人肺上皮细胞表达SPLUNC1的影响,并探讨其在介导细胞因子分泌中的作用。
1 材料与方法
1.1材料 TNF-α和IL-8 ELISA试剂盒为eBioscience产品;实时定量PCR SYBR Green mix购自天根生化科技有限公司;LPS(E.coli 0111:B4)购自Sigma-Adrich;抗IκB多克隆抗体、SPLUNC1单克隆抗体购自Santa Cruz;NF-κB活性检测试剂盒购自Cayman;PDTC购自Calbiochem。
1.2方法
1.2.1肺炎克雷伯菌的培养与夹膜多糖提取 肺炎克雷伯菌(ATCC)用含有100 μg/ml氨苄青霉素或50 μg/ml卡那霉素的LB培养基中培养。按照参考文献提供的方法提取CPS[6]。即将培养的肺炎克雷伯菌用25 ml蒸馏水重悬浮,100℃加热10 min以释放其荚膜成分。随后加入体积分数为80%的丙酮4℃孵育2 h以沉淀CPS。沉淀物室温干燥过夜后用PBS重悬浮,30 000 g离心去除不溶物。随后将上清在4℃、100 000 g离心8 min,弃沉淀(LPS和蛋白)。上清用RNase B(30 μg/ml)和Dnase Ⅰ(70 μg/ml)在37℃消化24 h,然后用链霉蛋白酶溶液(含10 mmol/L Tris HCl,pH7.4,1 mmol/L CaCl2)消化24 h。最后用50 kD的透析膜对样品进行透析、冻干。CPS粗提物随后在TSK HW-65F柱上进一步纯化,最后用0~2 mol/L NaCl洗脱。最后采用高效体积排阻色谱法进一步分离LPS。苯酚-浓硫酸法测定CPS的浓度,即在不同浓度的葡萄糖溶液2.0 ml中加入6%苯酚1.0 ml及浓硫酸5.0 ml,充分反应后于490 nm测定其吸光值(OD)。以糖浓度为横坐标、OD值为纵坐标,绘制标准曲线。取上述提取的CPS 2 ml,重复上述测量标准品浓度的步骤,根据标准曲线计算出样品中多糖的含量。刺激细胞前采用2-酮基-3-脱氧辛酸(KOD)-硫代巴比妥酸法测定CPS中LPS的含量以排除LPS污染。
1.2.2细胞培养与处理 NCI-H292细胞用有10%胎牛血清和青霉素-链霉素的RPMI1640培养基中于37℃、5%CO2培养。当NCI-H292细胞生长至80%~90%密度时,加入0.5~3 μg/ml CPS孵育24 h。
1.2.3实时定量PCR检测 mRNA表达 通过逆转录测定上皮细胞中SPLUNC1 mRNA的水平,然后进行实时定量PCR。使用TRIzol试剂提取总RNA。在50 μl反应中使用1 μg总RNA和随机六聚体进行逆转录反应。使用Primer Express软件设计用于人SPLUNC1基因的引物和探针。人SPLUNC1:正向引物,5′-GGGCCTGTTGGGCATTCT-3′;反向引物:5′-CCTCCTCCAGGCTTCAGGAT-3′;探针,5′-AAACCTTCCGCTCCTGGA-3′。在ABI Prism 7700序列检测系统上进行PCR。 25 μl PCR反应含有30 ng cDNA,100 nmol/L荧光探针和200 nmol/L引物以及来自TaqMan RT-PCR试剂盒的其他组分。采用比较阈值循环(CT)方法,通过计算其与管家基因GAPDH的比值来确定相对基因表达水平。
1.2.4NF-κB活性测定 通过使用Nuclear Extract Kit(Active Motif)提取核蛋白,并通过使用Bio-Rad蛋白质测定法(Bio-Rad Life Science Research)测定蛋白质浓度。NF-κBp65活性测定采用Active Motif提供的TransAM NF-κBp65 ELISA试剂盒进行,在该试剂盒中,通过将5 μg核蛋白加至反应孔中,最后通过测定其吸光度,间接测定p65与其DNA结合的含量。
1.2.5Western blot检测IκB表达 按照参考文献提供的方法提取细胞总蛋白[7]。首先采用SDS-PAGE分离并将其转移到PVDF膜上。将膜与5%脱脂奶粉室温封闭2 h,随后依次与一抗(抗IκB或β-actin)和二抗在室温下孵育1 h。使用ECL发光和Kodak X-OMAT LS胶片显影。
1.2.6ELISA检测TNF-α、IL-8及SPLUNC1分泌 处理结束后获取细胞上清用于ELISA测定TNF-α和IL-8。检测方法按照参考文献提供的步骤进行[8]。检测灵敏度为7 pg/ml。使用直接ELISA测定人SPLUNC1蛋白。即首先将重组人SPLUNC1蛋白标准品用PBS稀释为不同浓度并包被在96孔板上(PA),随后依次加入小鼠抗SPLUNC1抗体(1 μg/ml)、生物素化的抗小鼠抗体和抗生物素蛋白-生物素过氧化物酶共孵育。最后用TMB显色,酶标仪获取其吸光度,以建立标准曲线。测定培养上清中SPLUNC1浓度方法同上,最后用CurveExpert软件计算出培养上清中SPLUNC1浓度(ng/ml)。
1.2.7RNA干扰实验使用siRNA沉默基因沉默SPLUNC1。即将NCI-H292细胞以1.5×105个/孔的密度接种到6孔板中。12 h后(约60%~70%密度)根据DharmaFECT Transfection Reagents(Thermo Scientific)提供的步骤,分别将阴性对照siRNA或SPLUNC1 siRNA(75 pmol)转染细胞中。24 h后,将培养基更换为完全培养基继续培养48 h。收集转染的细胞,采用Western blot对其干扰效率进行分析并用于下一步处理。本文所用的SPLUNC1 siRNA序列为5′-GCCTGAACAACATCATTGATT-3′,对照siRNA(Scrambled siRNA)5′-UUCUCCGAACGTGUCACGUUU-3′。所用siRNA由上海吉玛制药技术有限公司合成。
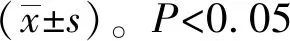
2 结果
2.1肺炎克雷伯菌夹膜多糖诱导NCI-H292细胞表达SPLUNC1 mRNA和蛋白 实时定量PCR结果显示,阴性对照组SPLUNC1 mRNA表达水平很低。加入0.1 μg/ml、1 μg/ml和3 μg/ml CPS后,SPLUNC1 mRNA随之增高(图1A)。此外,SPLUNC1的蛋白水平也与mRNA趋势类似(图1B)。
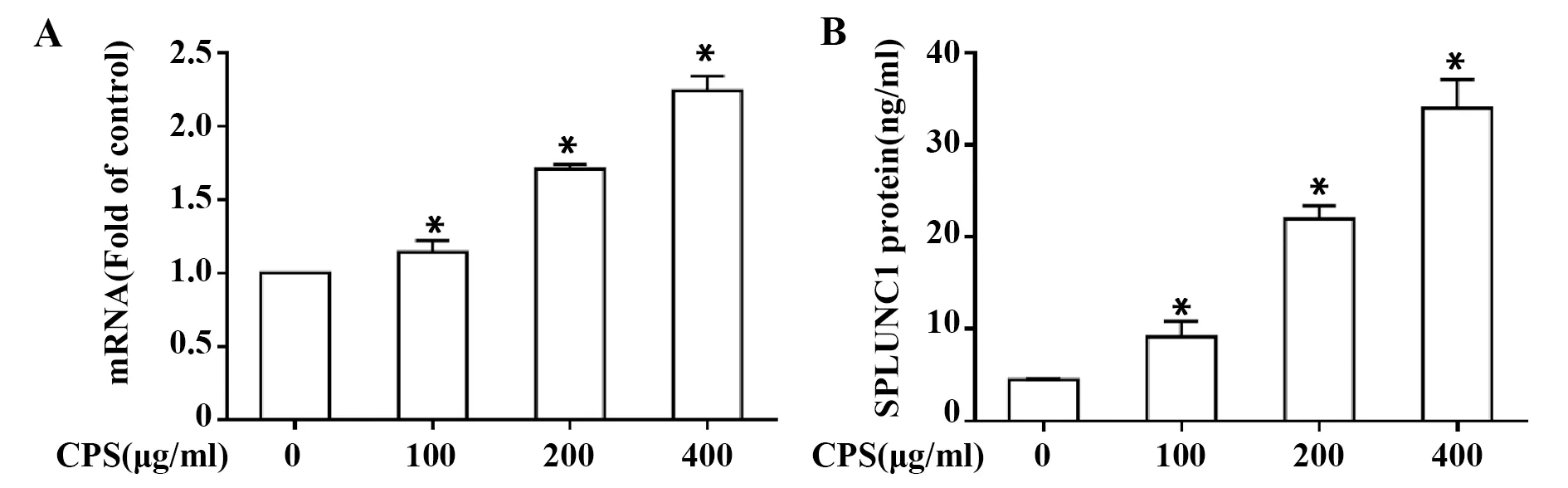
图1 不同浓度CPS对SPLUNC1 mRNA和蛋白表达的影响Fig.1 Different concentration of CPS on SPLUNC1 mRNA and protein expressionNote:Compared with control group,*.P<0.05.
2.2夹膜多糖激活NCI-H292细胞NF-κB NF-κB活性实验结果显示,0.1 μg/ml、1 μg/ml和3 μg/ml处理可明显增强细胞核内NF-κB的活性(图2A)。此外,Western blot结果也显示,CPS孵育后,可明显促进IκB的降解(图2B)。
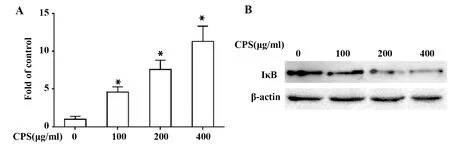
图2 不同浓度荚膜多糖激活NF-κBFig.2 Activation of NF-κB by different concentration of CPSNote:A.Activation of NF-κB by CPS, *.P<0.05, as compared with the control group (0 μg/ml);B.CPS induced degradation of IκB.
2.3夹膜多糖经NF-κB诱导NCI-H292细胞分泌TNF-α和IL-8 ELISA结果显示,NCI-H292细胞经不同浓度CPS孵育24 h后,与阴性对照组相比,TNF-α和IL-8分泌水平明显增高。而同时加入20 μmol/L NF-κB抑制剂PDTC预处理后,TNF-α和IL-8的含量进一步降低(图3)。
图3 夹膜多糖诱导NCI-H292细胞分泌TNF-α和IL-8Fig.3 CPS induces NCI-H 292 cells secretion of TNF-α and IL-8Note:*.P<0.05, as compared between the groups.
2.4沉默SPLUNC1增强夹膜多糖诱导TNF-α和IL-8分泌 为了进一步明确SPLUNC1在CPS诱导TNF-α和IL-8分泌中的作用,随后采用siRNA沉默SPLUNC1后,再加入CPS孵育,结果显示与未沉默的对照组相比,干扰SPLUNC1后TNF-α和IL-8分泌有所增多(图4)。
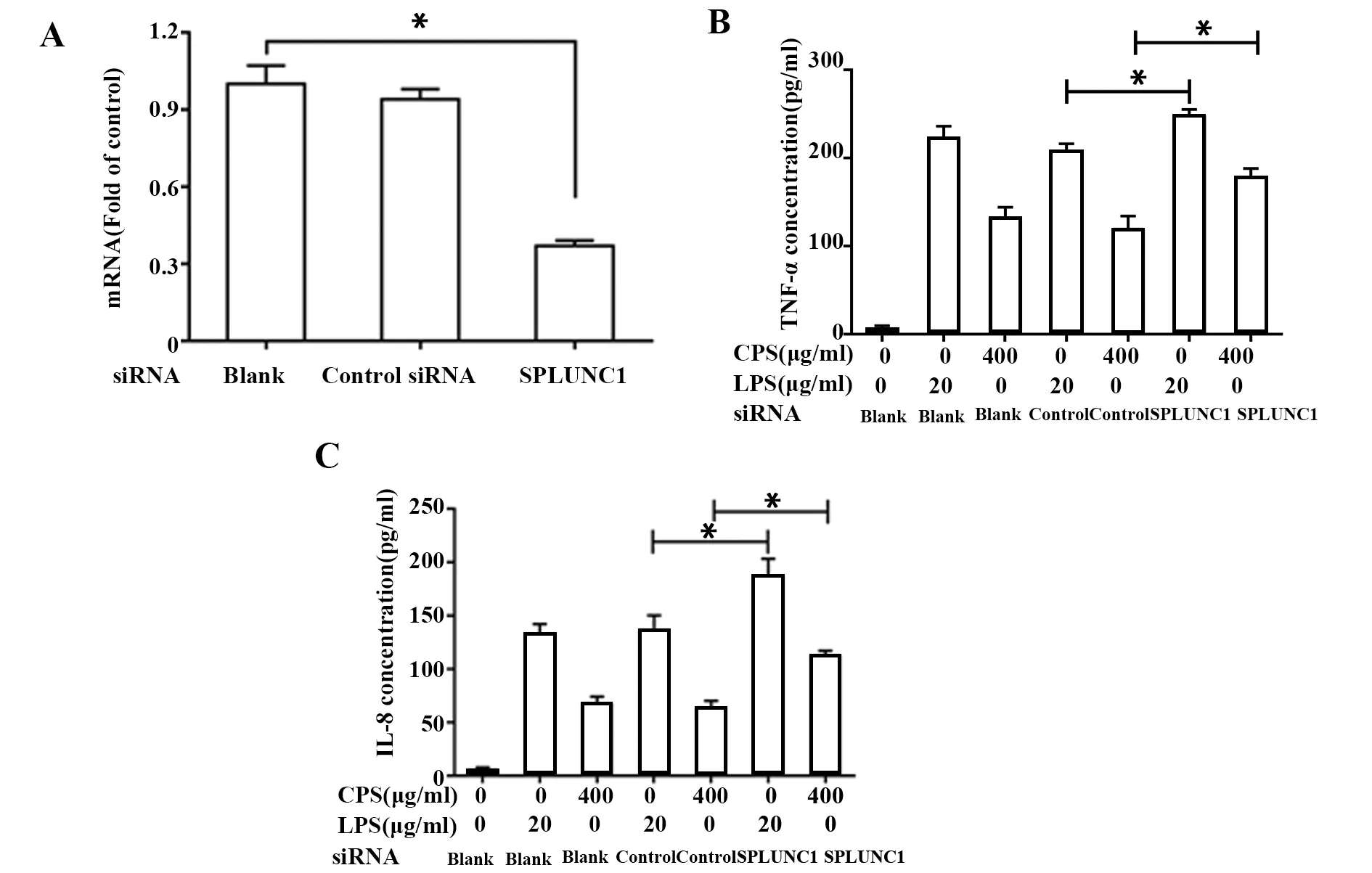
图4 沉默SPLUNC1对TNF-α和IL-8的影响Fig.4 Effect of TNF-α and IL-8 secretion after silence of SPLUNC1Note:A.Silence of SPLUNC1 by siRNA;B and C.Effect of SPLUNC1 siRNA on TNF-α and IL-8 production.*.P<0.05, as compared with the control siRNA.
3 讨论
SPLUNC是近年来从软腭、肺、悬雍垂和鼻腔上皮细胞中鉴定出的一种蛋白家族分子,目前发现的 10种PLUNC,其中SPLUNC1主要表达于人和小鼠的大气道上皮。研究表明,SPLUNC1是机体固有免疫系统的重要组成部分,对多种病原微生物如肺炎支原体、铜绿假单胞菌的入侵具有抵抗作用[9,10]。近年也有研究发现SPLUNC1也能抑制肺炎克雷伯菌生长[10],但肺炎克雷伯菌感染后,都能反馈性上调SPLUNC1表达目前仍不明确。对于肺炎克雷伯菌而言,其CPS是重要的致病物质。为了探讨其是否能诱导SPLUNC1表达,本研究首先检测了CPS处理后SPLUNC1 mRNA和蛋白的表达水平,结果发现,CPS处理可明显上调SPLUNC1 mRNA和蛋白的表达。为了明确SPLUNC1对炎症反应的作用,我们观察了CPS对细胞因子分泌的影响。结果发现,CPS处理后,随着剂量的上升,TNF-α和IL-8水平逐渐增高,这表明CPS对细胞因子分泌具有促进作用。对于病原微生物感染来说,其所诱发的炎症反应往往与激活其胞内核转录因子NF-κB有关[11]。为了观察CPS是否能影响NF-κB的活性,本研究检测了细胞核内NF-κB p65亚基的含量,后者是NF-κB激活的标志。结果发现,与未经CPS处理组相比,CPS处理后细胞核内NF-κB的活性明显增高。由于NF-κB在未激活状态下,p65和IκB结合于细胞浆中,当细胞被外源性刺激激活时,IκB降解,随后释放p65至细胞核中发挥作用。本研究同时也发现,采用CPS刺激后,IκB水平明显降低。这表明CPS能上调NF-κB的活性,最终诱导细胞因子分泌。有研究表明,SPLUNC1对多种病原微生物所致的炎症反应具有抑制作用[12]。既然CPS能通过激活NF-κB诱导细胞因子分泌,同时也能反馈性上调SPLUNC1表达,那么,SPLUNC1是否参与了CPS所致的炎症反应呢?为了进一步明确SPLUNC1在CPS影响TNF-α和IL-8分泌中的作用,本研究采用siRNA干扰SPLUNC1表达后,再用CPS孵育,结果显示与对照siRNA组相比,沉默SPLUNC1后,CPS对TNF-α和IL-8分泌作用有所增多,跟LPS类似。这表明SPLUNC1能在一定程度上负向调控包括夹膜多糖和LPS在内的病原相关分子模式诱导细胞因子的分泌。
综上所述,尽管肺炎克雷伯菌经宿主固有免疫系统或呼吸道上皮细胞识别后,可诱发固有免疫应答从而参与其清除。但细胞因子的过度分泌本身也会带来不利影响。机体在进化过程中已经形成了一种精密的负向调控机制及时调控炎症反应的强度,从而维持机体的免疫平衡。本研究表明SPLUNC1可能是在肺炎克雷伯菌感染后维持机体稳态的重要分子,但其究竟是通过何种机制影响细胞因子分泌仍不清楚。有研究显示,SPLUNC1能和TLR2受体结合而抑制IL-8的分泌[9],此外,SPLUNC1也能影响某些钠离子通道蛋白的活性,促进病原体清除[13]。总之,目前对SPLUNC1的研究还远远不够,SPLUNC1针对不同病原体是否存在不同机制,仍有待深入研究。
