内质网通道蛋白Sec61在PM2.5诱导支气管上皮细胞BEAS-2B高表达MUC5AC中的作用①
2019-12-27林秀山周向东王才春
林秀山 周向东 王才春
(海南医学院第一附属医院呼吸内科,海口 570102)
PM2.5是指空气动力学直径小于或等于2.5 μm的细颗粒物质,易被人体吸入到达远端支气管和肺泡,并且长期沉积在呼吸道中,是一系列呼吸系统疾病的危险因素,包括慢性支气管炎、哮喘、肺癌等[1,2]。气道上皮细胞在受到PM2.5刺激时常呈黏液高分泌状态,具有量大、黏稠等特点,纤毛无法有效的清除,而过量的黏液积聚又会加重局部呼吸道的炎症和感染,最终导致呼吸道慢性疾病的迁延不愈[3]。黏蛋白5AC(Mucin 5AC,MUC5AC)是气道黏液的主要蛋白成分,在呼吸道中发挥润滑和保湿作用,但是在PM2.5刺激下,MUC5AC大量分泌,且呈高度的硫酸化和糖基化,是黏液高分泌状态的主要原因[4],因此探讨PM2.5诱导支气管上皮细胞MUC5AC高表达的调节机制,并开展针对性的干预具有重要的临床意义。
Sec61是一种异源性三聚体,为内质网通道蛋白,参与调节核糖体生成的多肽链向内质网腔的转运[5,6]。研究发现,Sec61与内质网应激密切相关,如王军等[7]发现使用抑制剂阻断Sec61可以降低内质网应激标志物GRP78的表达,缓解肝细胞脂肪变性的程度。此外,Sec61可以促进钙离子从内质网向细胞质中释放,在钙离子紊乱中发挥重要的病理作用[8]。而内质网应激和钙离子紊乱也是PM2.5诱导气道黏液高分泌的病理机制[9],因此我们推测Sec61可能参与PM2.5诱导支气管上皮细胞MUC5AC高表达,本文首先使用PM2.5对支气管上皮细胞BEAS-2B进行刺激,以探讨Sec61在不同浓度和不同时间刺激下的变化规律,然后使用RNA干扰技术沉默Sec61表达,以研究Sec61沉默对细胞中MUC5AC表达的影响及相关机制。
1 材料与方法
1.1材料 siRNA-Sec61和siRNA-Control序列由吉凯基因公司设计和合成;siRNA-Sec61正义链:5′-GAGAGAAAGAUUCAGUUUAdTdT-3′,反义链:5′-UAAACUGAAUCUUUCUCUCdTdT-3′;siRNA-Control正义链:5′-GAUAAUAAAUCUAAGGGGUdTdT-3′,反义链:5′-ACCCCUUAGAUUUAUUAUCdTdT-3′;悬浮微粒采样器(TH-150)购自武汉市天虹仪表有限责任公司;支气管上皮细胞BEAS-2B购自美国ATCC公司,胎牛血清、DMEM培养基购自Gibco公司;LipofectamineTM2000、Fluo-4/AM荧光染料购自Invitrogen公司;PMSF、RIPA裂解液购自上海碧云天;一抗购自Santa Cruz公司;二抗购自Proteintech公司;逆转录试剂盒和荧光定量PCR试剂盒购自TaKaRa公司;引物合成自上海生工。
1.2方法
1.2.1PM2.5的采集与处理 于海口市的主要交通路口处,在空气质量指数大于5级、PM2.5严重超标的雾霾天气时分次采集PM2.5颗粒,采集时间为2018年3~5月,共采集8次,每次时间为8:00~18:00。采用悬浮微粒采样器收集PM2.5,结束后将纤维滤膜放入干燥器中暂时保存。将纤维滤膜浸入去离子水,超声振荡30 min,洗脱液10 000 r/min离心30 min,将沉淀物真空冻干后称重,于-20℃冰箱中保存。使用PBS将PM2.5配置成0、25、50、100、200 μg/ml[10,11]。
1.2.2细胞培养与处理 使用含10%胎牛血清的DMEM培养基培养BEAS-2B细胞,置于37℃、5%CO2的培养箱中。当细胞融合度达到70%时,更换为无血清培养基继续培养6 h,然后依次加入0、25、50、100、200 μg/ml的PM2.5刺激48 h,收集细胞,使用蛋白质免疫印迹(Western blot)检测细胞中Sec61的表达。使用100 μg/ml的PM2.5分别刺激细胞0、6、12、24、48 h,收集细胞,Western blot检测细胞中Sec61的表达。使用100 μg/ml的PM2.5刺激48 h,细胞免疫荧光染色检测Sec61的表达。
1.2.3细胞转染与实验分组 当细胞汇合度达到70%时,根据LipofectamineTM2000说明书分别将siRNA-Control和siRNA-Sec61干扰序列(工作浓度为50 nmol/L)转染至BEAS-2B细胞。将实验分为4组,即对照组、PM2.5组、siRNA-Control组、siRNA-Sec61组。对照组使用未进行转染的BEAS-2B细胞,加入PBS作为对照;PM2.5组使用未进行转染的BEAS-2B细胞,加入100 μg/ml的PM2.5刺激48 h;siRNA-Control组和siRNA-Sec61组分别使用转染siRNA-Control或siRNA-Sec61序列的细胞,加入100 μg/ml的PM2.5刺激48 h。收集细胞,使用荧光定量聚合酶链式反应和Western blot检测细胞中Sec61、MUC5AC、GRP78的表达,使用免疫荧光染色检测细胞中MUC5AC和游离钙离子的表达。
1.2.4蛋白质免疫印迹 使用含有PMSF的RIPA裂解液对细胞进行充分裂解,12 000 r/min离心5 min,收集上清液进行蛋白定量。取40 μg的总蛋白进行聚丙烯酰胺凝胶电泳,电转膜后加入5%的牛血清白蛋白室温封闭2 h,加入抗Sec61抗体(1∶500)、抗MUC5AC抗体(1∶1 000)、抗GRP78抗体(1∶500)和抗GAPDH抗体(1∶3 000)4℃过夜孵育。洗涤后,加入含辣根过氧化物酶的山羊抗兔抗体室温孵育1 h,经洗涤、显色后,使用凝胶成像仪拍照。使用Image Pro Plus 6.0软件测定各条带的灰度值,将对照组中目的蛋白与GAPDH蛋白的灰度值之比作为100。
1.2.5荧光定量聚合酶链式反应(qRT-PCR) Trizol法提取细胞中的总RNA,根据逆转录试剂盒说明书逆转录为cDNA,然后使用荧光定量PCR试剂盒扩增目的基因,反应条件:95℃预变性5 min;95℃变性30 s,55℃退火30 s,72℃延伸60 s,共进行40个循环,各基因的引物序列见表1。取扩增产物进行琼脂糖凝胶电泳,使用凝胶成像仪拍照,Image Pro Plus 6.0软件测定各条带的灰度值,将对照组中目的基因与GAPDH基因的灰度值之比作为100。
1.2.6细胞免疫荧光染色 4%的多聚甲醛固定细胞30 min,5%的牛血清白蛋白封闭1 h,加入抗Sec61抗体(1∶100)和抗MUC5AC抗体(1∶100)4℃过夜。次日,PBS洗涤后加入含有FITC荧光标签的山羊抗兔二抗37℃孵育30 min,PBS洗涤后DAPI染色10 min,洗涤后荧光显微镜下拍照。
1.2.7胞内游离钙离子的检测 PBS洗涤细胞2次后,加入Fluo-4/AM荧光染料(5 μmol/L)于37℃避光孵育60 min,PBS洗涤,于37℃继续孵育20 min,以保证Fluo-4/AM在细胞内充分转化为Fluo-4,然后使用激光共聚焦显微镜观察和拍照,激发波长为488 nm,发射波长为516 nm[12]。
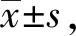
2 结果
2.1PM2.5刺激对Sec61表达的影响 随着PM2.5刺激浓度的增加和刺激时间的延长,Sec61蛋白质的表达量逐渐升高,刺激浓度为100 μg/ml、刺激时间为48 h时,Sec61的表达量最高,见图1。使用100 μg/ml的PM2.5刺激48 h,细胞中Sec61的免疫荧光强度明显高于对照组,见图2。
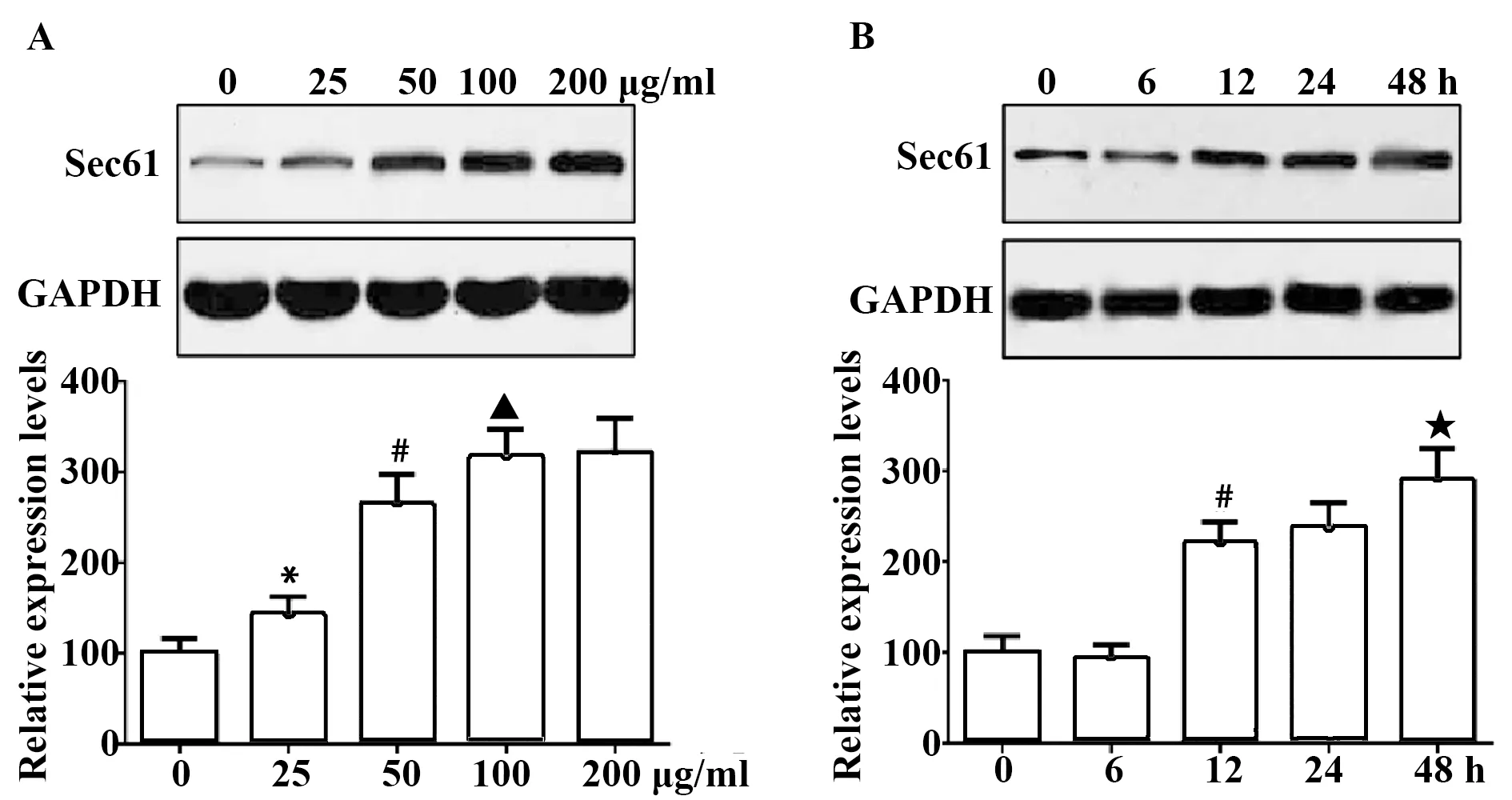
图1 Western blot检测PM2.5刺激对Sec61表达的影响Fig.1 Influence of PM2.5 stimulation on Sec61 express-ion was examined by Western blotNote:A.Influence of different stimulation concentrations on Sec61 expression;B.Influence of different stimulation time on Sec61 expression.Compared with 0 μg/ml group,*.P<0.05;compared with 25 μg/ml,#.P<0.05;compared with 100 μg/ml,▲.P<0.05;compared with 200 μg/ml,★.P<0.05.
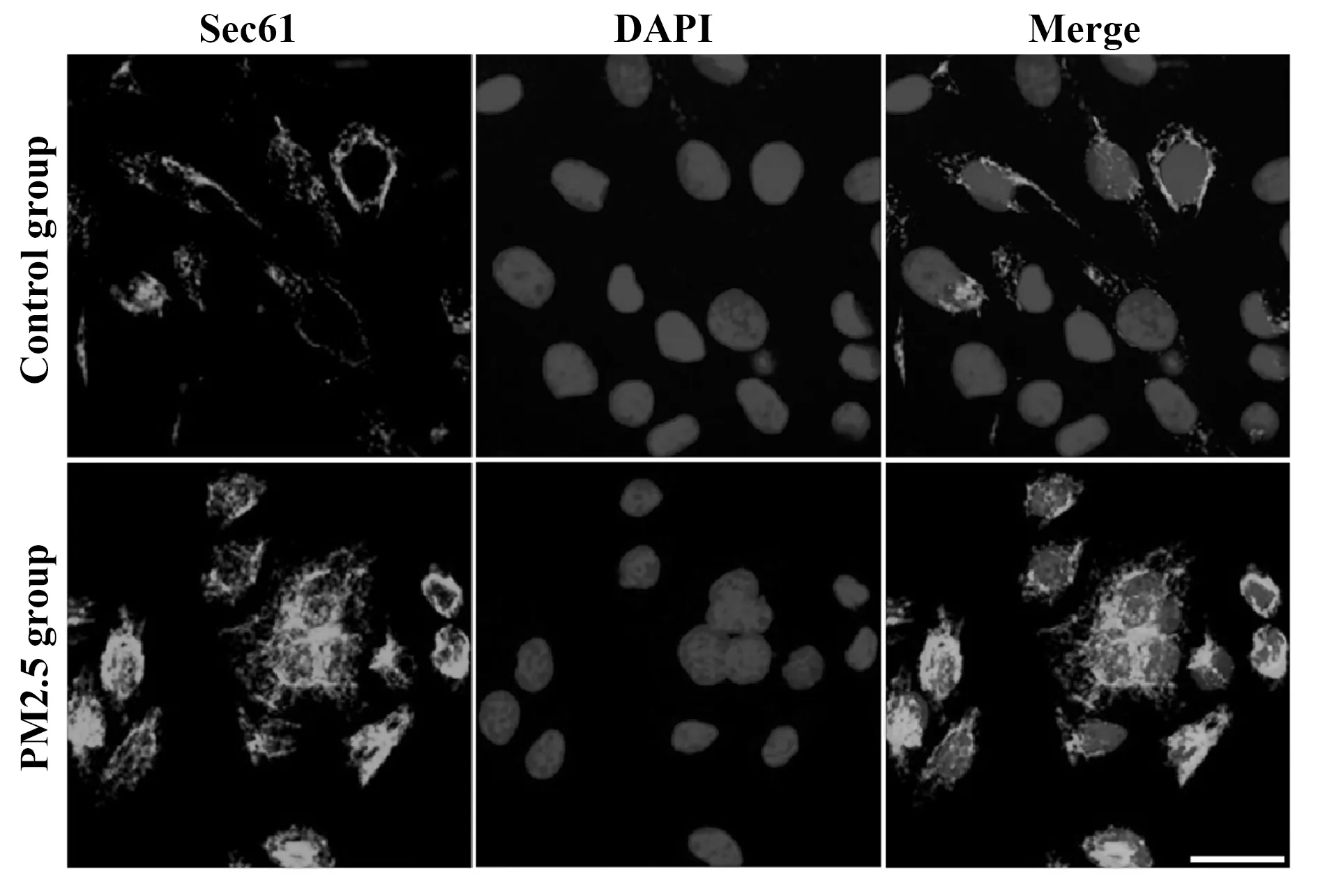
图2 细胞免疫荧光染色检测PM2.5刺激(100 μg/ml,48 h)对Sec61表达的影响Fig.2 Influence of PM2.5 stimulation (100 μg/ml,48 h) on Sec61 expression was examined by immunofluorescence stainingNote:Scale bar.25 μm.
2.2Sec61沉默对Sec61表达的抑制效果 与对照组比较,PM2.5组细胞中Sec61 mRNA和蛋白质的表达量升高,差异具有统计学意义(P<0.05);与PM2.5组比较,siRNA-Control组细胞中Sec61 mRNA和蛋白质的表达量差异无显著统计学意义(P>0.05);与siRNA-Control组比较,siRNA-Sec61组细胞中Sec61 mRNA和蛋白质的表达量降低,差异具有统计学意义(P<0.05),见图3。
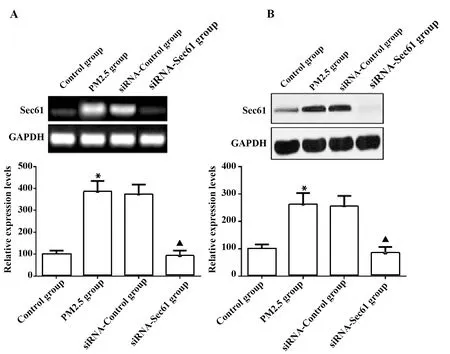
图3 Sec61沉默对Sec61表达的抑制效果Fig.3 Inhibitory effect of Sec61 silencing on Sec61expressionNote:A.qRT-PCR was used to detect the mRNA expression of Sec61;B.Western blot was used to detect the protein expression of Sec61.Compared with contrd group,*.P<0.05;compared with siRNA-control group;▲.P<0.05.
表1 引物序列
Tab.1 Primer sequence
GenePrimer sequenceSec61Forward primer5′-TGTCATCTCCCAAATGCTCTCA-3′Reverse primer5′-ACAGGTAATAGCAAAGGCCAC-3′MUC5ACForward primer5′-CAGCACAACCCCTGTTTCAAA-3′Reverse primer5′-GCGCACAGAGGATGACAGT-3′GRP78Forward primer5′-CGTCCTATGTCGCCTTCACT-3′Reverse primer5′-AATGTCTTTGTTTGCCCACC-3′GAPDHForward primer5′-GATTGTTGCCATCAACGACC-3′Reverse primer5′-GTGCAGGATGCATTGCTGAC-3′
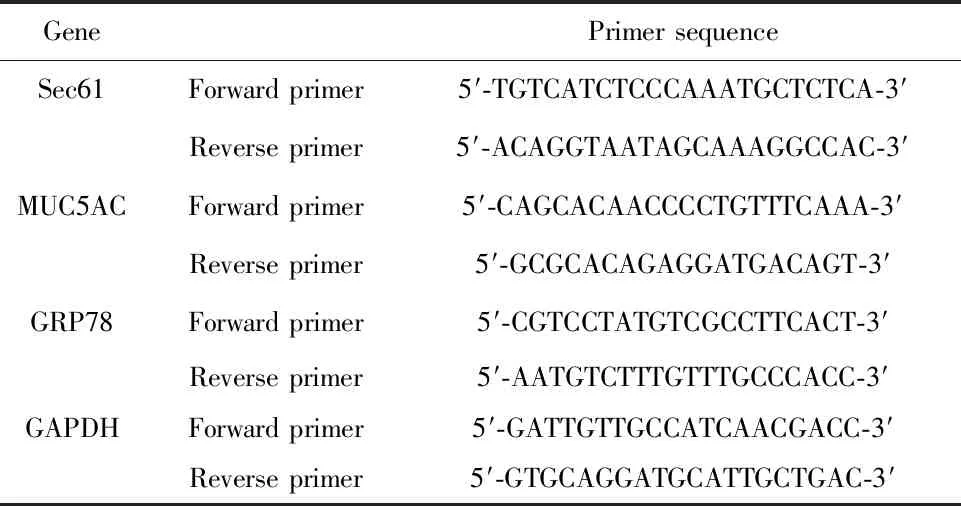
2.3Sec61沉默对MUC5AC表达的影响 与对照组相比较,PM2.5组细胞中MUC5AC mRNA和蛋白质的表达量升高,差异具有统计学意义(P<0.05);与PM2.5组相比较,siRNA-Control组细胞中MUC5AC mRNA和蛋白质的表达量差异无显著统计学意义(P>0.05);与siRNA-Control组相比较,siRNA-Sec61组细胞中MUC5AC mRNA和蛋白质的表达量降低,差异具有统计学意义(P<0.05),见图4。
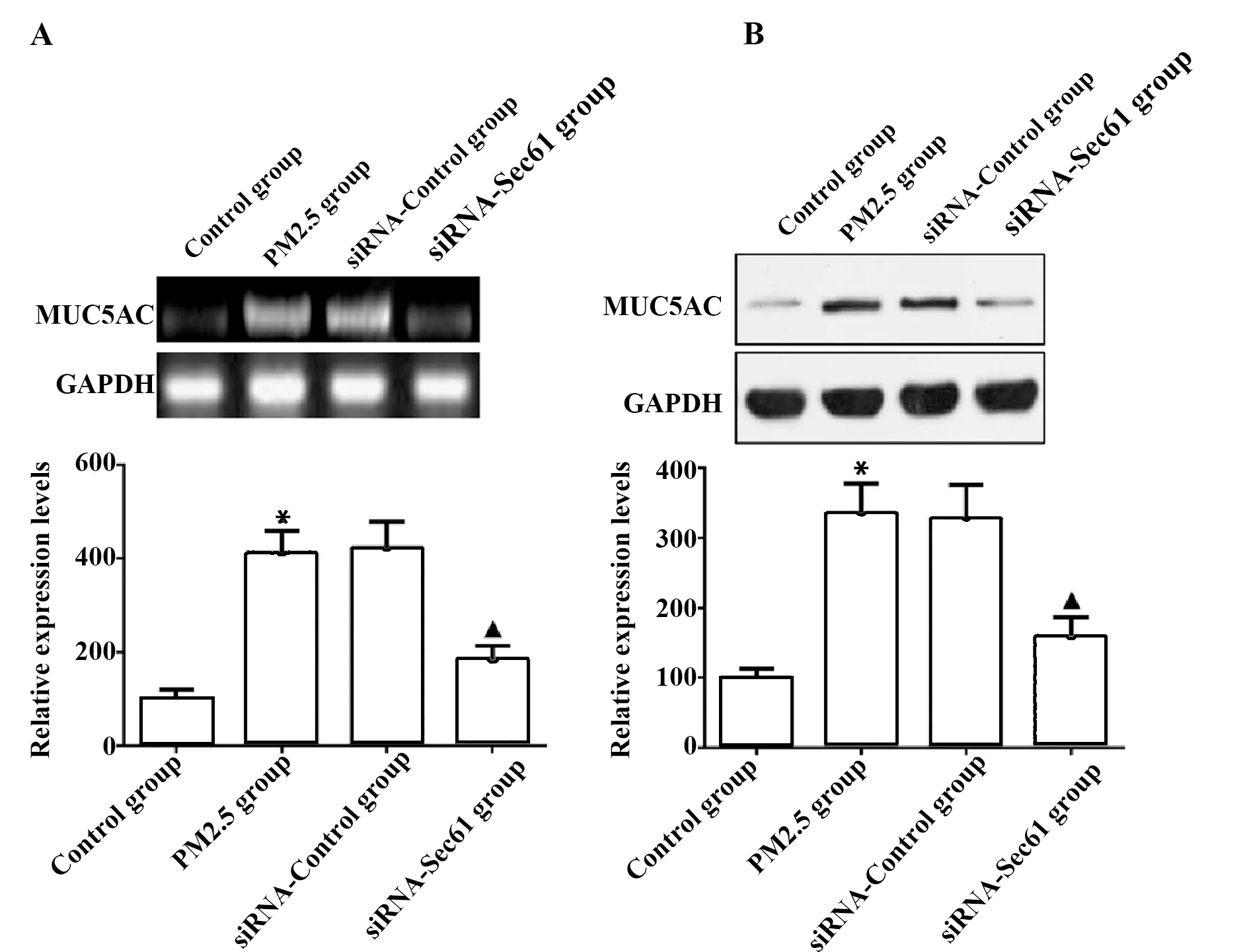
图4 检测Sec61沉默对MUC5AC表达的影响Fig.4 Influence of Sec61 silencing on MUC5AC express-ion was examinedNote:A.qRT-PCR was used to detect the mRNA expression of MUC5AC;B.Western blot was used to detect the protein expression of MUC5AC.Compared with control group,*.P<0.05;compared with PM2.5 group,#.P<0.05;compared with siRNA-control group,▲.P<0.05.
与对照组相比较,PM2.5组细胞中MUC5AC的荧光强度明显升高;与PM2.5组相比较,siRNA-Control组细胞中MUC5AC的荧光强度无明显差异;与siRNA-Control组相比较,siRNA-Sec61组细胞中MUC5AC的荧光强度明显降低,见图5。
图5 细胞免疫荧光染色检测Sec61沉默对MUC5AC表达的影响Fig.5 Influence of Sec61 silencing on MUC5AC express-ion was examined by immunofluore-scence stainingNote:Scale bar.50 μm.
2.4Sec61沉默对GRP78表达的影响 与对照组相比较,PM2.5组细胞中GRP78 mRNA和蛋白质的表达量升高,差异具有统计学意义(P<0.05);与PM2.5组相比较,siRNA-Control组细胞中GRP78 mRNA和蛋白质的表达量差异无显著统计学意义(P>0.05);与siRNA-Control组相比较,siRNA-Sec61组细胞中GRP78 mRNA和蛋白质的表达量降低,差异具有统计学意义(P<0.05),见图6。
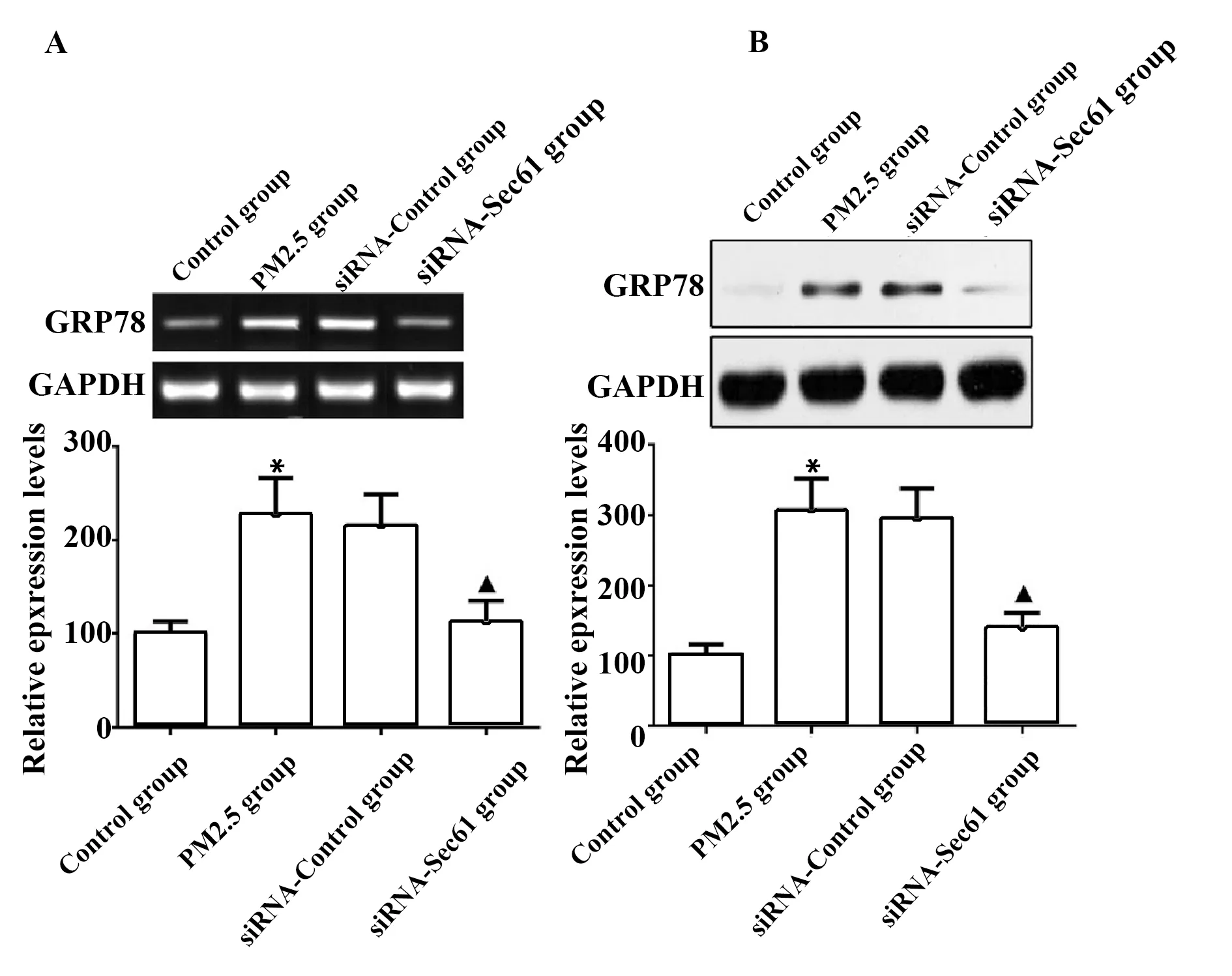
图6 Sec61沉默对GRP78表达的影响Fig.6 Influence of Sec61 silencing on GRP78 expressionNote:A.qRT-PCR was used to detect the mRNA expression of GRP78;B.Western blot was used to detect the protein expression of GRP78.Compared with control group,*.P<0.05;compared with PM2.5 group,#.P<0.05;compared with siRNA-control group,▲.P<0.05.
2.5Sec61沉默对细胞内游离钙离子的影响 与对照组比较,PM2.5组细胞中游离钙离子的荧光强度明显升高;与PM2.5组相比较,siRNA-Control组细胞中游离钙离子的荧光强度无明显差异;与siRNA-Control组相比较,siRNA-Sec61组细胞中游离钙离子的荧光强度明显降低,见图7。
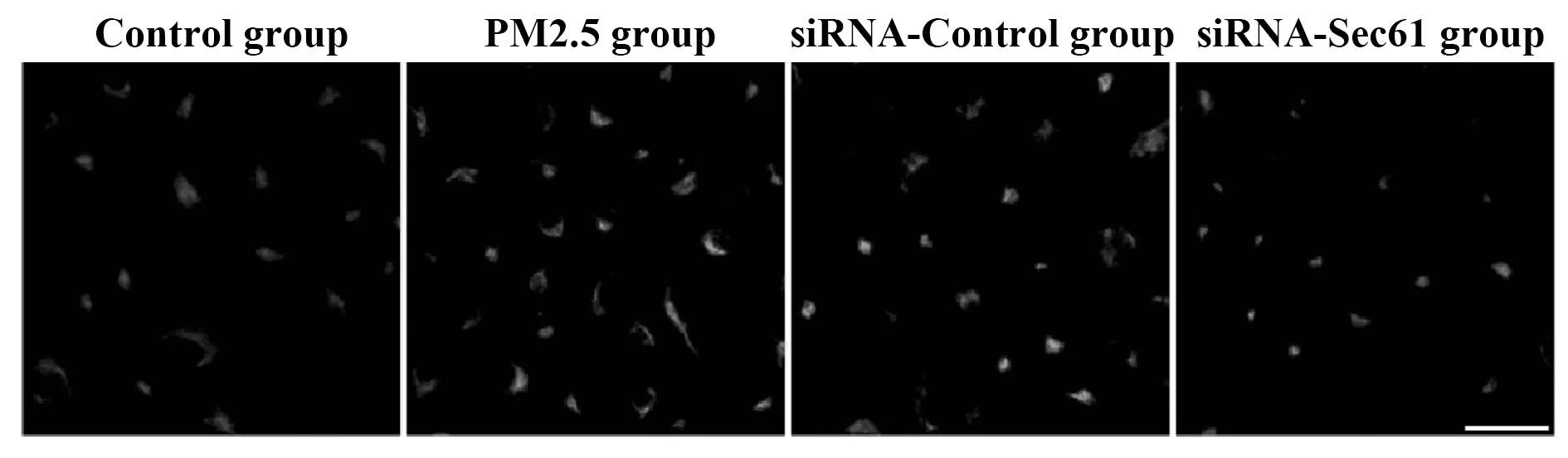
图7 Sec61沉默对细胞内游离钙离子的影响Fig.7 Influence of Sec61 silencing on concentration of intracellular calcium ionsNote:Scale bar.25 μm.
3 讨论
PM2.5是空气动力学直径小于或等于2.5 mm的大气颗粒物,是空气污染的重要组成部分,主要包含重金属颗粒、酸性氧化物、有机污染物、细菌、真菌、病毒等,吸入后可以沉积在远端气道和肺泡中,引起异常的免疫炎症反应[13]。流行病学研究表明,空气中PM2.5浓度每上升10 mg/m3,呼吸系统疾病的死亡率可增加2%,慢性阻塞性肺疾病患者的住院率可增加1.72%~6.87%[14],因此研究PM2.5对呼吸系统的损伤机制以及开展针对性的治疗具有重要意义。
支气管上皮细胞分泌黏液有助于清除进入肺部的病原体或颗粒物质,在呼吸道的防御机制中发挥重要作用,但是在PM2.5的长期刺激下,过多的黏液分泌会产生黏液栓,导致呼吸功能受损,甚至死亡。MUC5AC是呼吸道黏液的主要组成成分,可在病毒、细菌、烟雾等外界刺激物直接诱导产生,也可以在IL-4、IL-13、TNF-α等炎症因子的间接作用下上调表达,因此在支气管哮喘、呼吸道感染、慢性阻塞性肺疾病等呼吸系统疾病中大量表达和分泌[15-17]。同样,PM2.5也可以诱导支气管上皮细胞大量分泌MUC5AC,而且MUC5AC被糖基化和硫酸化修饰,使气道黏液呈酸性和黏稠状[3]。MUC5AC的初始肽链在细胞的核糖体中合成后,可转运至内质网中进行三维结构的折叠与加工,糖基化和硫酸化修饰也在此完成。综上,本文认为MUC5AC从核糖体向内质网的转运过程在PM2.5诱导气道上皮细胞黏液高分泌状态中发挥关键作用,若阻断该转运过程中的关键分子可能在PM2.5相关损伤中发挥保护效应。
Sec61是位于内质网膜上的双向通道蛋白,参与调节多肽链向内质网的转运以及钙离子向胞质的释放[5]。为了研究Sec61是否参与PM2.5诱导MUC5AC高表达,本文使用PM2.5刺激支气管上皮BEAS-2B细胞,结果发现随着PM2.5刺激浓度的增加和刺激时间的延长,Sec61蛋白质的表达量逐渐升高,表明PM2.5可以诱导Sec61高表达,且呈浓度依赖性和时间依赖性。当刺激浓度为100 μg/ml、刺激时间为48 h时,Sec61的表达量最高,细胞中Sec61的免疫荧光强度也明显高于对照组,因此本文在后续实验中均使用该刺激条件进行研究。
本文设计和构建了Sec61的小分子RNA干扰序列,转染后发现与siRNA-Control组比较,siRNA-Sec61组细胞中Sec61 mRNA和蛋白质的表达量降低,表明Sec61的小分子RNA干扰序列构建成功。为了研究Sec61的沉默是否影响MUC5AC的表达,本文分别使用RT-PCR、Western blot以及免疫荧光染色对MUC5AC的表达进行检测,结果显示与siRNA-Control组相比较,siRNA-Sec61组细胞中MUC5AC mRNA和蛋白质的表达量降低,免疫荧光强度也明显降低,表明Sec61沉默可以抑制PM2.5诱导的MUC5AC高表达,这种现象的出现可能因为Sec61通道蛋白数量的降低,使MUC5AC新生肽链无法有效进入内质网腔,从而积聚在细胞质中,负反馈调节使MUC5AC mRNA转录和蛋白质翻译水平降低。
内质网应激和钙离子失衡在PM2.5诱导气道上皮细胞损伤中发挥重要的病理作用,而且Sec61与内质网应激、钙离子稳态密切相关,如Schauble等[18]发现绿脓杆菌外毒素A可以抑制钙离子从内质网腔向胞质中释放钙离子,主要机制是其与Sec61α亚基的氨基端结合,介导Sec61通道蛋白的关闭;王军等[7]也在脂肪变性的肝细胞中发现,下调Sec61蛋白的表达可以抑制内质网应激。为了进一步研究Sec61沉默抑制MUC5AC高表达的机制,本文对细胞的内质网应激水平和胞内游离钙离子浓度进行检测,结果显示与siRNA-Control组相比较,siRNA-Sec61组细胞中内质网应激标志物GRP78 mRNA和蛋白质的表达量降低,细胞中游离钙离子的荧光强度明显降低,表明Sec61沉默可以降低PM2.5诱导的内质网应激,抑制钙离子从内质网腔向胞质的释放。
本文的不足和展望:①本文仅使用了体外细胞学实验进行研究,但是细胞学实验具有稳定性差、无法模拟体内环境等缺点,相关结论仍需要构建相关的动物模型进行验证;②本文使用小分子RNA干扰的方法抑制Sec61的表达,但是该方法发挥抑制效应的时间较短,一般在7 d左右,因此未来需要进一步开发稳定、高效、安全的抑制药物应用于临床。
综上所述,PM2.5可以诱导Sec61高表达,呈浓度依赖性和时间依赖性。使用小分子RNA沉默Sec61表达可以显著抑制MUC5AC高表达,可能与调节内质网应激和钙离子稳态有关。
