实时荧光定量PCR检测工程酵母制备重组单克隆抗体原液中的宿主DNA残余
2019-12-25鲁仕豪石萍萍王甜甜吴军刘波
鲁仕豪,石萍萍,2,王甜甜,吴军,刘波
1.军事医学研究院生物工程研究所,北京100071;2.安徽大学物质科学与信息技术研究院,安徽合肥230000
近年来,生物技术药物发展迅速,以单克隆抗体为首的重组生物制品在许多重大疾病的预防、诊断和治疗中得到广泛应用,是当今新药研发的重点。目前已经上市的单克隆抗体药物都是使用哺乳动物细胞表达制备,如最常见的中国仓鼠卵巢细胞(CHO)、鼠杂交瘤细胞(NSO)等。但动物细胞生长缓慢,构建稳定的工程细胞株所需时间长,且生产工艺放大和规模生产均存在一些瓶颈问题,难以满足应对突发生物危害时,对防生抗体的快速、大量的需求。巴斯德毕赤酵母作为最简单的真核生物,具有繁殖速度快、培养成本低、遗传操作性强,并且作为真核生物具有一定的折叠加工和翻译后修饰能力等特点,已经被广泛用于各类生物制品的表达和生产[1]。野生型毕赤酵母对重组蛋白的糖基化修饰与哺乳动物细胞复杂型糖链不同,是形成高甘露糖型蛋白。这类蛋白由于末端的甘露糖在体内容易被清除,导致半衰期缩短。并且高甘露糖型对生物学活性、抗体效应作用、药代动力学和免疫原性都存在一定的影响,从而限制了毕赤酵母表达系统制备重组糖蛋白的应用。
本研究团队构建的新型工程化毕赤酵母通过对N-糖基化修饰途径的定向改造,顺利阻断了高甘露糖修饰,敲除和引入多种酶,使其具有类似于哺乳动物细胞复杂型糖基化修饰能力,为抗体等糖蛋白的制备提供了新的途径[2-6]。本研究团队使用糖基工程酵母系统表达制备重组单克隆抗体和疫苗项目正在进行中,目前已进入中试制备生产前阶段。由于是国内首次利用毕赤酵母系统制备重组单克隆抗体,有针对性的临床前质量控制研究资料极度缺乏。生物制品中残余的宿主细胞的DNA 由于存在潜在致癌风险,一直以来都是非常重要的质量控制内容之一。针对宿主细胞DNA 残余,2015 版《中华人民共和国药典》三部中有明确规定:哺乳动物细胞表达系统的产品中其含量不超过100 pg/剂量,酵母表达系统产品中其含量不得超过10 ng/剂量[7]。实时荧光定量PCR 自1993 年问世以来[8],凭借着其特异性强、灵敏度高、污染少、快速便捷,逐渐应用于抗体外源DNA 残余量的测定,能在一定程度上解决抗体外源DNA 残余量测定的难题[9],目前已经逐步成为新药报批质量控制中对宿主DNA 残余检测的主要技术之一,但药典尚未公布基于工程化酵母表达重组蛋白的DNA 残余的实时荧光定量PCR 检测方法。
5S rRNA 基因在毕赤酵母中具有多达20 多个拷贝,广泛分布于各染色体上,即使在基因组不完整的情况下也很容易被检测到,适合作为DNA 残余检测的标志物。本研究通过对实时荧光定量PCR 方法的优化,选择毕赤酵母中的5S rRNA 作为检测基因,完成了DNA 残余检测的方法学验证,实现了对工程化酵母表达单克隆抗体原液中DNA 残余量的高效、稳定、高灵敏度的快速定量检测,为工程化酵母表达系统生产重组生物制品的质量控制提供了新的参考方法。
1 材料与方法
1.1 材料
工程化酵母菌株制备的重组单克隆抗体(本研究室制备);全自动荧光定量PCR 系统CFX Connect Real-Time System(美国伯乐生命医学产品有限公司);TB Green Premix Dimer Eraser(Perfect Real Time)、PCR 管(北京宝日医生物技术有限公司);酵母基因组DNA 提取试剂盒(北京天根生物技术有限公司);5S rRNA 基因特异性引物1(5′-GGTTGCGGCCATATCTAG-3′)和P2(5′-AGATTGCAGCACCTGAGT-3)(上海生工生物有限公司)[10-11];NANODROP 2000 分光光度计(Thermo Fisher Scientific)。
1.2 工程菌株基因组DNA 的提取
用酵母基因组DNA 提取试剂盒提取得到工程化菌株基因组DNA,用NANODROP 2000 测定基因组DNA 浓度及D260nm/D280nm值。
1.3 实时荧光定量PCR
将提取的工程化菌株的基因组DNA 用样品缓冲液稀释至不同浓度(1000、100、10、1、1×10-1、1×10-2、1×10-3、1×10-4pg/μL)作为标准品,每个浓度设置3 个平行样品。反应体系包括TB Green Premix(2×)12.5 μL、引物(10 μmol/L)各0.75 μL、DNA 模板10 μL、无菌ddH2O 9.0 μL,共25.0 μL(dNTP、DNA 聚合酶、缓冲液等PCR 体系包含在商业化TB Green Premix 中)。按照商业化TB Green Premix 说明书推荐的三步法进行了部分优化后的反应条件为:95℃模板预变性30 s,95℃变性5 s、55℃退火30 s、72℃延伸30 s,循环70 次,65℃升至95℃时系统收集荧光信号,获得单峰熔解曲线。
1.4 待测样品处理方法
将工程化酵母表达的单克隆抗体原液用注射用生理盐水稀释至4.0 mg/mL,设置3 个平行样品。为了防止高蛋白浓度对PCR 结果的影响,在此基础上再增加一组1/10 稀释,即0.4 mg/mL,同样设置3 个平行样品。
1.5 精密度和回收率测定
将100、1、1×10-2pg/μL 的标准品和高低浓度组供试品设置8 个平行对照,计算标准品和待测样品的精密度。
设置标准品1、1×10-1、1×10-2pg/μL 浓度与待测样品混合进行加样回收实验,设置3 个平行重复。用待测样品稀释1000 pg/μL 浓度的标准品分别至1、1×10-1、1×10-2pg/μL,采用下式计算回收率:回收率(%)=(标准品和样品DNA 测定值-样品测定值)/DNA 标准品理论值×100%
1.6 重组单克隆抗体原液中残余DNA 含量测定
将测定的4.0 和0.4 mg/mL 单克隆抗体原液Ct 值(循环阈值)代入拟定的标准曲线,再根据回收率校正按下式计算DNA 残余含量:样品DNA 残余量(pg/mg)=(样品经标准曲线计算浓度值×1000)/待测样品蛋白浓度。
按照单抗人用注射剂量为20 mg/次,计算每人用剂量中宿主DNA 残余量。
2 结果
2.1 工程菌株基因组DNA 提取结果
用NANODROP 2000 测定提取的工程化菌株基因组DNA 浓度,超纯水作为空白对照,测得DNA 浓度为8.2 ng/μL,D260nm/D280nm值为1.79,在1.7~1.9 范围内(纯DNA 的D260nm/D280nm值为1.80)。
2.2 实时荧光定量PCR 检测宿主DNA 残余量标准曲线的建立
标准品DNA 浓度为1×10-3~1×104pg/μL 时扩增曲线光滑平稳,峰值较高,3 个平行样品的重复性较好,清晰区分了基线期、指数扩增期、平台期,呈现出“S”型曲线,DNA 扩增效率高(图1)。选取标准品DNA 浓度为1×10-3~1×103pg/μL 拟合标准曲线,以每个反应管内荧光信号达到设定阈值所经历的拷贝数Ct 值为纵坐标,样品浓度取对数值为横坐标,得到标准曲线的斜率为-3.174,截距28.92,扩增效率为1.22(图2),样品浓度x与循环阈值Ct 的线性关系表达式为Ct=-3.714x+28.92(x是DNA 标准品浓度取对数值)。图3 为温度从65℃升至95℃系统收集到的DNA 标准品的熔解曲线,可以看到所有标准品均呈现单一明显的峰,无其他杂峰,说明反应特异性良好,无非特异性扩增和引物二聚体等干扰实验结果。
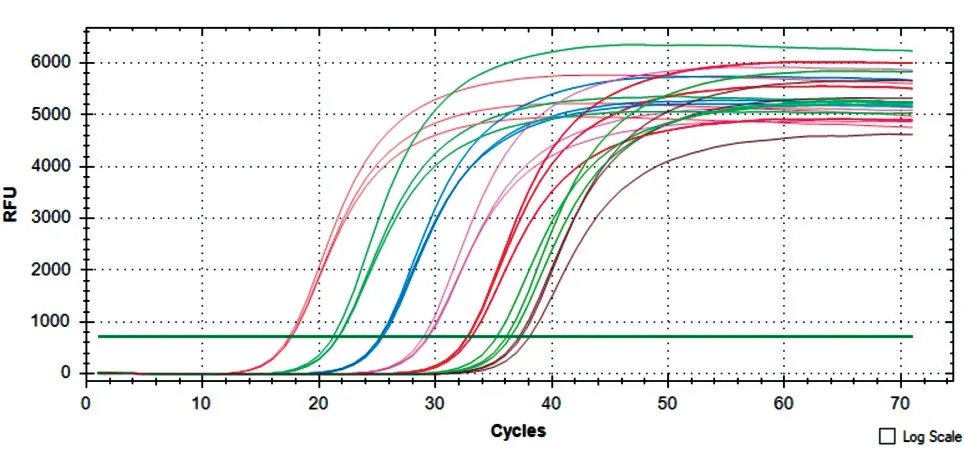
图1 标准品DNA 扩增曲线
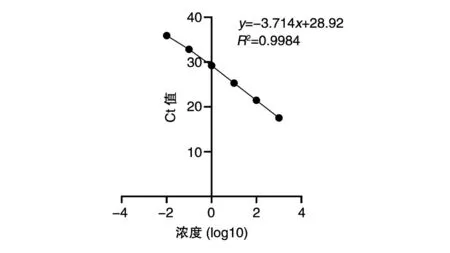
图2 循环阈值Ct 与DNA 标准品浓度的关系曲线
2.3 精密度测定结果
如表1,DNA 标准品浓度为100、1、1×10-2pg/μL 组的8 个平行样品Ct 值的变异系数CV(%)分别为1.43、0.33、1.16,高、低浓度供试品8 个平行样品Ct 值的变异系数CV(%)分别为2.86、2.62,说明该方法检测的精密度高。
2.4 回收率测定结果
加样回收率测定结果如表2,高浓度待测样品组(4.0 mg/mL)的测定浓度与稀释至1/10 后的低浓度待测样品组的测定浓度相差不大,但加样回收均偏差太大,说明高浓度蛋白的存在干扰了PCR 结果。低浓度待测样品组的加样回收率均为80%~120%。
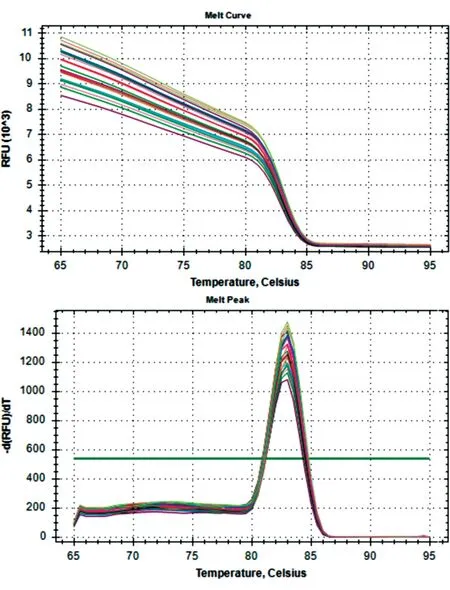
图3 DNA 标准品的熔解曲线
2.5 待测样品中DNA 残余量测定结果
根据仪器检测待测样品的Ct 值,代入标准曲线,再根据加样回收测定结果,用加样回收率校正结果的准确性。为避免高浓度蛋白对PCR 结果的影响,计算低浓度供试品(0.4 mg/mL)的宿主DNA 残余量见表3,经回收率校正后的平均值为0.049 pg/μL。如果按照单抗人用注射剂量为20 mg/次,换算成每剂量DNA 残余量为2.45 ng,满足药典对于酵母系统产品宿主核酸残余量不高于10 ng/剂量的要求。
3 讨论
本研究团队用糖基工程酵母制备的重组单克隆抗体是国内首次利用酵母系统制备重组单克隆抗体,急需建立相应的质控检测方法学,推动中试和临床前研究。
外源DNA 残余量的测定多采用DNA 探针杂交法或荧光染色法[12-14],这也是2015 版药典中推荐的方法,但抗体制品用药剂量大,人用剂量达到几十甚至几百毫克。由于存在高浓度蛋白的干扰[15]和实验方法检测限的限制,测定结果往往不太理想。实时荧光定量PCR 是在PCR 体系中加入荧光基团,利用荧光信号累积实时监测整个PCR 过程,最后通过特定数学原理对未知模板进行定量分析的方法。荧光信号的强弱与扩增产物量成正比,从而达到绝对定量的效果。相对于DNA 探针杂交法和荧光染色法,实时荧光定量PCR 法具有操作简单、特异性好、自动化程度高等优点。
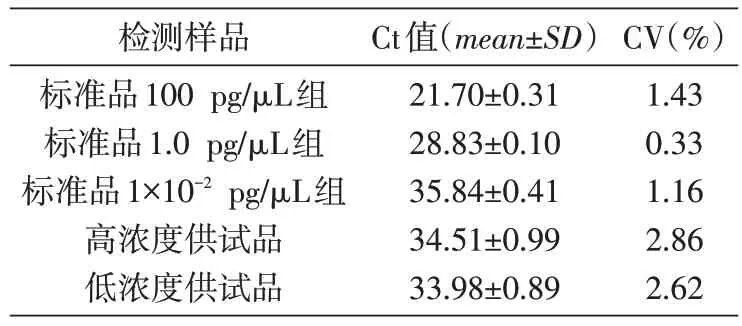
表1 DNA标准品和待测样品的精密度

表2 回收率测定结果

表3 低浓度待测样品组的DNA残余量
在这里我们优化了引物设计、反应体系、反应条件、加样回收实验等,提高了PCR 反应的特异性,基本克服了方法学缺陷。标准品DNA 浓度为1×10-3~1×103pg/μL 时具有良好的线性关系(R2>0.99),满足微量DNA 残余的检测需求。利用本法测得人用重组单克隆抗体(毕赤酵母)原液中宿主DNA 残余量为2.45 ng/剂量,低于10 ng/剂量的质量控制标准。优化后的加样回收实验,DNA 标准品回收率控制在80%~120%,方法精密度良好,RSD 值≤5%。该方法检测限达到1×10-3pg/μL,是一种灵敏度高、稳定性好、简便快速的检测生物制品(毕赤酵母)中宿主DNA 残余量的方法,适用于新药研发的质量控制研究,具有较好的应用范围和前景。
