鸡NLRX1表达的细胞定位及其siRNA干扰效果的研究
2019-11-22席德先许志伟寇家倩李槿年刘雪兰
朱 祥,马 珍,叶 红,丁 泠,席德先,许志伟,寇家倩,李槿年,刘雪兰
(1.安徽农业大学兽医病理生物学与疫病防控安徽省重点实验室,安徽 合肥 230036;2.安徽省医学科学研究院,安徽 合肥 230061)
NLRs (Nucleotide-binding domain and leucine-rich repeat-containing receptors)是天然免疫受体家族中一类重要的胞质内模式识别受体,主要感受外源病原微生物侵入和内源性的危险信号[1]。NLRs 家族成员多,分布广,无论高等动物还是低等动物,均有相关报道,同时还被认为其是植物R (NBS-LRR,核酸结合位点和富含亮氨酸重复)基因的同源物,存在于多种植物中,参与植物的抗菌反应[2-3]。NLR 分子中主要包括3 大功能区:位于N 端的效应结构域,主要负责募集下游效应信号分子;中间是一个NACHT 结构域(又称NOD),能够结合核酸并具有ATPase 的活性,对NLR 分子的寡聚体化与活化具有重要意义;C 端为数量可变的亮氨酸重复序列富集区(LRRs),主要负责识别配体(包括保守的PAMP或其它配体),同时也介导自身调控和蛋白间的相互作用[4]。
NLRX1 (NLR family member X1),又称 NOD5、NOD9、NOD26、DLNB26 和 CLR11.3,是 NLRs 家族中重要成员之一,其功能主要表现为对天然免疫应答的负调控作用[5]。但同时也发现NLRX1 可正向调控活性氧(ROS)的产生、细胞自噬和细胞凋亡[6]。NLRX1 分子结构中主要包含位于N 端的X 结构域、分子中部的NACHT 结构域和C 端的LRRs 结构域[7]。已有研究表明,人NLRX1 蛋白分子的N 端aa1~aa39 氨基酸基序具有线粒体定位功能[8]。当细胞受到病毒RNA 或 DNA 刺激后,NLRX1 通过LRRs 与MAVS 或STING 结合,从而抑制细胞I 型干扰素的产生[9-11]。NLRX1 还可作为炎症信号传导器或感受器,与IKK 复合体结合,抑制转录因子NF-κB 的激活,从而对TLR 受体介导的炎症反应发挥抑制作用[12-13]。
近年来,有关人、小鼠等哺乳动物以及多种鱼类NLRX1 相关的研究报道较多[14-15],而关于禽类NLRX1 分子特征和生物学功能方面的研究报道较少。本研究从青脚麻鸡肺组织中首次克隆鸡NLRX1(chNLRX1)基因cDNA 序列,分析其分子结构特征,并观察chNLRX1 在细胞中的表达和亚细胞定位,建立以腺病毒介导的RNAi 干扰chNLRX1 表达的方法,为进一步研究鸡NLRX1 分子的生物学功能奠定基础。
1 材料与方法
1.1 主要实验材料 1日龄青脚麻雏鸡购自合肥某孵化场;高保真酶FastPfu Fly PCR SuperMix、pEASY-Blunt Zero 载体、cDNA Synthesis SuperMix Kit、TRIzol、Trans-T1 感受态细胞均购自北京全式金生物公司;SMARTer RACE 5'/3' 试剂盒购自宝日医生物技术(北京)有限公司;HEK293T 人源胚胎肾细胞系、DF-1 鸡胚成纤维细胞系、pmCherry-C1、pEGFP-C1 载体均由本实验室保存;pHBAD-U6-MCS-CMV-puro 载体购自汉恒生物科技(上海)有限公司;Hoechst 33342 荧光试剂购自北京索莱宝科技有限公司;脂质体LipofectamineTM3000 购自 Thermo Fisher 公司;鼠抗 GFP 和抗 -actin 单克隆抗体(MAb)、羊抗鼠HRP-IgG 均购自南京金斯瑞生物科技公司;超敏ECL 化学发光底物购自武汉博士德生物公司。
1.2chNLRX1保守区基因片段的克隆及序列分析采集50 mg 青脚麻雏鸡肺脏组织于液氮中速冷并研磨成粉,采用TRIzol 提取其总RNA,经微量核酸蛋白检测仪分析RNA 浓度和纯度,-80 ℃保存备用。
从GenBank 数据库中检索人(NM_024618.3)和小鼠(NM_001163742.1)以及其它动物的NLRX1基因序列,应用Clustal X 软件比对NLRX1基因相对保守区序列,据此设计一对特异性引物:chNLRX1-F1:5'-TCATCCCCTTCTCCTGTGAGGAC-3'/chNLRX1-R1:5'-CGCAGGAAGCTGGTGTAGATGC-3'。
利用 DNAMan 和 UniProt 软件分析鸡与人(NP_078894.2)、 小 鼠 (NP_001157214.1)、 鮸 鱼(ALJ32259.1)的NLRX1 氨基酸的组成和结构域。结果显示,鸡NLRX1 蛋白结构中含有类似于人、小鼠、鮸鱼 NLRX1 的 1 个 NACHT 结构域和 7 个LRR 结构域。此外,人NLRX1 蛋白N 端aa1~aa39发挥线粒体定位作用[8],chNLRX1 蛋白与该对应的N 端aa1~aa43 序列可能存在线粒体定位效应,但该段序列保守性较低。
1.3chNLRX1基因5'/3' 端序列的 PCR 扩增及序列分析 将上述获得的chNLRX1基因片段与Gen-Bank 中chNLRX1基因序列进行比对分析。在此基础上,设计扩增NLRX1-3' 端基因序列的特异性引物 3'GSP-F:5'-TGTCATCAGGAACAGCCGCAAAGG-3'和5' 端序列的特异性引物5'GSP-R:5'-ACAGGGCA GCCAGGTACTCCTGCATTGCAGG-3', 将 1.2 中 的总RNA 反转录为cDNA 作为模板,以高保真酶SeqAmp DNA Polymerase 进行3' 和5' 端序列的末端快速克隆(RACE)扩增,反应程序为:94 ℃30 s,72 ℃2 min,5 个循环;94 ℃ 30 s,70 ℃ 30 s,72 ℃ 2 min,5 个循环;94 ℃ 30 s,68 ℃ 30 s,72 ℃ 2 min,25个循环。RACE 扩增产物经1.0 %琼脂糖凝胶电泳检测后回收纯化,连接至pEASY-Blunt Zero 载体,转化Trans1-T1 感受态细胞,经菌液PCR 鉴定为阳性的3 个克隆由生物公司测序,所获序列通过NCBI-Blast 分析。
那一刻,我估计我是疯了,要么就是不想活。我刺激他,希望他追上来打我。他虽然腿跛,但我年少,他打我还是没问题的。他就是打不过,我也不能还手。我若还手,就是反上,要遭全村子人的唾弃。
1.4 chNLRX1 分子结构分析 用DNAStar 软件分析上述扩增的基因序列并进行chNLRX1全基因序列拼接,分析其开放阅读框(ORF)大小和编码的氨基酸组成,预测chNLRX1 编码蛋白的大小与等电点。
应用DNAMAN 软件分析13 个不同物种的NLRX1 基因序列的同源性,通过UniProt (https://www.uniprot.org/)软件分析鸡 NLRX1 与人(NP_078894.2)、小鼠(NP_001157214.1)、鮸鱼(ALJ32259.1)氨基酸序列结构域,并利用建模软件SWISS-MODEL (https://Swissmodel.expasy.org/)构建NLRX1 蛋白分子的空间三维结构,比较其结构的相似性。
1.5 真核表达载体的构建 设计用于扩增chNLRX1ORF 预测区基因序列的一对特异性引物:chNLRX1-F2: 5'-CGGAATTCTATGTCCTGGGCCAT GCAGTAC-3' (EcoRⅠ)/chNLRX1-R2:5'-GGGGTAC CTCAAAGGGTCCCATGCTGGAG-3' (KpnⅠ)。以青脚麻雏鸡肺脏cDNA 为模板,PCR 扩增chNLRX1ORF 预测区基因,克隆至真核表达载体pmCherry-C1 中,构建 pmCherry-chNLRX1 重组质粒,经EcoRⅠ和KpnⅠ双酶切和测序鉴定该质粒,经去内毒素试剂盒抽提质粒后用于转染细胞。
例(10):Then for the next two hundred years the family tree shows a succession of soldiers— noble, high-spirited fellows, who always went into battle singing, right behind the army, and always went our a-whooping, right ahead of it.
1.9 Western blot 检测干扰效果 分别收集上述腺病毒-shRNA 干扰实验组和对照组的细胞,加入RIPA 细胞裂解液(含 1.0 mmol/L PMSF),4 ℃离心获取上清中细胞全蛋白进行SDS-PAGE 凝胶电泳后转印PVDF 膜,5 %脱脂奶粉室温封闭1 h,分别以鼠抗 GFP 和抗 -actin MAb (1∶200)为一抗,4 ℃过夜孵育,以羊抗鼠HRP-IgG (1∶5 000)为二抗,室温孵育1 h,western blot 检测chNLRX1-GFP 融合蛋白表达水平,通过Image J 分析灰度值并计算出干扰效率。
2.2chNLRX1在真核细胞中的表达与定位检测结果 将克隆的chNLRX1基因编码区序列,插入pm-Cherry-C1 真核表达载体,构建了pmCherry-chNLRX1 重组质粒,经双酶切和测序鉴定该质粒均显示该质粒正确构建。利用脂质体分别将该重组质粒转染HEK293T 细胞中过表达,以Hoechst 33342 核酸染料对转染48 h 后的细胞核进行染色。
1.8 腺病毒介导shRNA 干扰chNLRX1 表达的检测根据ckNLRX1基因的转录本设计3 个干扰靶点,由汉恒生物科技(上海)有限公司合成3 个siRNA 引物序列(表1)。将单链引物退火成shRNA 序列,连接入经双酶切线性化的pHBAD-U6-MCS-CMV-puro 干扰载体,抽提通过测序验证正确重组的pHBAD-shRNA 质粒并委托汉恒生物科技(上海)有限公司进行腺病毒包装与滴度检测。

表1 靶向chNLRX1 基因的siRNA 干扰序列名si-NLRX1-1 si-NLRX1-2 si-NLRX1-3 RNAi 对照(sh-ctrl)5'-CAGGATAACTTGGTGGAGATGCTAT-3'5'-AGGAGCTGTTCAAAGAGGAGGATTA-3'5'-CCAAGGCCATGAAGAAGACTGTCAT-3'5'-TTCTCCGAACGTGTCACGTAA-3'
将 HEK293T 细胞以 5×104个 / 孔接种于 24 孔板,培养24 h 细胞融合率达50 %~70 %时,按照MOI 500 加入shRNA 包装的腺病毒(腺病毒-shRNA,滴度为1.58×1010pfu/mL),同时将重组质粒pEGFP-chNLRX1 (0.7 μg/孔)通过脂质体介导转染细胞,以sh-ctrl 包装的腺病毒(腺病毒-sh-ctrl)感染的chNLRX1 过表达的293T 细胞作为对照。每个转染实验组和对照组设3 个重复,37 ℃培养6 h 后换正常培养基。继续培养至48 h,通过倒置荧光显微镜观察绿色荧光表达,分析shRNA 的干扰效果。
1.6chNLRX1在真核细胞中的表达与定位观察将HEK293T 细胞以3×105个/ 皿接种至激光共聚焦培养皿,以脂质体LipofectamineTM3000 介导转染pmCherry- chNLRX1 重组质粒,同时,设空质粒转染对照。转染后 48 h,加入终浓度为 15 μg/mL Hoechst 33342 荧光试剂,37 ℃孵育30 min,对细胞核染色。通过Olympus FV1000 激光共聚焦扫描显微镜观察chNLRX1 在细胞内的表达与定位。
基于OBE(Outcomes Based Education)的工程教育模式,是以预期学习产出为中心来组织、实施和评价教育的结构模式,围绕“定义模式——实现模式——评估模式”这条主线而展开,评估OBE工程教育模式而构成教学质量持续改进的闭环,目标是应用型高校学生通过工程教育过程获得学习成果产出。OBE工程教育模式实施步骤:定义OBE工程教育模式,实现OBE工程教育模式,评价OBE工程教育模式,反馈OBE工程教育模式 [1]。
2 结 果
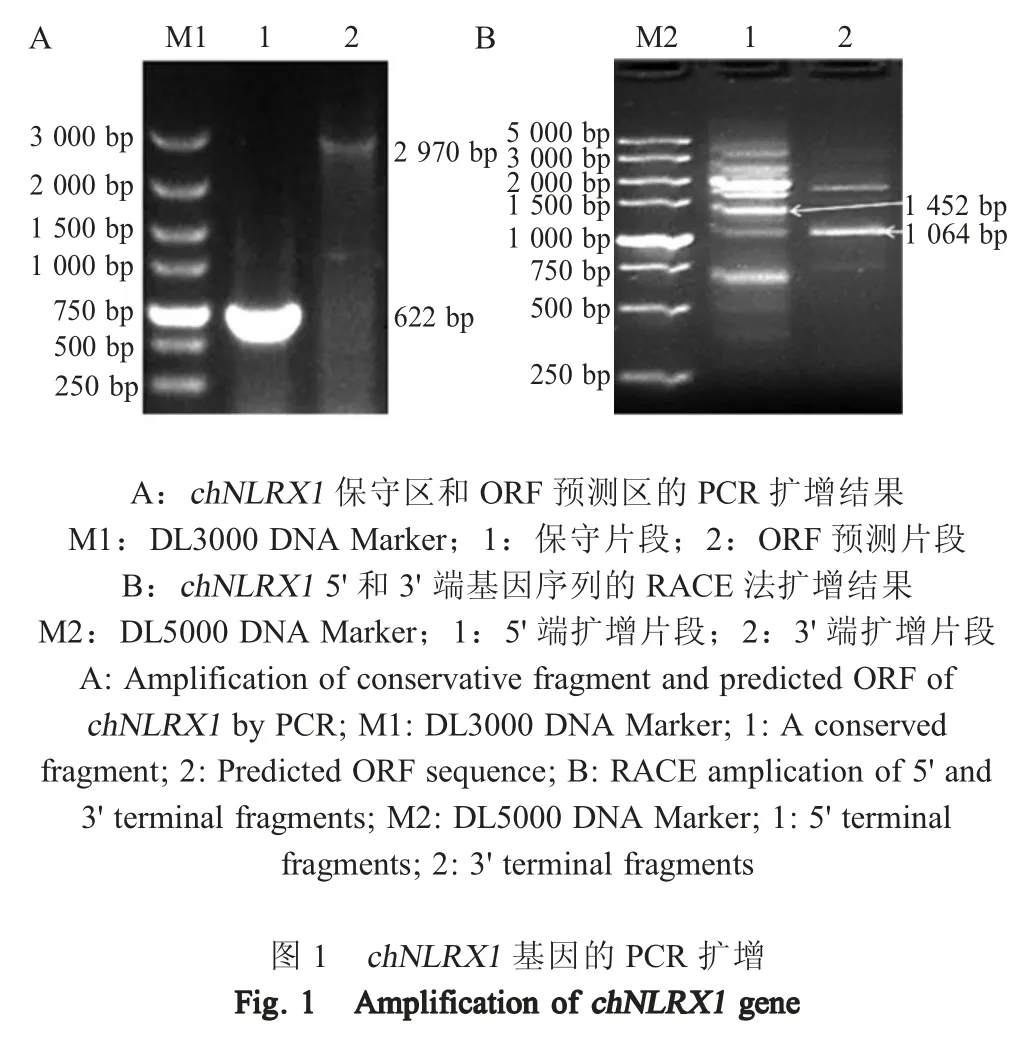
2.1 chNLRX1 的分子特征 以鸡肺脏总RNA 反转录的cDNA 为模板,以1.2 和1.5 中相应引物通过PCR 分别扩增chNLRX1基因的保守区和ORF 预测区,并以RACE 法扩增其5'/3' 端序列,测序后经序列拼接获得chNLRX1基因全长cDNA。扩增结果显示,在约600 bp 和3 000 bp 处出现了预期目的条带,经测序分析表明,获得了chNLRX1基因编码区中 622 bp 保守序列和 ORF 预测区(图1A)。以RACE 方法扩增出多个条带(图1B),将预期大小为1 500 bp (5'端)和 1 000 bp (3' 端)序列经纯化后连接pEASY-Blunt Zero 载体并测序,测序结果显示PCR扩增的基因片段分别为1 452 bp 和1 064 bp。所有片段拼接后显示,chNLRX1 cDNA 大小为3 225 bp,经序列分析显示chNLRX1基因最长ORF 为2 970 bp,预测编码989 个氨基酸,蛋白质分子量约111.11 ku。将该序列上传至GenBank,登录号:MH704638.1。
解 如图13,作FM∥BD且作FN∥CE且不妨将D,E看作动点,则FM,FN是D,E带给F的双重作用下的分解.因为所以以其构建平行四边形如图,即点F的运动轨迹为直线型,沿FP方向.同时,所以PF∥AG,且线段AG满足
利用 DNAStar 软件分析chNLRX1与其它 12 个物种NLRX1的基因序列。比对结果显示,chNLRX1与绿头鸭(Anas platyrhynchos)NLRX1部分基因序列的同源性最高,达到86.5 %;与人NLRX1基因的同源性为64.9 %,与小鼠、牛、野猪等其它动物NLRX1基因的同源性接近其于与人NLRX1基因的同源性,为63.0 %~65.8 %;与草鱼、金鱼、鮸鱼等鱼类NLRX1的同源性相对较低,为53.2 %~57.5 %。表明,chNLRX1基因在遗传进化上主要趋近于绿头鸭和哺乳动物的NLRX1的基因序列。
将总RNA 反转录成cDNA 为模板,以高保真酶FastPfu Fly PCR SuperMix 经 PCR 扩增 chNLRX1 保守区基因序列,反应程序为:94 ℃4 min;94 ℃1 min、60 ℃ 1 min、72 ℃ 1.5 min,30 个循环;72 ℃10 min。PCR 扩增产物经1.5 %琼脂糖凝胶电泳检测后回收纯化,连接到pEASY-Blunt Zero 载体构建重组质粒pEASY- chNLRX1,转化Trans1-T1 感受态细胞,经菌液PCR 鉴定后选取2 个阳性克隆由南京擎科生物公司测序,所获序列通过NCBI-Blast分析。
(1)加强对资产证券化的信用管理。保证风险抵押物的质量。风险抵押物的质量问题一直在影响着我国资产证券化的进程,资产证券化的资产价值与风险抵押物的实际价值不符是资产证券化的巨大风险。尽管近几年来我国的资产证券化抵押物质量水平整体不错,但面对不良资产带来的巨大风险,银行等金融机构要加大审查力度,以保证基础资产的质量。
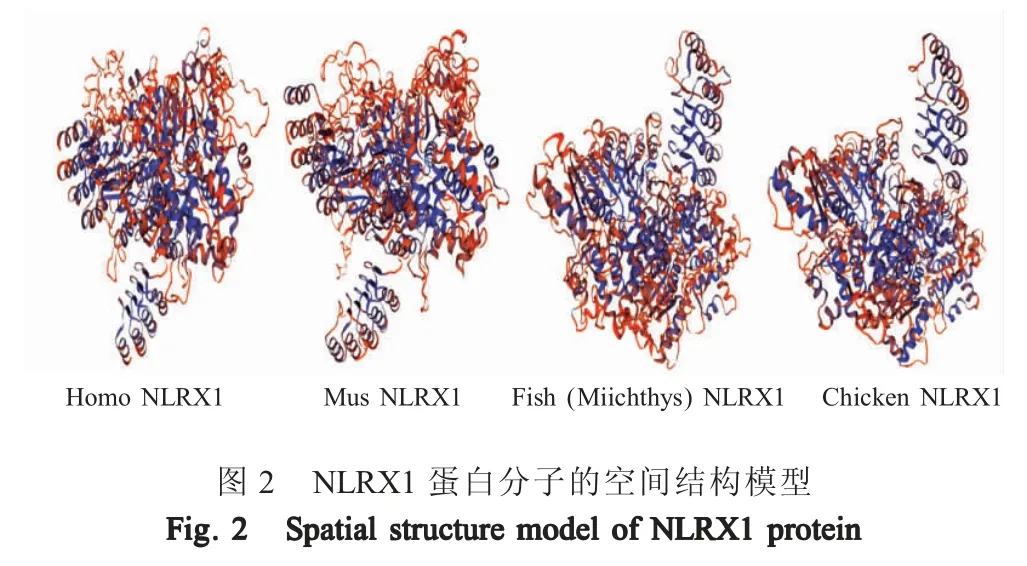
进而通过SWISS-Model 软件分别对上述4 个物种的NLRX1 蛋白空间结构进行同源建模。结果显示,与人和小鼠NLRX1 相比,chNLRX1 具有与鮸鱼NLRX1 更为相似的三维空间结构(图2),即二者蛋白分子结构的相似性更高。上述结果表明,chNLRX1 蛋白空间结构更接近于鱼类NLRX1。
1.7 chNLRX1 的亚细胞定位 以pmCherry-chNLRX1 重组质粒为模板,以1.5 中chNLRX1-F2/R2 引物 PCR 扩增chNLRX1基因亚克隆至 pEGFP-C1 载体,构建pEGFP-chNLRX1 重组质粒,对其经EcoRⅠ和KpnⅠ双酶切鉴定该重组质粒。利用脂质体介导该重组质粒和空质粒分别转染DF-1 细胞。转染36 h后,加入终浓度为0.5 μmol/L 的FM 和 15 μg/mL 的 Hoechst 33342 对活细胞的线粒体和细胞核分别进行荧光标记,通过倒置荧光显微镜观察chNLRX1 在细胞器中的定位情况。
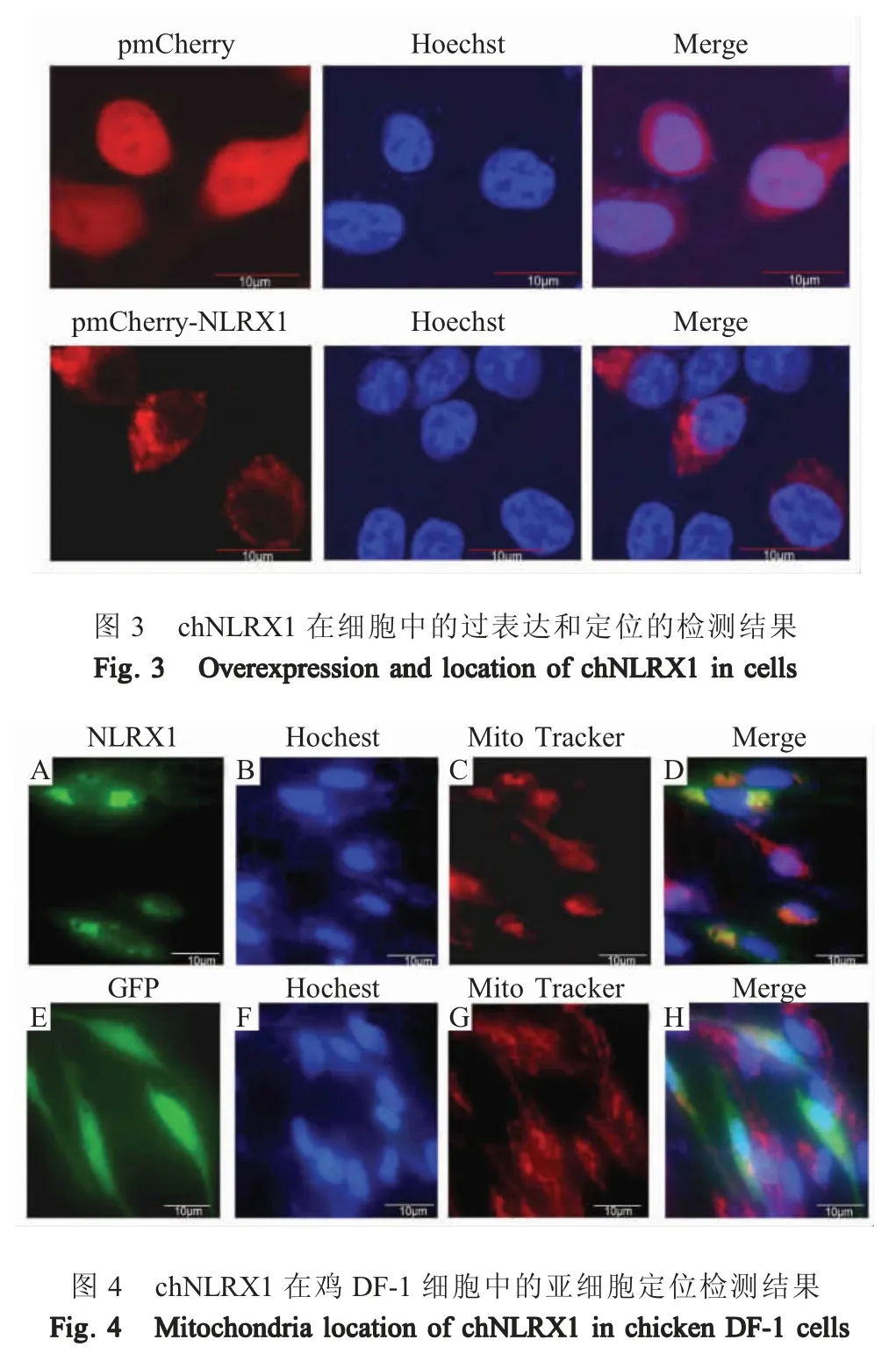
通过激光共聚焦显微镜观察可见,在过表达chNLRX1 的细胞中可见chNLRX1 具有聚集性,主要分布于细胞质中,而空载体转染的细胞中,红色荧光出现于整个细胞,呈弥散分布(图3)。表明,chNLRX1 主要定位于细胞质中。
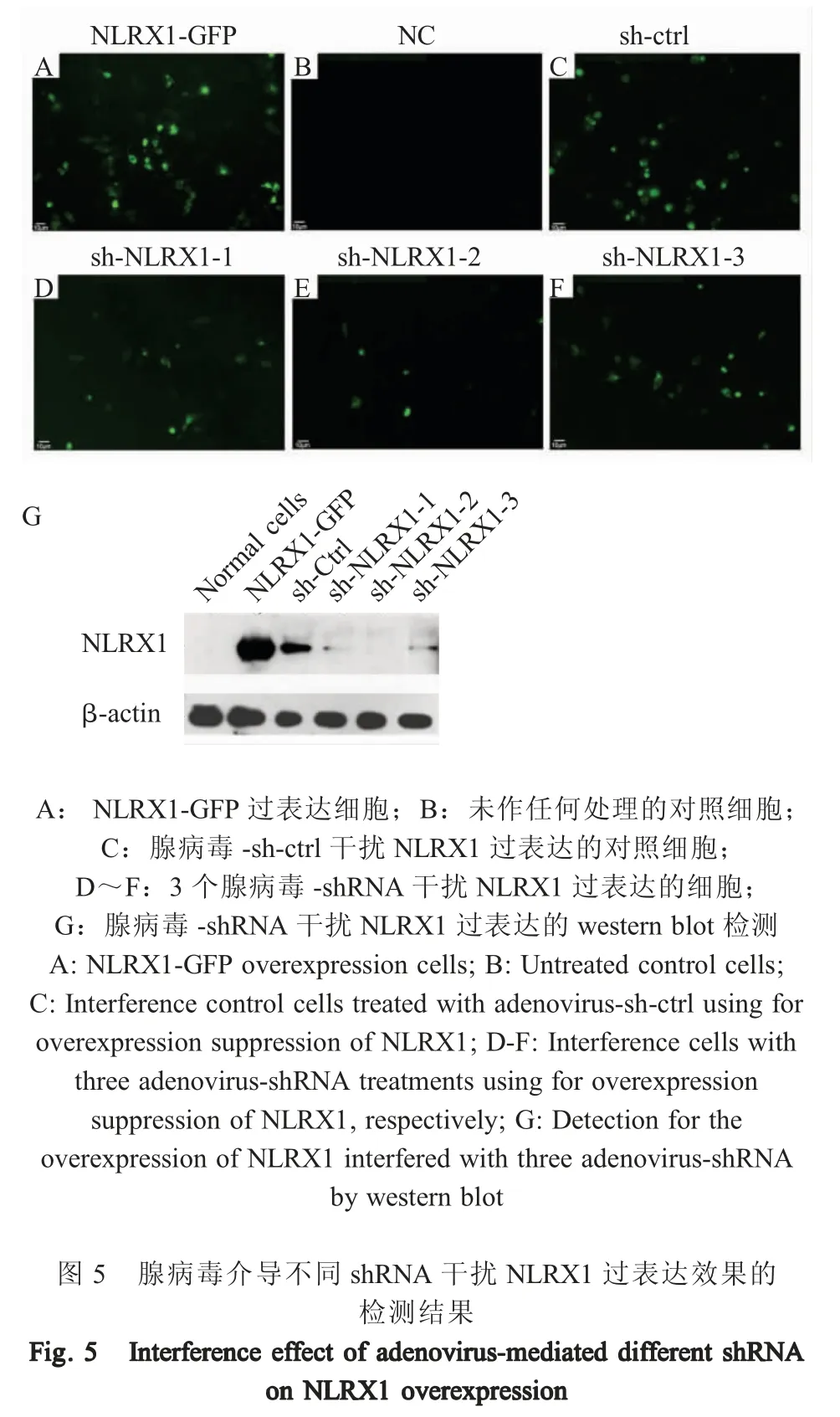
2.3 chNLRX1 的亚细胞定位检测结果 将构建的pEGFP-chNLRX1 重组质粒经双酶切鉴定正确后,转染鸡DF-1 细胞,以荧光染料转染后分别标记细胞中的线粒体和细胞核,通过倒置荧光显微镜观察可见chNLRX1 主要定位于细胞核外(图4A),与线粒体区域有明显的重叠(图4D),而空质粒pEGFP-C1转染的DF-1 细胞中,GFP 绿色荧光均匀分布于整个细胞(图4E),未明显定位于MitoTracker Red 标记的线粒体区域(图4H)。表明,chNLRX1 具有线粒体定位效应。
2.4 腺病毒介导shRNA 干扰chNLRX1B 表达效果的评价 根据chNLRX1基因转录本设计并合成了sh-NLRX1-1、sh-NLRX1-2 和 sh-NLRX1-3 3 个 干 扰序列。通过1.8 的方法将其包装腺病毒。以腺病毒-shRNA 和 sh-ctrl 分别孵育 HEK293T 细胞,同时,分别转染 pEGFP-chNLRX1 重组质粒,36 h 后通过倒置荧光显微镜观察和western blot 分析干扰效果。结果显示,NLRX1-GFP 过表达的细胞可观察到明显的GFP 绿色荧光(图5A),未转染对照细胞中无明显GFP 荧光(图5B),表明NLRX1 在转染细胞中实现了过表达(图5A 和5B)。以腺病毒-shRNA 干扰NLRX1 过表达的3 个实验组细胞中可见荧光强度明显降低(图5D~5F),尤其是腺病毒-sh-NLRX1-2 干扰组细胞,绿色荧光强度明显低于其它干扰组(图5E),与此相比,在腺病毒-sh-ctrl 干扰NLRX1 过表达的对照组细胞中荧光强度仅稍为减弱(图5C)。
根据试验安排和结果,建立RS3质量分数的回归模型,并对模型方差分析。结果分析表明,此模型的决定系数R2为0.767 6,响应面回归模型达到高度显著性水平(p=0.039 0)(如表2所示)。回归方程模型失拟p=0.057 3>0.05,不显著,说明该二次模型能够拟合真实的试验结果(如表3所示)。则
将5块太阳能电池板串联后(90V)与蓄电池组的正负极连接。为确保蓄电池组的安全,在电路中串接熔断器(5A左右)两个,同时串接一个工作电流为10A的空气开关(QF)。为防止无光照时蓄电池组对太阳能电池板反向充电,在太阳能电池板和蓄电池组之间串接一个10A的二极管,同时在每块太阳能电池板的两个极间都并联一个10A的二极管。最终电路设计如图3所示。
通过 western blot 检测,经 Image J 软件计算chNLRX1 融合蛋白表达的灰度值。结果显示,3 组siRNA 均具有不同程度干扰chNLRX1 融合蛋白表达的效果(68 %~87 %),其中 sh-NLRX1-2 对 chNLRX1 表达的干扰效率达到87 % (图5G)。上述结果表明, sh-NLRX1-2 对NLRX1 过表达具有最佳的干扰效果。
3 讨 论
天然免疫对宿主抵抗病原体感染至关重要,但过度的免疫反应则会对宿主造成伤害,因而宿主体内存在多种负调控机制,以维持免疫反应的平衡。有研究证实NLRX1 在调节过度炎症反应中发挥着重要作用[12-13]。此外,某些病毒能够通过上调NLRX1,抑制I 型干扰素的产生,从而逃逸宿主的抗病毒免疫[9-11]。
哺乳动物和多种硬骨鱼类NLRX1 相关研究报道较多[14-15]。本研究克隆并鉴定了鸡NLRX1基因,发现chNLRX1与人、小鼠以及鮸鱼等NLRX1 在基因序列、结构域和空间结构等方面均具有一定的相似性。与其它物种中关于NLRX1 结构域的报道一致[4]。chNLRX1 分子结构中存在对NLRs 家族蛋白的寡聚体化和活化非常重要的NACHT 结构域以及包含7 个亮氨酸重复序列的LRR 结构域,这与其它物种NLRX1 的LRR 结构域中亮氨酸重复序列数目不同,可能源于分子进化所致[15]。此外,据有关报道称,人NLRX1 的 C 端aa629~aa975 存在一个大的聚合区,包含6 个LRR 结构,可以直接与RNA相互作用,在抗病毒免疫中识别细胞内病毒RNA[9]。
NLRX1 分子最突出的特点是定位于细胞的线粒体[7-8]。Tattoli 等通过构建真核表达人NLRX1 的重组质粒,转染至HEK293T 细胞中研究发现NLRX1 具有亚细胞(线粒体)定位特点[8]。本研究通过构建chNLRX1 真核表达质粒,探究了chNLRX1 是否也具有其它物种NLRX1 的定位特点,结果显示鸡NLRX1 不仅在胞质内表达,而且明显定位于鸡细胞中的线粒体。经预测,chNLRX1 的 N 端定位序列(aa1~aa43)可能发挥类似于人NLRX1 分子N 端定位序列的功能[8],但需要进一步研究与验证。
英特诺中国技术中心具有很强的生产研发实力。位于苏州的区域技术中心是全球唯一一个可以提供英特诺全线产品的技术中心。未来,我们还将加大对深圳工厂的投资,来进一步提升英特诺在中国的本土生产能力。在与现有客户继续深化合作的基础之上,英特诺将在中国进一步拓展细分市场,涉及电商、食品、机场、医药、服装、轮胎等行业。在未来,英特诺希望能够在立足本土的基础上,为中国市场和全球市场提供更多更好的产品与服务。
RNAi 是分子生物学研究的一个重要技术手段,以腺病毒介导shRNA 用于RNAi,由于其带有抗生素标记的载体可以在细胞中持续抑制靶基因的表达,相较于其它载体,病毒携带shRNA 载体可以直接高效率感染细胞以进行基因沉默的研究,转染效果稳定,且可以避免由于质粒转染效率低而带来的影响。本研究设计3 个靶向chNLRX1的siRNA 干扰序列,以腺病毒介导、荧光观察和western blot 检测分析,表明建立了高效干扰NLRX1基因表达的siRNA 方法。上述结果为进一步研究chNLRX1 的功能奠定基础。
