细胞溶酶体降解A型流感病毒HA蛋白的机制研究
2019-11-22姚晓雨刘宇婷郑永辉
姚晓雨,王 斌,刘宇婷,张 晶,刘 鑫,郑永辉
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室- 美国密歇根州立大学天然免疫联合实验室,黑龙江 哈尔滨 150069;2.中国农业科学院上海兽医研究所,上海 201100)
流感病毒是负链RNA 病毒,为正黏病毒科,流感病毒属成员。目前按照核蛋白和基质蛋白的抗原性,可以将流感病毒划分为A、B、C、D 4 类。其中A 型流感病毒具有较为广泛的生物学宿主,可以感染人和多种动物,给公共卫生安全带来了沉重的负担[1-3]。流感病毒为I 型包膜病毒,其进入靶细胞的过程需要膜糖蛋白的介导,流感病毒介导膜融合的包膜蛋白为血凝素蛋白(HA)。HA 蛋白在自然条件下是以三聚体的形式存在于病毒包膜上,而每个HA 单体是由 HA1 和HA2 以二硫键连接组成的。HA 是流感病毒囊膜表面纤突结构的主要成分,其可在动物体内诱导中和抗体的产生,是流感病毒毒力的重要决定因子[4-8]。流感病毒感染宿主细胞后,释放的核糖核蛋白复合物(RNPs)利用宿主细胞内的蛋白质合成机制,在细胞核内转录,继而翻译合成病毒自身蛋白。HA 蛋白作为一种高度糖基化的蛋白,其生物合成受到宿主细胞的严格调控。首先在内质网中形成糖基化的HA0 蛋白前体模式,随后又在高尔基体中进一步加工,后被宿主蛋白酶切割为HA1 和HA2 亚单位[5]。在HA 蛋白合成过程中,需进行糖基化、酰基化等翻译后修饰以及宿主蛋白酶的切割,最终成熟的HA 被转运到膜上以用于子代病毒粒子的组装[8]。
蛋白在宿主细胞内的成熟是一个合成和降解的动态平衡过程[9]。即使在正常生理条件下,细胞中有30 %新合成的蛋白由于错误折叠而被降解,而当细胞处于应激状态时,被降解的蛋白数量可能会更多[9-11]。本实验室前期研究证明流感病毒HA 蛋白能够引起内质网应激,并通过内质网相关蛋白降解(ERAD)途径被蛋白酶体降解,同时发现部分HA 蛋白也被溶酶体降解[12],而其机制尚不明确。本研究尝试阐明宿主细胞通过溶酶体途径降解流感病毒HA 蛋白的机制,为开发新的抗病毒手段奠定基础。
1 材料与方法
1.1 主要实验材料 人胚胎肾细胞293T 及Atg3 基因敲除的293T 细胞、质粒pXBP1u-Luc、pCS-H5HA由本实验室保存;GFP-250 质粒由Elizabeth Sztul 惠赠;表达伪狂犬病毒(PRV) gE 蛋白的重组质粒PRV-gE 及鼠源抗gE 蛋白单克隆抗体(MAb)由田志军研究员惠赠;Lamp2a siRNA 购自GenePharma 公司;聚乙烯亚胺转染试剂(Polyethylenimine,PEI)购自 Polyscience公司;转染试剂LipofectamineRNAiMAX 购自 Invitrogen 公司;二甲基亚砜(DMSO)、溶酶体抑制剂BafilomycinA1(Baf-A1)、自噬抑制剂 Wortmannin 购自 Sigma 公司;抗 H5N1-HA 兔源多克隆抗体购自SinoBiological;兔源抗Atg3 MAb购自Cell Signaling Technology;兔源抗LC3 多克隆抗体、鼠源抗β-actin MAb 均购自Sigma 公司;羊抗兔和羊抗鼠IgG-HRP 购自Jackson 公司。
1.2 HA 蛋白过表达对内质网应激的检测 细胞中错误折叠的蛋白可诱发内质网应激,而细胞为了维持自身稳态可通过特定通路将错误折叠蛋白直接降解。当细胞处于内质网应激状态时,可启动X 盒结合蛋白1 (Xbp1)的剪切。为了验证HA 蛋白由于自身错误折叠而引起的内质网应激,本研究检测了细胞过表达HA 蛋白是否促进Xbp1 的剪切。将野生型293T 细胞以4×105细胞/ 孔的密度接种于六孔细胞培养板,待细胞密度达到70 %~80 %时,利用3 μg PEI 将 1 μg pCS-H5HA 与 1 μg pXBP1u-Luc 按照常规方法共转染细胞,同时将空质粒与pXBP1u-Luc 共转染作为阴性对照。转染后4 h 更换新鲜培养液,转染后48 h,收集细胞,利用RIPA 裂解细胞,取25 μL 细胞裂解液置于检测板中,再加入25 μL萤光素酶检测底物,利用多功能酶标仪检测荧光素酶活性,其大小反应了内质网应激的相对强弱。
1.3 HA 蛋白溶酶体降解的验证 为了验证错误折叠的HA 蛋白是否通过溶酶体通路降解,按照前述方法将2 μg pCS-H5HA 转染至 293T 细胞中,转染后24 h,向细胞中添加溶酶体抑制剂Baf-A1 (终浓度为100 nmol/L),以DMSO 处理细胞作为阴性对照。抑制剂处理细胞24 h 后,收集细胞并裂解,蛋白样品经SDS-PAGE 检测后转移至硝酸纤维素膜,5 %脱脂乳封闭 30 min,分别以 1∶2 000 稀释的抗H5N1-HA 兔源多克隆抗体和1∶2 000 稀释的鼠源抗β-actin MAb 作为一抗,羊抗兔和羊抗鼠IgG-HRP(1 ∶5 000)为二抗,western blot检测HA蛋白及β-actin 的表达,蛋白的相对表达量经由ImagJ 软件计算分析。
1.4 Western blot 检测分子伴侣介导的自噬(CMA)情况 溶酶体相关膜蛋白2a (Lamp2a)是溶酶体膜上的受体,是CMA 途径的主要功能性分子[13]。本研究通过检测抑制Lamp2a 蛋白表达的293T 细胞中HA 蛋白的表达来检测HA 蛋白是否通过CMA 途径降解。首先对购自GenePharma 公司的针对Lamp2a基因的干扰RNA 进行效率验证。RNA 序列如表1所示。

?
利用LipofectamineRNAiMAX 转染试剂,将40 pmol 各siRNA 转染至6 孔板中的生长状态良好的293T 细胞中,转染后 24 h 收集细胞,以 1∶1 000 稀释的兔源抗Lamp2a 多克隆抗体为一抗,羊抗兔IgG-HRP (1∶5 000)为二抗,western blot 检测 Lamp2a的表达水平,筛选出针对于Lamp2a 干扰效率最高的siRNA 用于后续试验。将相应的Lamp2a 特异性siRNA 及对照组 siRNA 转染 293T 细胞后 24 h,将细胞再次转染1 μg pCS-H5HA,24 h 后收集细胞,以H5N1 兔源多克隆抗体(1∶2 000)为一抗,羊抗兔IgG-HRP (1∶5 000)为二抗,western blot 检测 HA 蛋白,同样以上述抗体浓度检测Lamp2a 的表达,分析CMA 途径阻断后,HA 蛋白的表达变化。
1.5 ELISA 检测内吞途径是否参与HA 蛋白的降解为验证内吞途径是否参与HA 蛋白的降解,进行了温度依赖的蛋白内化试验[14]。HA 蛋白为囊膜糖蛋白,其在宿主细胞内合成成熟后,被转运至细胞膜表面,如果细胞表面的HA 蛋白经过内吞途径被降解,那么当蛋白的细胞内吞被激活以后,细胞表面HA 蛋白的数量则相应减少。本试验按照3×104细胞/ 孔的密度将293T 细胞铺于多聚赖氨酸处理的96孔细胞培养板中,pCS-H5HA 转染2 个96 孔板,标记为 1 号板和 2 号板,PRV-gE 转染 2 个 96 孔板,标记为3 号板和4 号板,4 个96 孔板每孔转染0.02 μg质粒。转染24 h 后,轻轻弃掉细胞培养液,抗体使用5 %的BSA 稀释,1 号板和2 号板以抗H5N1-HA兔源多克隆抗体(1∶2 000)孵育,3 号板和4 号板孵育鼠源抗 gE 蛋白 MAb (1∶1 000),每孔加入 100 μL稀释后的抗体,4 ℃孵育1 h 后,1 号板和3 号板以4 %的多聚甲醛室温固定30 min,2 号板和4 号板重新加入100 μL Opti-MEM 板置于37 ℃培养 45 min,以相同方法固定,PBS 洗涤4 个96 孔板两次,加入羊抗鼠或羊抗兔IgG-HRP (1∶5 000)为二抗,室温孵育1 h 后,加入TMB 和终止液3 mol/L 硫酸终止反应,进行ELISA 检测,采用酶标仪测定OD450nm值,检测低温条件下(1 号板和3 号板)和当细胞重新置于37 ℃后(2 号板和4 号板)细胞膜表面的HA 蛋白。
1.6 自噬通路降解 HA 蛋白的检测 将 2 μg pCS-H5HA 转染293T 细胞,转染后24 h,向细胞中添加自噬抑制剂Wortmannin (终浓度为100 nmol/L),以DMSO 处理细胞作为阴性对照,转染后48 h,收集细胞,提取细胞可溶性总蛋白,以抗H5N1-HA兔源多克隆抗体(1∶2 000)为一抗,羊抗兔IgG-HRP(1∶5 000)为二抗,检测HA 蛋白的表达。同时,将2 μg pCS-H5HA 分别转染 293T 细胞 和 Atg3 敲除293T 细胞,转染后48 h,收集细胞,提取细胞可溶性总蛋白,以上述同样方法检测HA 蛋白,分析巨自噬途径被抑制后HA 蛋白的表达变化。
1.7 溶酶体降解HA 蛋白形成的凝集结构的检测将 1 μg pCS-H5HA 和 1 μg 重组质粒 GFP-250 共转染293T 细胞[15],转染后20 h 向细胞加入终浓度为100 nmol/L 的Baf-A1,48 h 后利用荧光显微镜观察绿色荧光,即为凝集结构。每个样品随机选取不同区域,拍摄15 张图片,利用软件ImageJ 定量分析绿色荧光。
1.8 统计学分析 所有实验数据在Graphad prism 6.0 软件中进行配对双尾t 检验统计学分析,其中每组平均值的标准误差(SD)在图例中均以误差线表示,其中*:p<0.05,表示差异显著;**:p<0.01、***:p<0.001、****:p<0.0001,表示差异极显著;ns:p≥0.05,表示无显著性差异。
2 结 果
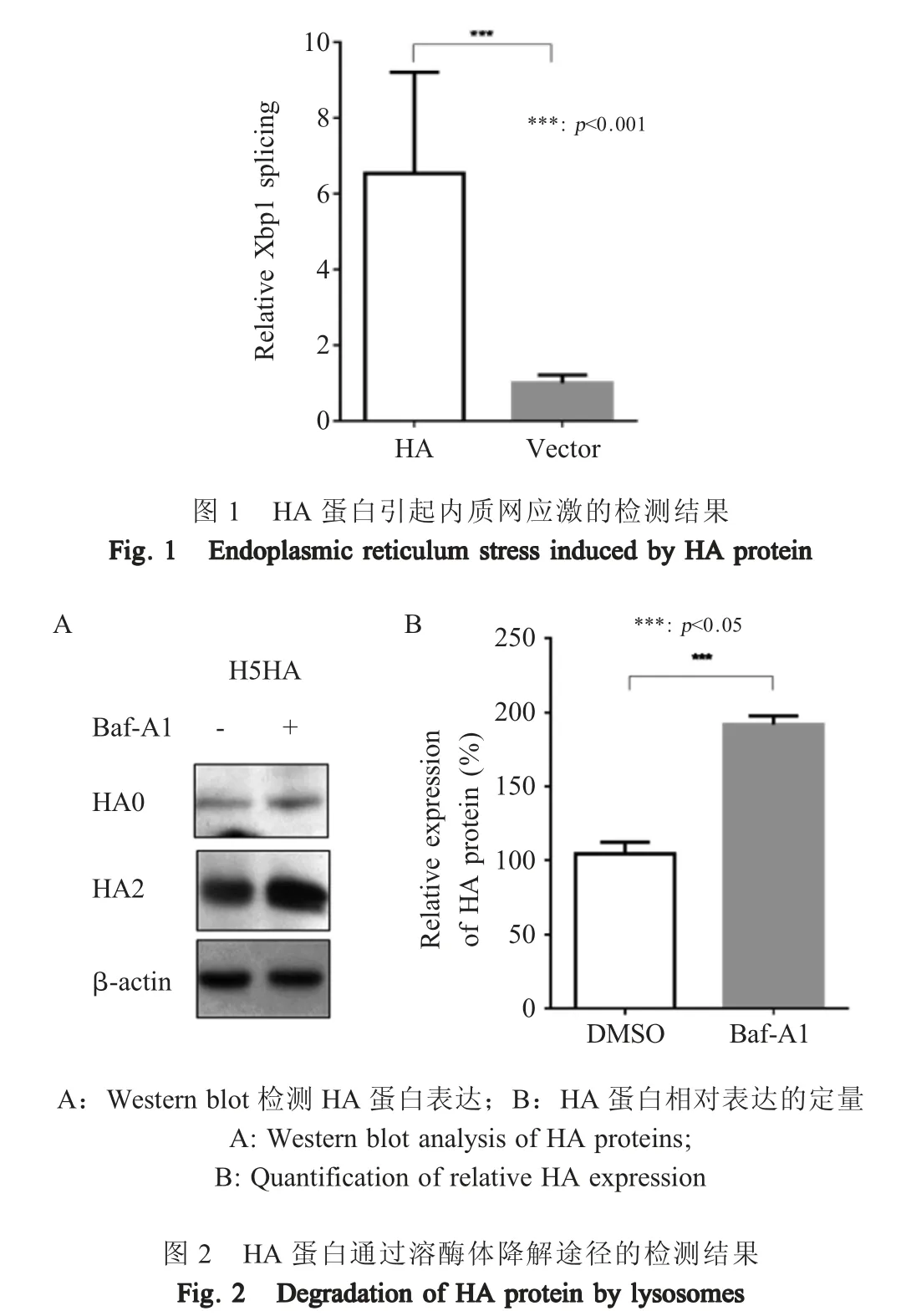
2.1 HA 蛋白诱发内质网应激的检测结果 利用pCS-H5HA 与pXBP1u-Luc 按照常规方法共转染细胞后加入萤光素酶检测底物,利用多功能酶标仪检测荧光素酶活性,结果显示在293T 细胞中,与空载体转染组相比,转染质粒pCS-H5HA 的细胞的荧光素酶活性明显升高(图1),表明过表达HA 蛋白可显著增强Xbp1 的剪切,提示部分HA 蛋白由于错误折叠而诱发了内质网应激。
2.2 HA 蛋白溶酶体降解途径的检测结果 将过表达HA 蛋白的细胞利用溶酶体降解抑制剂Baf-A1 处理,检测HA 的表达水平是否恢复。Western blot 结果显示,当加入溶酶体抑制剂Baf-A1 后,HA 蛋白表达量与DMSO 组相比极显著增加(p<0.001) (图2),表明Baf-A1 能够显著上调HA 的表达水平,提示部分HA 经由溶酶体途径降解。
2.3 CMA 途径降解HA 蛋白的检测结果 利用western blot 检测3 条siRNA 干扰效率,结果显示编号为 1283 的 siRNA 的干扰效果最好(图3A、3B)。将 293T 细胞转染 Lamp2a siRNA-1283 和 pCS-H5HA后,western blot 检测HA 蛋白表达量,结果显示干扰Lamp2a 表达细胞中的HA 蛋白的表达量与对照组细胞相比无明显变化(p>0.05) (图3C、3D),表明HA 蛋白并未通过CMA 途径降解。
2.4 内吞途径降解HA 蛋白的检测结果 利用ELISA 检测不同时间点细胞膜表面HA 蛋白数量变化,以已被证实通过细胞内吞途径降解的PRV 囊膜糖蛋白gE[14]用作本试验的阳性对照。结果显示当细胞被置于37 ℃45 min 后,细胞膜表面gE 蛋白与转染起始点时相比明显降低,而HA 蛋白则无明显变化(图4),表明内吞途径并未参与HA 蛋白降解。

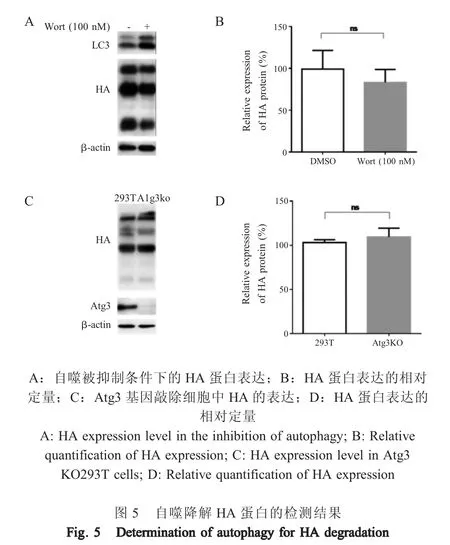
2.5 自噬通路降解HA 蛋白的检测结果 293T 细胞转染pCS-H5HA 后,用自噬抑制剂Wortmannin 处理细胞,western blot 检测HA 蛋白表达水平。结果显示,当自噬被抑制后(表现为LC3-Ⅱ的降解受到抑制),HA 蛋白表达量并无明显变化(图5A、5B),表明自噬途径并未参与HA 蛋白的降解。为了进一步验证该结论,利用自噬相关分子Atg3 基因敲除细胞系,检测HA 蛋白的表达。结果显示HA 蛋白在Atg3 敲除细胞中的表达量与野生型293T 细胞相比并无明显差异(图5C、5D)。以上结果表明HA 蛋白并未通过自噬途径降解。
2.6 凝集的HA 蛋白通过溶酶体降解检测结果pCS-H5HA 与 GFP-250 共转染细胞,BAF-A1 处理细胞后,观察细胞中绿色荧光,并做定量分析。结果显示,HA 蛋白在293T 细胞中可形成凝集结构,且溶酶体抑制剂Baf-A1 可增加细胞凝集HA 的数量(图6)。表明HA 蛋白在细胞内表达时,部分可溶的HA 蛋白首先发生凝集,随后凝集的HA 通过溶酶体降解。

3 讨 论
A 型流感病毒是自然界中最常见的流感病毒,可以造成世界范围内的大流行。目前应对流感病毒感染的方法主要是疫苗接种和药物治疗。商品化的抗流感病毒药物主要有NA 抑制剂药物奥司他韦和扎那米韦以及M2 抑制剂药物金刚烷胺和金刚乙胺[16],但这些抗病毒药物会促使产生出大量耐药病毒株。因此,有必要开发新的抗病毒手段。HA 蛋白是流感病毒启动感染、致病性和传染性的主要决定组分[5-6,8]。HA 蛋白的成熟对于流感病毒的感染有着至关重要的作用[7]。糖蛋白的加工成熟是一个易于出错的过程,而折叠错误的蛋白质不具备正常的生物学功能[9],其在细胞中不断累积会对细胞产生一定的刺激和毒性。细胞为维持稳态则会利用蛋白降解通路降解错误折叠的蛋白质[11]。
为了探究HA 蛋白通过溶酶体降解的具体机制,本研究首先利用溶酶体抑制剂Baf-A1 处理表达HA蛋白的细胞,发现HA 蛋白的确可通过溶酶体途径降解。通过对溶酶体不同降解途径的分析,发现HA 蛋白并未通过CMA、内吞和自噬途径降解,而是HA 蛋白在其表达过程中,不正确折叠的HA 不断聚集,最终形成了一种疏水的致密性结构,即为凝集的HA,该凝集结构可被溶酶体所降解。研究表明多种病毒感染后均可以诱导细胞产生凝集结构,凝集结构对于病毒的组装以及病毒蛋白的降解等方面均发挥着作用[17-19]。有研究报道流感病毒可以劫持凝集结构的形成机制从而利于自身病毒的侵入[20]。本研究发现HA 蛋白能够形成凝集结构并通过溶酶体降解,这有可能是宿主细胞为了对抗流感病毒,通过降解病毒相关蛋白以抑制病毒的复制,此推测需要进一步的深入研究。本研究虽然证明部分HA 蛋白通过溶酶体降解,但对于其具体机制,特别是HA 蛋白形成凝集结构后是如何被溶酶体所降解的,目前仍不清楚,而在这个过程中宿主细胞内又有哪些分子参与其中,尚需进一步探究。本研究结果为新型抗流感病毒药物的研发奠定了基础。
