OmpT对禽致病性大肠杆菌生物学特性和致病性影响的研究
2019-11-22宋祥军蒋胡艳侯曼曼刘红梅祁克宗
宋祥军,蒋胡艳,侯曼曼,涂 健,邵 颖,刘红梅,祁克宗
(安徽农业大学兽医病理生物学与疫病防控安徽省重点实验室,安徽 合肥 230036)
禽致病性大肠杆菌(Avian pathogenicEscherichia coli,APEC)属于肠道外致病性大肠杆菌,能引起禽类局部或全身性感染,易与其它疾病并发,造成混合型感染。APEC 几乎遍布全国各地,严重影响了养禽业的发展,给养禽业带来了严重的经济损失,同时也给人类健康造成严重威胁[1]。目前已知的APEC 的毒力因子有耶尔森强毒力岛(HPI)、鞭毛毒素、脂多糖、黏附素、外膜蛋白等。在APEC 众多转录调控因子中,二元调控系统是大肠杆菌等革兰氏阴性菌中的重要毒力调控单元,有研究发现PhoP/Q 参与调控外膜蛋白合成相关基因的表达[2-3]。本实验室前期研究发现,APEC 中PhoP/Q 的缺失会引起其外膜蛋白编码基因ompT表达量显著下调[4]。
外膜蛋白酶T(Outer-membrane protease T,OmpT)是革兰氏阴性菌中的一种外膜蛋白酶,属于Omptins 家族,位于细胞表面,兼具天冬氨酸酶和丝氨酸蛋白酶活性,可通过加工或者降解多种宿主蛋白质使宿主发病[5]。Hejair 等人研究发现OmpT 的缺失使得APEC 毒力、侵袭力及黏附力均下降[6]。Cheng 等人通过研究发现OmpT 能够抵抗尿阳离子抗菌肽的抗菌活性,促进细菌在泌尿道定植[7]。Stumpe 等人报道,OmpT 可作为一种胞质外蛋白酶,使富含低分子精氨酸的核蛋白的抗菌肽鱼精蛋白失活[8]。陈娟通过荧光定量PCR 方法检测发现缺失ompT基因的APEC 菌株中I 型菌毛合成必需蛋白基因FimC表达量下调,推测ompT基因通过影响菌株黏附的能力来改变APEC 的致病力[9]。但关于OmpT对APEC 生物学特性及致病性影响的机理研究甚少。
本实验通过构建ompT基因缺失株及回复株,检测OmpT 蛋白对APEC 生物学特性和致病性的影响,并通过mRNA 测序对ompT基因的缺失是否会影响其它基因的表达进行分析,为进一步研究APEC 对家禽的感染奠定一定的实验基础。
1 材料与方法
1.1 主要实验材料 APEC AE17 株、AE17-pKD46、pKD3、pCP20、质粒pSTV-28、鸡巨噬细胞HD-11均为本实验室保存;DH5α 感受态细胞、质粒提取试剂盒购自天根生化科技有限公司;1日龄雏鸡购自安徽省安禽养殖公司。
1.2 引物设计 根据GenBank 中登录的APEC O1型ompT基因序列(CP000468.1),利用 Primer Premier 5.0 软件设计引物,引物由上海生工生物工程技术服务有限公司合成(表1)。

表1 用于基因敲除和回复的引物序列引物名称Primer AE17-F AE17-R ompT-in-F ompT-in-R ompT-pKD3-F引物序列(5'-3')Sequence (5'-3')GAGCGATCTTGGCTATACC GTGAAGCTATCTAACAACGG GCTCCTCAACGAACCCAAT TCATCTCTGAATCCCTCCTCA ATGCGGGCGAAACTTCTGGGAATAG TCCTGACACCCCCTATGTAGGCTGG AGCTGCTT TTAAAAGGTGTACTTAAGACCAGCA GTAGTGATGAAGTTACATATGAATA TCCTCCTTAGTTC CAAGAATTGTGGCTCCGTAT AGATCGCCTCGCTGTTAG GATACCGTCCGTTCTTTCCTT TGATGATACCGCTGCCTTACT TTAGTGGTTGTAAAAACACCTGACC GTTAGCGTTGAAGAATTTAGCCC CAGGAAACAGCTATGAC GTTTTCCCAGTCACGAC CCGGAATTCCGGATGCGGGCGAAA CTTCTGGGAA CCCAAGCTTGGGTTAAAAGGTGTA CTTAAGACCA大小/bp Size/bp 1 023 bp 120 bp 1 013 bp ompT-pKD3-R ompT-out-F ompT-out-R pKD46-F pKD46-R pCP20-F pCP20-R M13-F M13-R ompT-EcoRⅠ-F 2 427 bp 888 bp 409 bp 123 bp 978 bp ompT-Hind Ⅲ-R
1.3ompT缺失株的构建 以pKD3 为模板,以ompT-pKD3-F/R 为引物扩增ompT-pKD3 抗性片段,电转化至AE17-pKD46 感受态细胞中,于含氯霉素的LB 平板上挑取阳性单菌落,利用ompT-out-F/R引物对其进行PCR 验证,将验证正确的阳性重组子接种于含氯霉素抗性的培养液中,42 ℃200 r/min过夜培养消除pKD46 后将阳性重组子制备感受态细胞。将pCP20 质粒电转化该感受态细胞,涂布于含氯霉素和氨苄青霉素的平板中进行筛选,将筛选获得的重组子利用ompT-in-F/R,pKD3-F/R、ompT-out-F/R 引物进行PCR 验证,将验证正确的ompT基因缺失菌株命名为ΔompT。
1.4 回复株ΔompT-comp 的构建 利用常规方法提取APEC AE17 菌株基因组为模板,以含有EcoRⅠ和Hind Ⅲ酶切位点的ompT-EcoRⅠ-F/ompT-Hind Ⅲ-R 为引物扩增并回收纯化片段EcoRⅠ-ompT-Hind Ⅲ,连接至pSTV-28 质粒后转化DH5α 感受态细胞,涂布于含氯霉素抗性的LB 平板,挑取阳性单菌落利用M13-F/R 和ompT-in-F/R 引物进行鉴定,将鉴定正确的阳性质粒命名为pSTV-28-ompT,并将其电转化ΔompT,利用M13-F/R 和ompT-out-F/R 两对引物对其进行鉴定,将验证正确的菌株命名为ΔompT-comp。
1.5 AE17、ΔompT以及 ΔompT-comp 生长曲线及运动性的测定 分别挑取 AE17、ΔompT以及ΔompT-comp 单菌落于LB 液体培养基中培养至对数期再次进行转接培养,每隔1 h 测定各自OD600nm值,根据 OD600nm值绘制生长曲线。当 AE17、ΔompT和 ΔompT-comp OD600nm=1.0 时,各取 10 μL菌液于半固体培养基中,9 h 后利用游标卡尺测量菌圈大小,进行各菌株的运动性试验。
1.6 鸡巨噬细胞吞噬试验 接种鸡巨噬细胞HD-11于12 孔细胞培养板,滴加DMEM 培养基培养24 h。弃去培养基,PBS 洗3 次,每孔滴加2×107cfu 细菌(细菌∶细胞=100∶1),使其与鸡巨噬细胞充分作用,然后PBS 洗3 次,去除未被鸡巨噬细胞吞噬的菌体。向 12 孔板中加入含庆大霉素(100 μg/mL)的DMEM 培养基培养1.5 h,再次弃去,PBS 洗3 次,加入1 mL 0.1 % TritonX-100 裂解细胞释放胞内细菌后,10 倍稀释涂于平板上,以平板计数法计算细菌数量。
1.7 细菌半数致死量(LD50)的测定 将 AE17、ΔompT及 ΔompT-comp 分别转接于 LB 固体平板,挑取单菌落培养至对数期,PBS 清洗后每株菌液分别稀释至 6 个浓度梯度:1×108cfu/mL、1×107cfu/mL、1×106cfu/mL、1×105cfu/mL、1×104cfu/mL、1×103cfu/mL。将7日龄雏鸡随机分为19 组,每组8 只,并将3 株菌分别通过大腿肌肉注射1 mL 进行感染试验,对照组注射等量PBS。连续观察7 d,记录死亡雏鸡的数量。根据寇氏法计算上述3 株菌的LD50。
1.8 组织载菌量试验 分别挑取上述3 株菌于LB培养液中培养至对数期,PBS 稀释至1×106cfu/mL,将3 株菌分别通过大腿肌肉注射的方式感染7日龄雏鸡,每只1 mL,每组8 只,感染24 h 后迫杀,无菌采集肝脏、脾脏和肺脏组织,灭菌PBS 研磨后10 倍梯度稀释,利用平板计数法计算细菌数量。
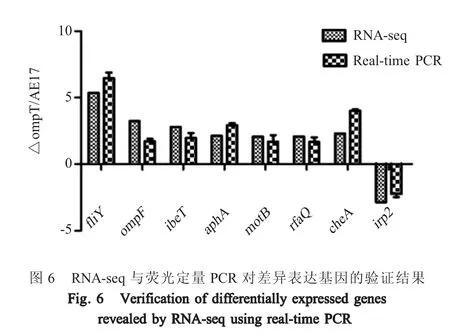
1.9 AE17 及 ΔompT样品的 RNA-Seq 测序 分别将AE17 及ΔompT培养至OD600nm=1.5,离心后弃上清收集菌体。将所收集的菌体用PBS 清洗后置于-80 ℃冷冻保存,样品由上海伯豪公司进行RNASeq 测序。以差异倍数(Fold change)绝对值≤2 且q-value≤0.05 作为筛选差异基因的标准。对所获取的差异表达基因进行GO 及KEGG 分析。选取8 个差异基因,以dnaE作为内参基因通过荧光定量PCR 验证RNA-Seq 的结果,引物见表2。

表2 荧光定量的引物序列基因名称Gene name fliY产物长度/bp Product size (bp)138 ompF 125 ibeT 108 aphA 156 motB 99 rfaQ 114 cheA 194 irp2138 dnaE引物序列(5'-3')Sequence (5'-3')F: CGGTTACTGCCAGCGTATCGTTG R: GCGTGGATGTGCGTACCTATGATG F: TTCGCTGCCAGGTAGATGTTGTTC R: GGTGCTTATGGTGCCGCTGAC F: GTCTGTTACCGCTACTGCCTATGC R: ATCCAACCAATACGGCCACGAAC F: TTCCTGCCACCAACATGAATCCG R: GGATACCACGAGCGCCAACATC F: GGCGCTTACTGGCTCATTCTGG R: GCCGTCAACCGTCGCATCAG F: CAACACCTGCATGATCAAGTTCGC R: ACTTATCCGTGCTGACGCCATTG F: GCTACACGGATGCTGGTGGATTC R: ATCGCCGAAGATGACATCACTGC F: GTCGGTGTGGTCAACGGTTCTC R: CTCAGCAGCATCAGCGAGGTG F: GATTGAGCGTTATGTCGGAGGC R: GCCCCGCAGCCGTGAT 80
1.10 统计分析 实验所涉及到的数据使用SPSS 17.0 软件进行单因素分析,其结果以“平均值±标准误”表示,p<0.01 为差异极显著,p<0.05 为差异显著,具有统计学意义。
2 结 果
2.1ompT缺失株和回复株的鉴定 通过ompT外侧引物ompT-out-F/R 对野生株及缺失株进行PCR 鉴定,结果显示,对照组野生菌株扩增片段约为2 500 bp,ompT基因缺失株扩增片段约为1 500 bp,与预期相符(图1A),表明正确构建缺失株ΔompT。利用 M13-F/R、ompT-out-F/R、ompT-in-F/R 引物对回复菌株进行鉴定,结果显示所扩增片段分别约为1 000 bp、1 500 bp、120 bp,与预期相符(图1B),表明回复株ΔompT-comp 正确构建。
2.2 生长曲线和运动性测定 对AE17、ΔompT和ΔompT-comp 菌株培养后测定各时间点菌液OD600nm值,并绘制生长曲线定,结果显示3 株菌生长曲线基本一致(图2A),表明ompT的缺失不影响APEC的增殖特性。测量 AE17、ΔompT和 ΔompT-comp菌圈大小,结果显示3 株菌的运动直径分别为345±3 mm、330±5 mm、355±3mm,统计学分析显示三者差异不显著(p>0.05) (图2B,2C),表明ompT基因缺失后APEC 的运动性并未受到影响。
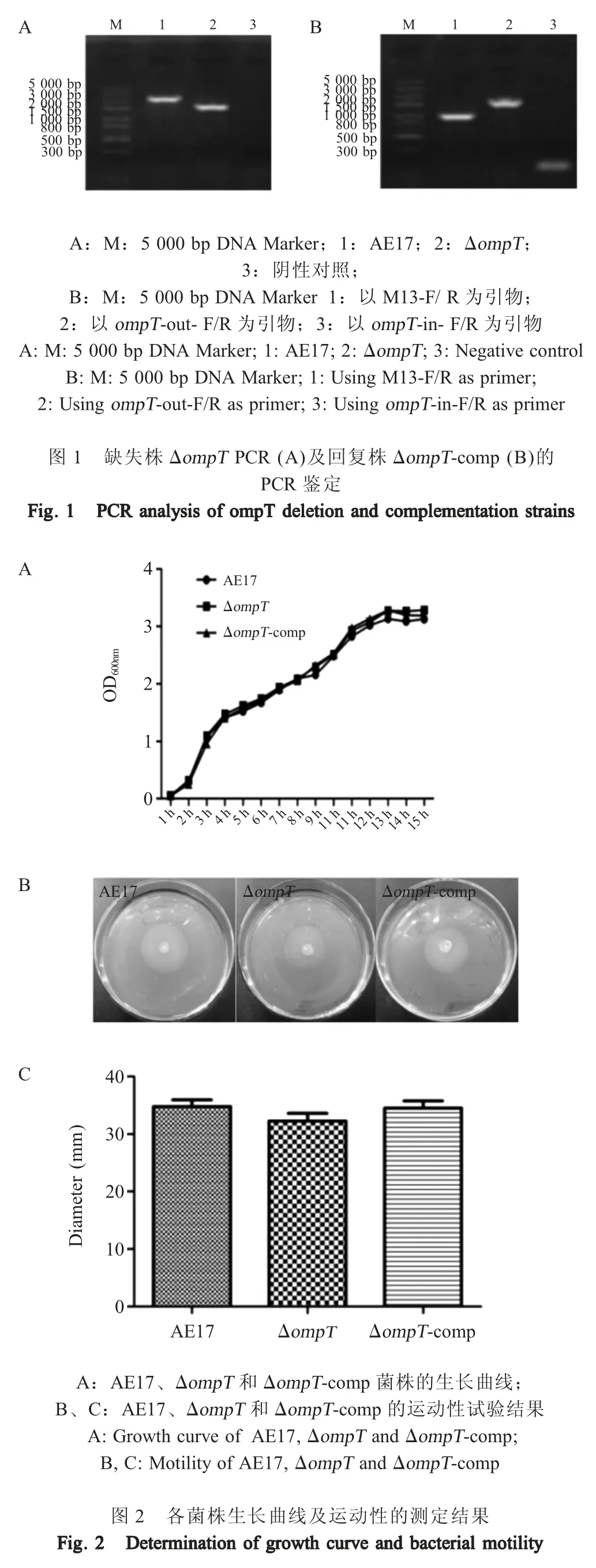
2.3 鸡巨噬细胞吞噬试验结果 通过平板计数法检测裂解的巨噬细胞释放细菌数量,结果显示1.5 h后 HD-11 细胞吞噬 AE17、ΔompT、ΔompT-comp 的细菌量分别为:(4.33±0.21)× 106cfu、(4.27±0.18)×106cfu、(4.57±0.16)×106cfu (图3),统计学分析显示三者差异不显著(p>0.05)。表明ompT基因的缺失不影响APEC 对HD-11 细胞的抗吞噬能力。
2.4 细菌LD50的测定结果 采用寇氏法对3 株菌感染雏鸡后的结果进行统计并计算,结果显示AE17、ΔompT和 ΔompT-comp 菌株感染组的 LD50分别为 7.499×104cfu、7.499×105cfu 和 3.162×105cfu,与野生株相比,ompT基因的缺失导致其对雏鸡LD50增加10 倍。表明ompT基因缺失导致 APEC 致病力降低。
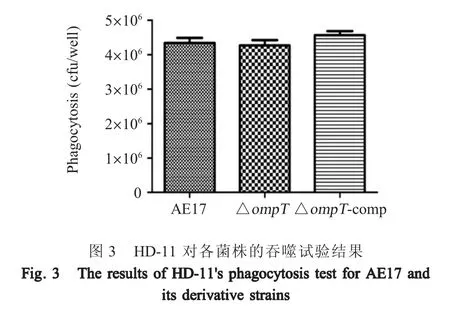
2.5 组织载菌量试验结果 相同剂量的3 株菌感染雏鸡后对试验鸡各脏器组织载菌量进行检测,结果显示 AE17、ΔompT及 ΔompT- comp 感染雏鸡肺脏组织载菌量分别是107.18cfu/g、105.66cfu/g、106.88cfu/g(p<0.01);肝脏组织载菌量分别是 108.08cfu/g、105.22cfu/g、106.94cfu/g(p<0.01)、脾脏组织载菌量分别是108.07cfu/g、106.49cfu/g、108.09cfu/g (p<0.01) (图4)。表明ompT基因缺失导致APEC 在肝脏、脾脏、肺脏组织中的定植力降低。
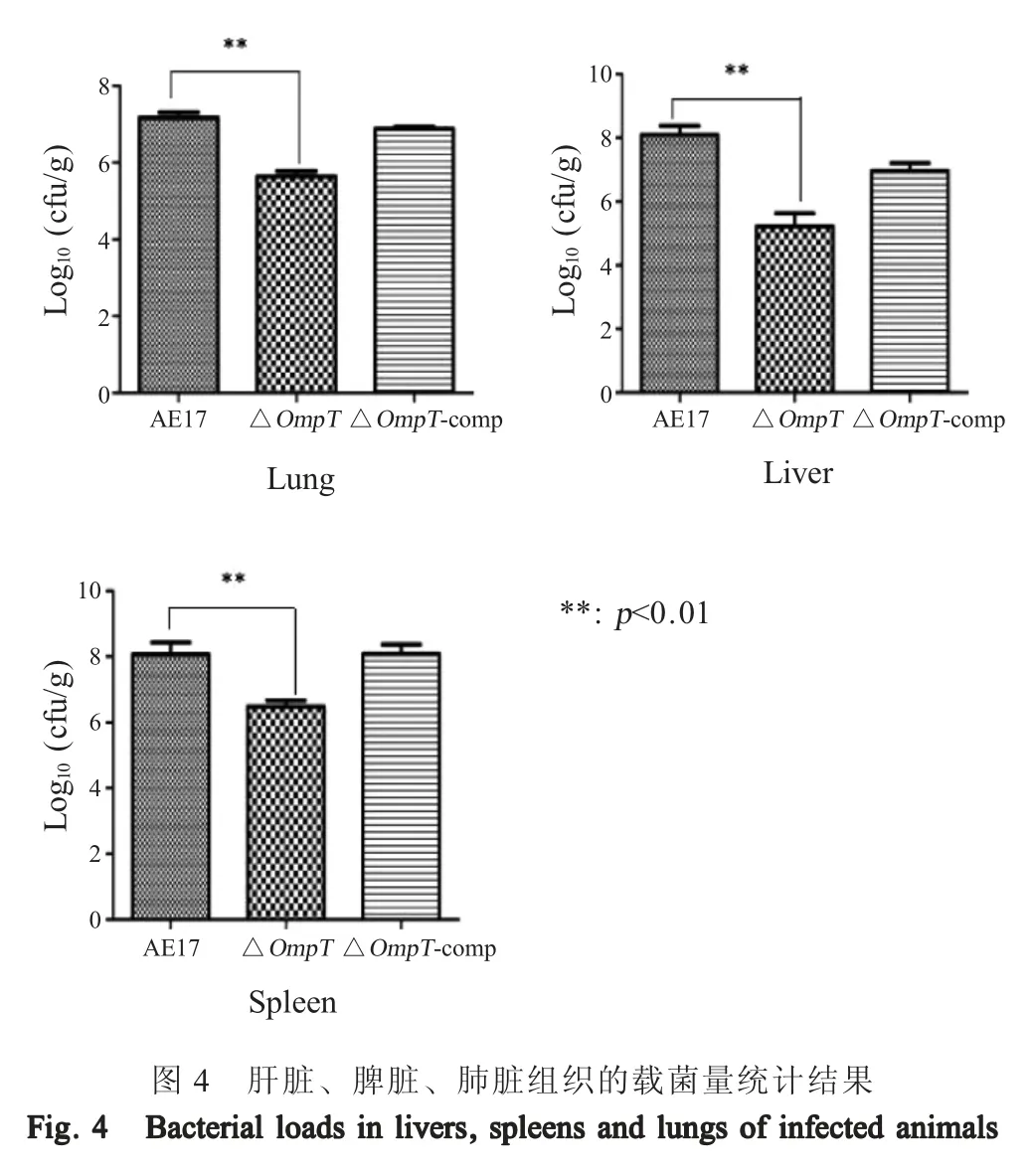
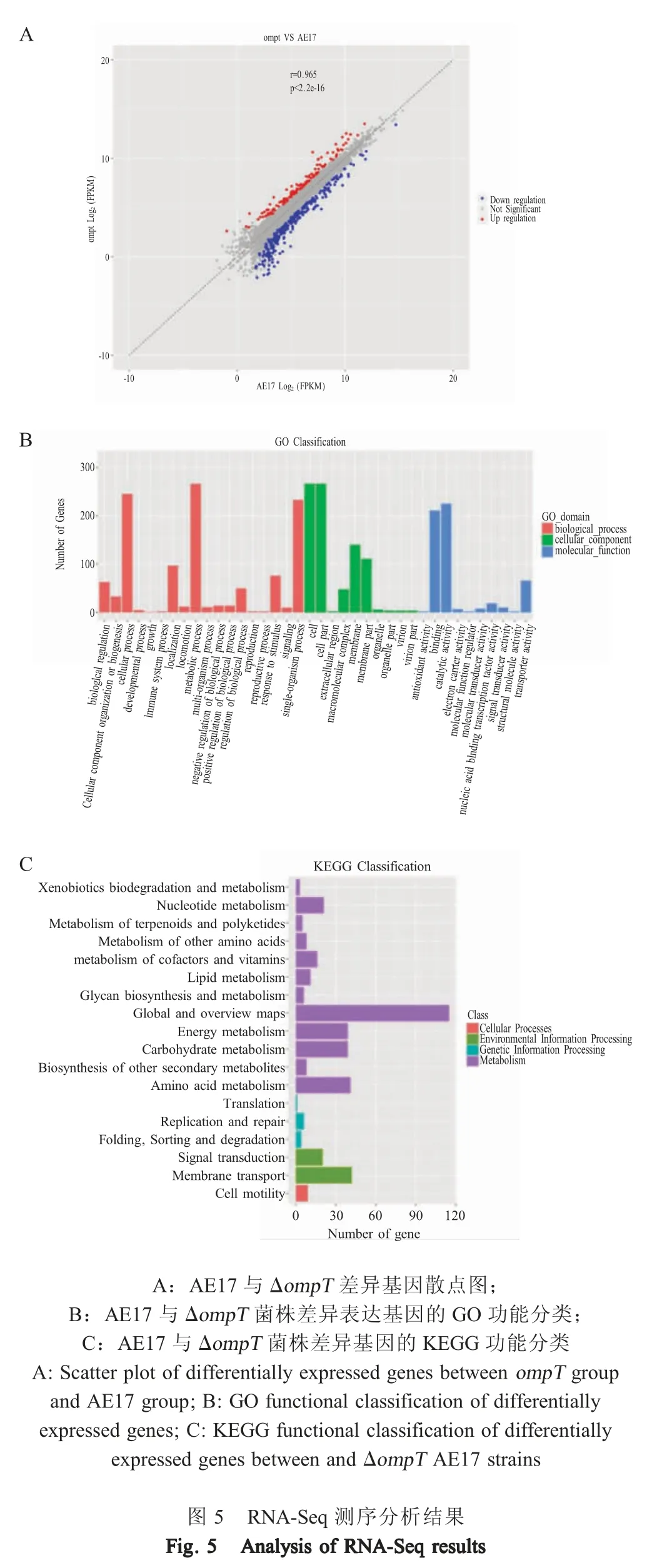
2.6ompT缺失对APEC 基因转录的影响 分析转录组数据,结果显示筛选得到490 个差异表达基因,其中365 个基因表达上调,125 个基因表达下调(图5A)。GO 分析结果显示,差异表达基因主要富集在裂解酶活性、铁离子稳态、肽聚糖生物合成、细胞形态调控等生物学过程(图5B)。KEGG 通路分析结果显示,差异基因主要富集在细菌趋化性、生物膜形成、脂多糖生物合成等通路(图5C)。选取部分差异表达基因进行荧光定量PCR 验证,结果与RNA-Seq 测序结果一致(图6)。以上结果表明OmpT蛋白参与细菌的一些重要通路的调控。
3 讨 论
近年来研究发现细菌的外膜蛋白参与细菌对宿主致病性的调控,OmpT 蛋白在细菌对宿主的致病性中发挥重要作用,但关于OmpT 对APEC 的作用研究甚少。因此本研究通过构建ompT的缺失株及回复株,探究OmpT 对APEC 生物学特性及致病性的影响。
生物学试验结果显示,野生株AE17 与缺失株ΔompT的生长速率差异不显著,与何洪波实验结果[10]一致,表明ompT基因缺失对APEC 的生长速率无影响。在细菌运动性试验中,ompT基因的缺失不影响APEC 的运动性,这可能是由于ompT基因的缺失并不影响菌株鞭毛的运动性。转录组数据分析发现ompT基因缺失后,与鞭毛相关的基因flgA、flgK、flhD、flhE、fliY、ycgR表达量上调,仅fliK表达量下调。FlgK 属于鞭毛中的连接蛋白,起到连接鞭毛丝和基体的作用,FlhD 的表达量决定着鞭毛生成的数量,FliY 为鞭毛马达开关蛋白,FliK 为鞭毛钩长度控制蛋白,YcgR 属于鞭毛制动蛋白,可与鞭毛蛋白相互作用影响鞭毛的运动速率,而运动性试验结果发现野生株与缺失株的运动性差异并不显著,推测可能是多个鞭毛相关差异表达基因相互作用的结果。
组织细菌载量试验结果发现ompT基因缺失后雏鸡肝脏、脾脏、肺脏的载菌量下降,与周亚菲实验结果一致[11],表明ompT的缺失可使细菌对组织的定植力下降。ompT基因缺失后,脂多糖生物合成通路中kpsU、lpxK基因的表达量显著下调。kpsU属于荚膜多糖合成基因簇kps中的基因,荚膜多糖是细菌发挥毒力的主要因素,能够保护细菌免受宿主先天性免疫系统的清除,同时可通过多种机制提高致病菌的毒力,荚膜多糖的存在有助于病原菌在宿主中的定植[12]。lpxK是合成LPS 中类脂A 的重要基因,脂多糖(LPS)是大肠杆菌外膜的重要组成部分。有研究表明LPS 的结构对细胞粘附性、细胞外膜通透性、菌膜形成方面起到重要作用[13]。推测kpsU及lpxK基因表达量的下调可能是组织载菌量下降的原因之一。
LD50检测试验发现ompT缺失株的LD50高于野生株AE17,提示ompT基因的缺失导致APEC 的致病力下降。对ompT缺失株差异表达基因进行KEGG 富集分析发现,差异表达基因富集在多个毒力相关信号通路中,包括糖酵解通路、生物膜形成通路、ABC 转运等通路。糖酵解通路是细菌获取能量的主要途径,转录组数据显示富集在糖酵解通路中的差异表达基因均下调。推测这些基因的下调导致细菌能量减少,导致缺失株的致病力降低。有7个差异表达基因富集在生物膜形成通路中,其中6个差异表达基因下调,生物膜是细菌生长过程中分泌于胞外的成分,参与细菌应对不利环境[14]。本实验发现ABC 转运通路中proW、proV、proX、lolD表达量均下调,ABC 转运蛋白是一类在原核及真核生物中均广泛分布的、具有多种功能的膜蛋白超家族,proVWX 为ABC 转运通路中的摄入系统,是大肠杆菌获取营养的主要途径之一,proW、proV、proX的表达下调可导致APEC 从外界获取的营养物质减少。另外,LolCED 属于ABC 转运通路中的输出系统,有研究表明将大肠杆菌暴露于LolCED 抑制剂中,可使LolCED 功能减弱,最终导致细胞活性丧失,细胞裂解[15]。在本实验中糖酵解通路、生物膜形成通路、ABC 转运通路中相关基因表达量的下调可能是缺失株致病力下降的原因。
本实验初步研究了APECompT基因缺失后对其生物学特性及致病性的影响,结果发现ompT的缺失未对APEC 生物学特性造成影响,但导致APEC的致病力下降。通过转录组分析发现,OmpT 是通过影响多个信号通路基因的表达导致影响APEC 的致病力。本研究为APEC 致病机理研究提供了参考依据。
