牛传染性鼻气管炎病毒SYBR GreenⅠ荧光定量PCR检测方法的建立及应用
2019-11-22任亚初楚会萌程凯慧解晓莉孙阳阳杨宏军唐月新刘文浩李开荣
任亚初,楚会萌,程凯慧,解晓莉,张 亮,孙阳阳,杨 美,杨宏军,唐月新,刘文浩,李开荣
(1.山东省农业科学院奶牛研究中心,山东 济南 250131;2.曲阜市畜牧兽医局,山东 曲阜 273100)
牛传染性鼻气管炎(Infectious bovine rhinotracheitis,IBR)是由IBR 病毒(IBRV)引起的一种急性、热性、接触性传染病,以高热、呼吸困难、流鼻涕、上呼吸道及气管、黏膜发炎等为特征[1]。IBRV可导致潜伏性感染,世界动物卫生组织(OIE)将该病列为B 类疫病,也是我国进境动物必检疾病之一[2]。因此,亟需建立针对IBRV 的快速有效的检测方法。
目前国外已经建立了诸多针对IBRV 的检测方法,如病毒分离培养与鉴定、常规PCR 鉴定、荧光定量PCR 鉴定等方法[3]。但病毒分离培养鉴定与常规PCR 鉴定等传统方法,不能满足现代疾病检测对时效性、准确性、便捷性等要求,亟需建立新的检测方法。曲光刚等建立了IBRV 的荧光定量检测方法[4-9]。在此基础上,本研究通过生物信息学方法分析本实验室分离获得的IBRV 及国内外流行株全基因组序列,发现gD 结构基因在IBRV 全基因组中属于保守序列,因此选取gD 结构基因设计引物,利用SYBR Green I 荧光染料法[10]建立了特异性检测IBRV 的荧光定量PCR 方法,并初步应用于临床样品的检测,为IBRV 流行病学检测及疫情诊断提供了技术支持。
1 材料与方法
1.1 病毒株和样品来源 IBRV、牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)、牛肠道病毒(Bovine enterovirus,BEV)、牛轮状病毒(Bovine totavirus, BRV)、牛冠状病毒(Bovine coronavirus,BCoV)、牛副流感 3 型病毒(Bovine parainfluenza virus type 3,BPIV3)等相关病毒核酸均由山东省农业科学院奶牛研究中心疾病研究室保存。47 份奶牛鼻拭子样品分别来自2018年山东省、江苏省等3 家规模化牧场送检样品。
1.3 引物的设计与合成 参考GenBank 中IBRV(MK552112.1)的全基因组核酸序列,设计扩增IBRV结构基因gD 的通用引物及SYBR GreenⅠ荧光定量PCR 引物(表1),由擎科生物技术有限公司合成。
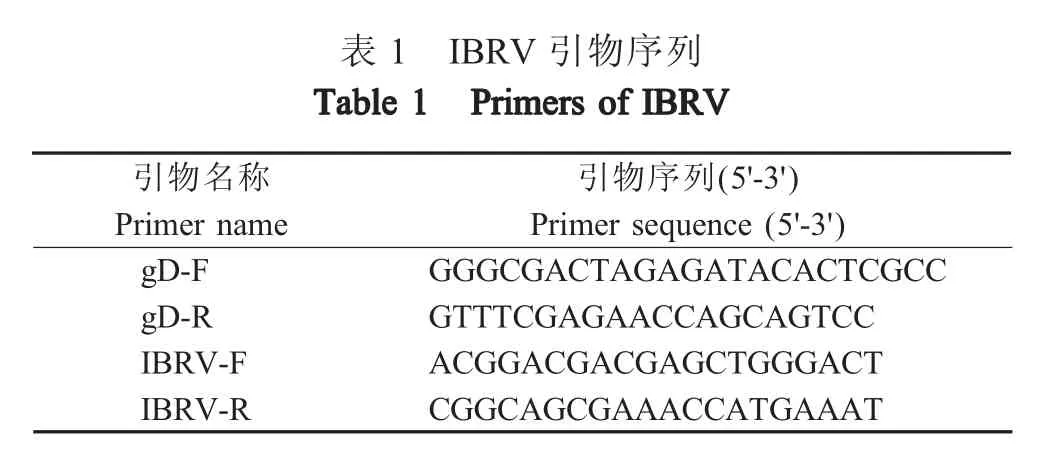
表1 IBRV 引物序列引物名称Primer name gD-F gD-R IBRV-F IBRV-R引物序列(5'-3')Primer sequence (5'-3')GGGCGACTAGAGATACACTCGCC GTTTCGAGAACCAGCAGTCC ACGGACGACGAGCTGGGACT CGGCAGCGAAACCATGAAAT
1.4 重组质粒标准品的制备 取200 μL IBRV 病毒原液,利用病毒基因组DNA/RNA 提取试剂盒提取IBRV 病毒基因组DNA,以其为模板,gD-F/R 为引物进行PCR 扩增,扩增产物经1 %琼脂糖凝胶电泳检测后回收目的片段,克隆于pClone 007 载体,经测序鉴定正确的重组质粒测定浓度,按照以下公式转换成质粒的拷贝数:拷贝数= 质粒浓度×10-9×6.02×1023/(660×质粒长度),并作为阳性标准品,命名为pClone 007-gD,-20 ℃保存备用。
1.5 SYBR Green Ⅰ荧光定量PCR 检测方法的建立 以pClone 007-gD 阳性标准品为模板,采用方阵法分别对引物浓度(5 pmol/L~20 pmol/L)、退火温度(55 ℃~62 ℃)和循环数进行优化,选取Cp 最小值、荧光最高值、融解曲线特异型明显的PCR 反应条件作为最适反应条件。
采用优化后的反应条件,以10 倍倍比稀释后的重组质粒标准品pClone 007-gD 为模板,进行荧光定量PCR 扩增,绘制标准曲线。
1.6 特异性试验 按反转录试剂盒说明书将BVDV、BPIV-3、BCoV、BEV 基因组反转录为cDNA,以其cDNA 及 IBRV 的 DNA 为模板,采用已建立的SYBR Green Ⅰ荧光定量PCR 方法分别进行扩增,并以ddH2O 为阴性对照,分析该方法的特异性。
1.7 敏感性试验 以10 倍倍比稀释的质粒pClone 007-gD 标准品为模板,以ddH2O 作为无模板对照,按照建立的SYBR Green Ⅰ荧光定量PCR 方法进行扩增,每个模板浓度做3 个重复,进行敏感性试验。同时进行常规PCR 试验,比较两种方法的灵敏性。
1.8 重复性试验 批内重复性试验:取4 份不同稀释度的pClone 007-gD 质粒进行荧光定量PCR 检测(同时设置空白对照),每份样品做3 个重复,通过计算Cp 值的标准差(S)和变异系数(CV)来确定荧光定量PCR 的批内重复性。
批间重复性试验:选取上述4 份不同稀释度的pClone 007-gD 质粒为模板,进行荧光定量PCR 扩增,间隔7 d 重复一次,共进行3 次重复,计算Cp值的变异系(CV),以确定荧光定量PCR 的批间重复性。
1.9 临床样品的检测 将47 份奶牛鼻拭子样品取样分装至2 mL 离心管中,经PBS 稀释后将样品4 500 r/min 离心,取200 μL 上清,利用病毒基因组DNA/RNA 提取试剂盒提取核酸,以其为模板,采用本研究建立的IBRV SYBR GreenⅠ荧光定量PCR方法和普通PCR 进行检测,比较二者的检出率,计算二者的符合率。
2 结 果
2.1 重组质粒标准品的鉴定 以提取的IBRV 基因组DNA 为模板,利用引物gD-F/gD-R 进行 PCR 扩增,得到约130 bp 的目的片段,与预期片段大小一致,阴性对照无该目的条带(图1)。将目的片段胶回收及纯化后,克隆于pClone 007 载体。提取质粒测序,测序结果与NCBI 登录的标准序列对比,片段插入位置正确,且同源性为100 %。表明质粒标准品pClone 007-gD 构建正确。扩增后提取质粒,其中pClone 007-gD 的质粒浓度为223 ng/μL,总长度为 2 030 bp。经计算拷贝数为 6.1×1010拷贝 /μL。

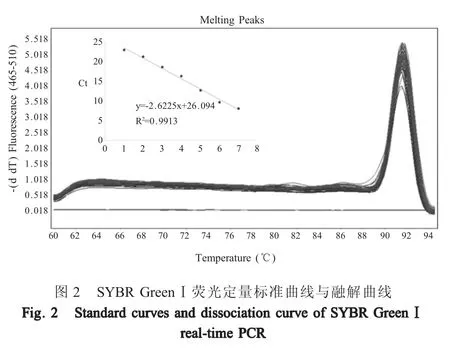
2.2 SYBR Green Ⅰ荧光定量 PCR 方法的建立通过对SYBR GreenⅠ荧光定量PCR 条件进行优化,建立了最佳的反应体系,并获得了最佳循环参数。反应体系IBRV-F/R 各 0.5 μL,模板 2 μL,ddH2O 补充至 20 μL。反应条件:95 ℃ 30 s;95 ℃ 5 s、60 ℃ 30 s,40 个循环。融解曲线:95 ℃5 s,60 ℃1 min,95 ℃,1个循环。建立标准曲线斜率为-2.6225,截距为26.094,相关系数为0.9913 (图2)。
SYBR GreenⅠ荧光定量PCR 检测 IBRV 的融解曲线显示,重组质粒标准品均出现了单一波峰,而阴性对照没有出现融点峰(图2),表明试验中未出现污染和引物二聚体,引物特异性较强。
2.3 特异性试验结果 利用建立的SYBR GreenⅠ荧光定量PCR 方法对IBRV、BVDV、BPIV-3、BCoV、BEV、ddH2O 进行检测,结果显示除了IBRV 核酸检测结果为阳性外,其余病毒核酸与阴性对照检测均为阴性(图3),表明建立的SYBR GreenⅠ荧光定量PCR 方法具有很强的特异性。

2.4 敏感性试验结果 将重组质粒标准品10 倍倍比稀释至 6.1×107拷贝 /μL~6.1×100拷贝 /μL 后作为模板,分别利用建立的SYBR Green I 荧光定量PCR 方法和常规PCR 方法进行扩增。结果显示,SYBR Green I 荧光定量PCR 对质粒标准品的检测下限为 6.1×101拷贝 /μL,而常规 PCR 方法对相应质粒标准品的检测下限为 6.1×102拷贝 /μL (图4),表明本研究建立的方法敏感性较高。

2.5 重复性试验结果 重复性试验结果显示,该方法批内变异系数为1.1 %~2.8 %,批间变异系数为1.2 %~1.9 %,均小于3 %。表明本研究建立的方法具有良好的重复性。
2.6 临床样品检测 采用建立的SYBR GreenⅠ荧光定量PCR 方法检测47 份奶牛鼻拭子样品,结果显示共检出IBRV 阳性样品12 份,阳性检出率为25.5 %(12/47),而普通PCR 阳性检出率为23.4 %(11/47)。经计算,二者的符合率为97.87 %。计算方法为:100 %×(两种方法共同认定阳性数+ 共同认定阴性数)/ 受测样品总数,表明该方法具有较好的检测准确率。
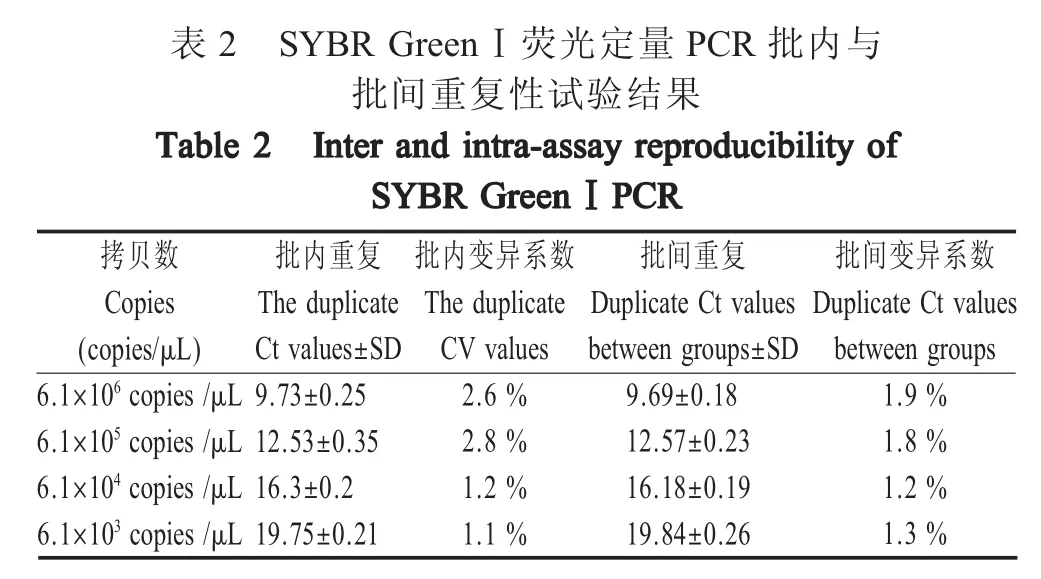
表2 SYBR GreenⅠ荧光定量PCR 批内与批间重复性试验结果(copies/μL)6.1×106 copies /μL 6.1×105 copies /μL 6.1×104 copies /μL 6.1×103 copies /μL Ct values±SD 9.73±0.25 12.53±0.35 16.3±0.2 19.75±0.21 CV values 2.6 %2.8 %1.2 %1.1 %between groups±SD 9.69±0.18 12.57±0.23 16.18±0.19 19.84±0.26 between groups 1.9 %1.8 %1.2 %1.3 %

d total荧光定量PCR SYBR GreenⅠPCR Grand total Positive No.Negative No.Positive No.11 0 11 Negative No.1 35 36 12 35 47
3 讨 论
IBRV 可引起潜伏感染,导致患牛长期携带病毒并排毒,造成大规模的牲畜感染,对牛群育肥、产奶量和繁殖影响极大[11]。随着集约化、规模化畜牧生产的发展,建立IBRV 的群体检测方法对该病的流行病学调查、临床诊断、疫苗研制乃至疫病的防控等方面均具有重要的意义[12]。本研究建立了IBRV的SYBR Green I 荧光定量 PCR 检测方法。SYBR Green I 对双链DNA 具有高度专一性,其灵敏度要优于常规PCR[13]。随着分子生物学检测方法在临床中的应用,荧光定量PCR 技术已应用于对多种病毒的检测,该检测方法具有灵敏度高、特异性强、操作简便、快速高效的特点,能够对病毒mRNA 进行准确定量[14]。
曲光刚等2012年建立的IBRVTaqMan 荧光定量PCR 敏感性试验中检测到质粒标准品最低浓度为11 拷贝 /μL[4];陈圣军等 2013年建立的 IBRV SYBR Green I 荧光定量的检测敏感度为 360 拷贝/25μL(14.4 拷贝 /μL)[5];乔波等 2015年建立的 IBRV 的TaqMan-MGB 荧光定量PCR 检测敏感度为 14.9 拷贝 /μL[6];2017年张喜喜等建立的 IBRV 的 SYBR Green I 荧光定量PCR 与TaqMan 探针荧光定量PCR检测到最低质粒浓度为100 拷贝/μL[7]。
本实验室通过对已经报道的多个IBRV 基因序列进行比对,针对gD 基因保守区域[15],设计引物,建立了SYBR GreenⅠ检测方法。本实验用该方法所能检出的最低拷贝数为6.1×101拷贝/μL,对比其它IBRV 荧光定量检测方法和常规PCR 方法,敏感度有提高;该方法检测BVDV、BPIV3、BCoV、BEV等奶牛易感病毒均为阴性结果,表明该方法具有较强的特异性;批内、批间重复性试验的变异系数均小于3 %,表明该方法具有良好的重复性。采用建立的SYBR GreenⅠ荧光定量PCR 方法和普通PCR方法同时检测了3 个规模化牛场送检的47 份奶牛鼻拭子,SYBR GreenⅠ荧光定量PCR 方法阳性样品检出率高于普通PCR 方法,检测结果更加准确。
综上所述,本研究建立的SYBR GreenⅠ荧光定量PCR 检测方法具有特异、稳定、高效、灵敏的优点。该方法可更加快速高效检出患病牛,便于牧场对患病牛的下一步治疗处理;又可对IBRV 定量监测,为IBRV 流行病学调查、疫病诊断提供了有力的技术支持。
