魔芋葡甘聚糖-海藻酸钠复合益生菌微胶囊的构建及性能评价
2019-11-14周艳林吴影马雨浩闫佳琦王大红张红梅古绍彬
周艳林,吴影,2, 3,马雨浩,闫佳琦,王大红,2,张红梅,3,古绍彬, 2, 3*
1(河南科技大学 食品与生物工程学院,河南 洛阳,471023) 2(河南省食品微生物工程技术研究中心,河南 洛阳,471023)3(食品加工与安全国家级实验教学示范中心,河南 洛阳,471023)
益生菌被定义为在适当的情况下,对宿主健康有益的活的微生物。它们可以通过保持健康的肠道菌群,抑制病原菌生长,缓解便秘,刺激免疫系统,合成维生素和抗菌剂,提高钙的吸收,对人体产生有益的作用[1]。然而,胃的酸性条件和分泌到十二指肠的胆汁盐是细菌生存的主要障碍[2]。内源乳化法制作出的微胶囊,粒径大小能够控制,且制作过程中用到的都是无毒试剂,运用这种方法已经成功包埋乳酸菌、胰岛素等生物活性组分,因而内源乳化法可以用来制备益生菌微胶囊[3]。
魔芋葡甘聚糖是从我国魔芋块茎中提取的水溶性黏稠膳食纤维[4],是一种天然高分子多糖,具有降低胆固醇、调节肠道微生物代谢和减肥等功能[5]。CONNOLLY等[6]研究发现魔芋葡甘聚糖发酵后,双歧杆菌属、乳杆菌属等不同有益菌的菌群数量均可显著增加。CHEN等[7]研究魔芋葡甘聚糖具有益生元效应,其能够显著提高粪便中双歧杆菌和乳酸菌的含量。此外,魔芋葡甘聚糖经常作为添加剂在食品中应用。在汤、肉汁、蛋黄酱和果酱等食品中具有增稠、成胶、乳化、稳定和水结合等特性[8]。WEN等[9]以魔芋葡甘聚糖为原料,在温和条件下通过脱乙酰反应和物理交联法制备了DNA控释水凝胶。WANG等[10]以海藻酸钠、魔芋葡甘聚糖为原料,制备了缓释微球。通过红外光谱分析发现,海藻酸钠和魔芋葡甘聚糖间存在微弱氢键结合和静电相互作用,电镜照片显示微球表面形成了有助于提高对药物的包埋能力的明显凹痕。采用静电络合法制备了羧甲基魔芋葡甘聚糖-壳聚糖纳米胶囊,并将其用于L-天冬氨酸酶固定化,与天然酶相比,固定化酶表现出更好的稳定性和活性[11]。目前,有关魔芋葡甘聚糖作为壁材包埋益生菌的研究少有报道,本文重点研究魔芋葡甘聚糖作为壁材对复合益生菌进行包埋工艺条件,考察其主要性能指标,并将微胶囊灌胃小鼠,研究魔芋葡甘聚糖对小鼠主要生长性能的影响。
1 材料与方法
1.1 材料与试剂
假链状双歧杆菌、植物乳杆菌HZLp-005、干酪乳杆菌HZLc-017,实验室菌株。
ALG,天津市光复精细化工研究所; KGM(90~100万Da),合肥博美生物科技有限公司;纳米级分析纯CaCO3,上海启臣有限公司;3号胆盐、胃蛋白酶(3 000 U/mg)、胰蛋白酶(250 U/mg),Biosharp公司;BALB/C小鼠(雄性、清洁级),由河南科技大学动物实验中心提供。
1.2 仪器与设备
H1850R台式高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;HJ-3型磁力搅拌器,金坛市万华实验仪器厂;TM3030plus扫描电子显微镜,日本日立高新技术公司;LG-0.2真空冷冻干燥机,沈阳新阳速冻设备制造公司;奥林巴斯BX50显微镜,瑞戈(上海)实业有限公司;其他为实验室常用仪器和设备。
1.3 实验方法
1.3.1 菌种培养
将保存的双歧杆菌在液体MRS培养基中于37℃培养24 h,将植物乳杆菌、干酪乳杆菌在液体MRS培养基中于37℃培养18 h,并根据3%的接种量接种,连续活化传代2~3次。将活化好的种子液4 000 r/min离心10 min,用生理盐水洗涤2次,将洗涤后的菌体重悬于生理盐水中,使此浓缩菌液为109CFU/mL。
1.3.2 益生菌微胶囊的制备工艺优化
1.3.2.1 益生菌微胶囊的制备
益生菌微胶囊的制备过程如下[12]:分别称取海藻酸钠、魔芋葡甘聚糖和CaCO3粉末,缓慢加入水中,搅拌均匀,配制含海藻酸钠、魔芋葡甘聚糖和CaCO3的混合液,溶胀24 h左右;将菌悬液与配制的混合溶液按照体积比1∶3混合均匀后;加入到大豆油中(含体积分数1%的Span80),机械搅拌形成油包水液滴后,加入200 μL冰醋酸继续搅拌,然后用水(含体积分数1%的吐温80) 洗涤微胶囊,最后将收集得到的微胶囊保存于4℃冰箱中。
1.3.2.2 微胶囊制备工艺优化
通过单因素试验测定不同ALG质量分数(1%、2%、3%、4%、5%);KGM质量分数(0%、0.6%、1.2%、1.8%、2.4%);水油体积比(1∶1、1∶2、1∶3、1∶4、1∶5);CaCO3和ALG质量比(1∶1、1∶2、1∶3、1∶4、1∶5)对微胶囊包埋效果的影响。采用4因素3水平L9(34)正交试验设计,研究4个因素对微胶囊包埋率的影响。KGM-ALG微胶囊配方L9(34)正交试验设计如表1所示。

表1 正交试验因素水平表Table 1 Factor levels of orthogonal test
1.3.3 微胶囊包埋产率的测定
微胶囊包埋率的测定[13]:将1 g微胶囊加入到9 mL磷酸盐缓冲溶液中,在摇床中于37℃、230 r/min摇晃30 min,取样,进行活菌计数。同时,计算最初添加的活菌数。益生菌包埋率(embedding rate,EY)可表示为公式(1):
(1)
式中:m0,起始添加的活菌数,CFU/mL;m2,微胶囊中包埋的活菌数,CFU/mL。
1.3.4 微胶囊的形态观察及粒径的分析
用玻璃棒沾取微胶囊的分散溶液1滴,置于载玻片上,用光学显微镜进行形态观察。用测微尺测定胶囊的粒径,计数 100个以上,取平均值。通过扫描电子显微镜观察微胶囊冷冻干燥后的结构。
1.3.5 微胶囊耐受性
1.3.5.1 微胶囊对模拟胃液的耐受试验
取1 g微胶囊置于9 mL胃液中,于37℃、 230 r/min分别处理0、30、60、90、120 min后取样计数;未包封的菌为对照。
1.3.5.2 微胶囊在模拟肠液中的释放试验
取1 g微胶囊置于9 mL肠液中,于37 ℃、230 r/min分别处理0、30、60、90、120 min后取样计数。
1.3.5.3 微胶囊在模拟连续的胃肠道试验
取1 g微胶囊置于9 mL胃液[14]中,于37℃、230 r/min条件下处理60 min后取样进行活菌计数,离心收集微胶囊后加入胆盐溶液,30 min后取样进行活菌计数,离心,用生理盐水洗涤后加入肠液,振荡处理60 min后取样计数;未包封的菌为对照。
1.3.6 微胶囊壁材对小鼠的影响
1.3.6.1 试验设计
将小鼠随机分为3组,每组10只,分别作为对照组(灌胃生理盐水)、ALG组、ALG+KGM组,每只小鼠下午4时灌胃,对照组灌胃0.2 mL生理盐水,ALG组灌胃0.2 mL混匀的ALG微胶囊溶液,ALG+KGM组灌胃0.2 mL混匀的ALG+KGM微胶囊溶液,微胶囊质量浓度为1 g/mL,每天1次,试验持续6周,监测小鼠的死亡症状、体重变化、行为异常等情况。
1.3.6.2 血清生化指标分析
颈椎脱臼法致死小鼠后,主动脉取血,3 000 r/min离心6 min,分离得到小鼠血清并用全自动生化分析仪分析小鼠血清各个生化指标,其原理及实验步骤根据试剂盒所带说明书进行。
1.3.6.3 肝脏、肾脏组织切片染色
小鼠处死后,立即将肝脏、肾脏用10%(体积分数)甲醛溶液固定,固定好后,切成小块,放入包埋笼中进行冲洗、脱水、包埋、切片、烤片、染色(苏木精染色10 min,用蒸馏水返蓝5~15 min,用伊红染液进行细胞质的染色),中性树胶封片后,晾干镜检。
1.3.6.4 肠道微生物多样性测定
小鼠肠道微生物多样性测定送检至美吉生物科技有限公司进行测序分析。高通量测序是在Illumina MiSeq平台上测序完成。然后根据OTU分析结果,通过使用在线平台软件,对样本进行物种注释和多样性进行分析。
1.4 数据统计分析
利用Oringin统计分析软件分析和处理,每个实验重复3次,最后用3个独立实验均值±标准差(SD)表示,各组数据间的差异用SPSS 19.0 软件进行Duncan’s多重比较分析,当P<0.05时视为差异显著。
2 结果与分析
2.1 益生菌微胶囊的制备
2.1.1 KGM质量分数对包埋率的影响
KGM质量分数对包埋率的影响如图1所示。从图中可看出,当KGM质量分数为0.6%时,微胶囊包埋率最大,随着KGM质量分数的增加,微胶囊的包埋率增加,这可能是KGM的添加,使海藻酸钠凝胶孔隙变小,可有效提高微胶囊对益生菌的保护作用;由于KGM其本身黏度较大,随着其质量分数的增大,使要包埋的菌体分散较为困难,进而引起包埋率降低。赵萌等[15]用海藻酸钠和魔芋葡甘聚糖复配可提高微胶囊对益生菌的包埋率,并研究了魔芋葡甘聚糖分子质量对包埋率的影响,结果发现,中等分子质量的魔芋葡甘聚糖在机械强度、包埋率等均优于海藻酸钠微胶囊,且魔芋葡甘聚糖分子质量增大时,包埋率也会提高。

图1 魔芋葡甘聚糖质量分数对微胶囊包埋率的影响Fig.1 Effect of konjac glucomannan concentrationon the encapsulation efficiency of microcapsules注:不同小写字母表示差异显著,(P<0.05)。下同。
2.1.2 ALG质量分数对包埋率的影响
ALG质量分数对包埋率的影响如图2所示。从图中可以看出,微胶囊的包埋率随ALG质量分数增加而增加,当ALG质量分数为3%时,微胶囊包埋率最大,当ALG质量分数不断增加时,微胶囊包埋率降低。这主要由于当ALG的质量分数增高时,溶液黏度增大,益生菌不易分散;当ALG质量分数低时,形成的凝胶颗粒小,机械强度低,不能有效包埋菌体,影响包埋效果。当海藻酸钠质量分数从2%增大到4%时,微胶囊粒径变大,这主要是由于溶液黏度增大,在搅拌时不利于乳化。ZHAO等[16]通过压缩试验和动态振荡流变学结果均表明,海藻酸钠质量分数较高的微胶囊具有较高的力学强度。其原因可能是海藻酸钠质量分数增加导致固相体积分数和交联密度的增加,从而使微胶囊具有更高的硬度[17-18]。具有较高质量分数的碳酸钙微胶囊也有类似的趋势。这可能是由于较高的质量分数浓度提供了更多的Ca2+和海藻酸根交联。

图2 海藻酸钠质量分数对微胶囊包埋率的影响Fig.2 Effect of sodium alginate concentration onthe encapsulation efficiency of microcapsules
2.1.3 水油体积比对包埋率的影响
水油体积比对包埋率的影响如图3所示。从图中可以看出,油相不足时,包埋率较低,可能是由于乳化剂的含量较少,微胶囊的含量较高,在搅拌的过程中颗粒之间相互挤压,使得微胶囊颗粒不易成型;水油体积比变小时,油相体积充足,分散空间比较宽松,壁材可以充分乳化并分散,形成微胶囊的粒径比较均匀,有利于微胶囊包埋率的提高,通过显微镜可以观察到微胶囊粒径较小,经过搅拌、离心以及洗涤等机械作用下,微胶囊极易破裂,最终导致包埋率较低[19]。

图3 水油体积比对微胶囊包埋率的影响Fig.3 Effect of water phase and oil phase volumeratio on the encapsulation efficiency of microcapsules
2.1.4 CaCO3与ALG质量比对包埋率的影响
CaCO3与ALG质量比对包埋率的影响如图4所示。从图中可以看出,随着CaCO3添加量的增加,微胶囊包埋率增加,当CaCO3与ALG质量比>1∶2时,虽然包埋率较高,但形成的颗粒粒径较大,呈球性差;当碳酸钙与ALG质量比<1∶5时,微胶囊包埋率降低,交联剂浓度降低,颗粒不易成型,包埋率降低。SILVA等[20]用内源乳化法将重组人胰岛素包埋在海藻酸钠中,考察了工艺参数对胰岛素的形态和包封率的影响,发现CaCO3的浓度对胰岛素的包埋率有显著影响。SULTANA等[21]测定了不同浓度的海藻酸钠和钡盐对微胶囊包埋率的影响,包埋率随着聚合物浓度的增加而显著提高,这可能是由于在聚合链中有更多的活性钡结合位点,因此,随着海藻酸钠含量的增加,交联程度也会提高。LEE等[22]证明了这一现象,即随着海藻酸钠浓度的增加可能获得更高的载药量,增加交联剂的浓度也会增加载药量。这可能是由于随着钡离子的增加,凝胶强度也随之增加,聚合物的交联性和形成的凝胶的致密性也提高了。这些结果与TAKKA等[23]和MIRGHANI等[24]的报道相一致。

图4 碳酸钙与海藻酸钠质量比对微胶囊包埋率的影响Fig.4 The influence of the mass ratio of CaCO3 to sodium alginate on the encapsulation efficiency of microcapsules
2.1.5 微胶囊最佳配方的确定
通过测定微胶囊的包埋率,进行最佳配方筛选。以包埋率为试验指标,极差越大表明该因素对指标影响的因素越大。由表2可知,4种因素对包埋率影响大小依次为:C(水油体积比)>D(CaCO3与ALG质量比)>B(KGM质量分数)>A(ALG质量分数)。因此,A2B1C2D1为最佳组合。但该组合未在试验之列,故需作进一步验证工作。
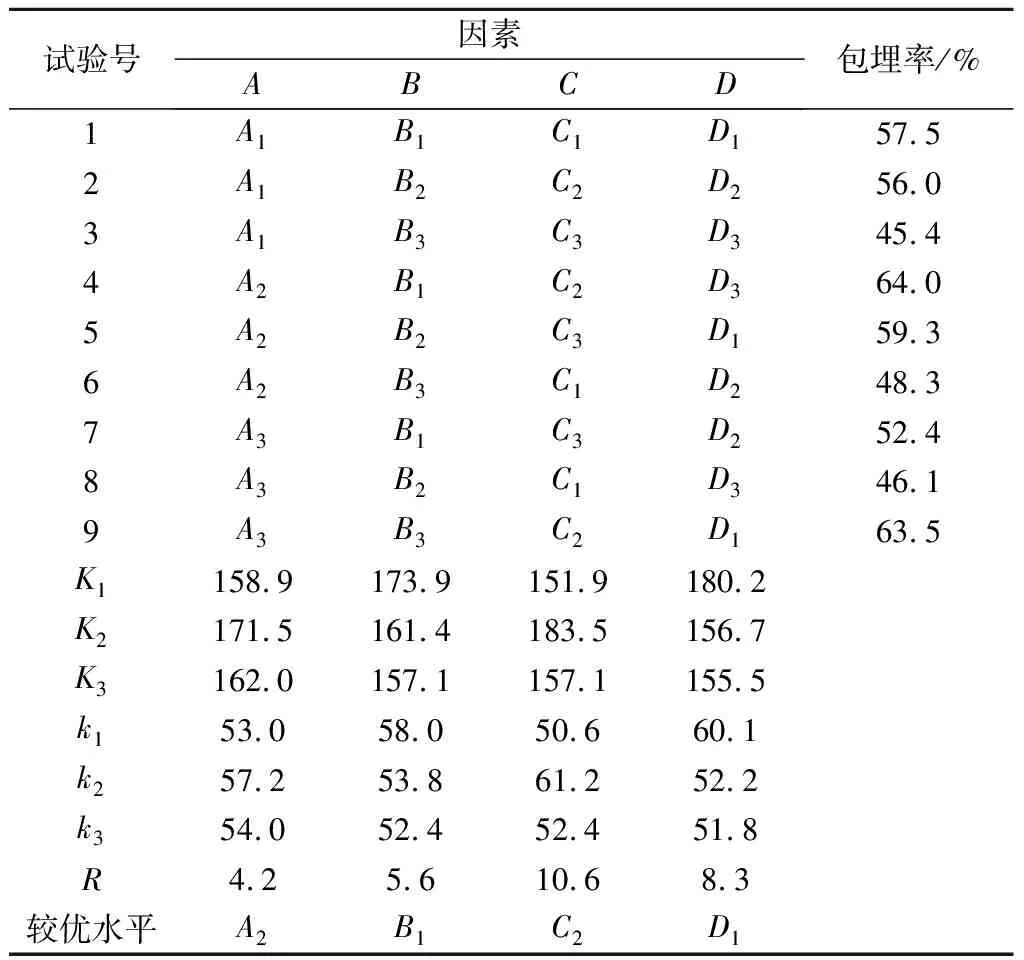
表2 微胶囊配方筛选L9(34) 正交试验Table 2 The orthogonal experiment L9(34) result of screening microencapsulation
最佳配方的验证试验表明,A2B1C2D1组合的包埋率较高,达到(76.2±5.1)%,经检验A2B1C2D1的包封率显著高于其他组(P<0.05)。且微胶囊呈球性好,粒径较小。因此,选择A2B1C2D1组合的微胶囊做后续试验。以包埋率为指标,则ALG的质量分数为3%,KGM的质量分数为0.6%,水油体积比1∶3, CaCO3与ALG的质量比1∶3,为制备微胶囊的最佳配方。
2.1.6 微胶囊的微观结构
通过光学显微镜和扫描电子显微镜观察新制备和冷冻干燥的微胶囊,结果如图5、图6所示。由图可知,复合益生菌微胶囊具有一个光滑的表面和良好的分散性的规则球形结构,平均粒径为(352.6±9.5)μm。微胶囊经冷冻干燥后,呈蜂窝状,表面褶皱,凹陷,仍维持球形外观,这是冷冻干燥常有的现象。微胶囊结构致密,是由于在冰醋酸的作用下,Ca2+释放与海藻酸钠形成致密的凝胶网络结构。CHEN等[25]通过冷冻干燥显著保留了益生菌的活性。扫描电镜图像证实了冻干后微胶囊的形貌得到了较好的保存,微胶囊适用于严酷的加工或消化条件,HOMAYOUNI等[26]认为,微胶囊化主要是为了保护冰淇淋中的益生菌在加工过程中不受氧毒性和机械压力的影响,从而保证了冰淇淋中益生菌的存活。
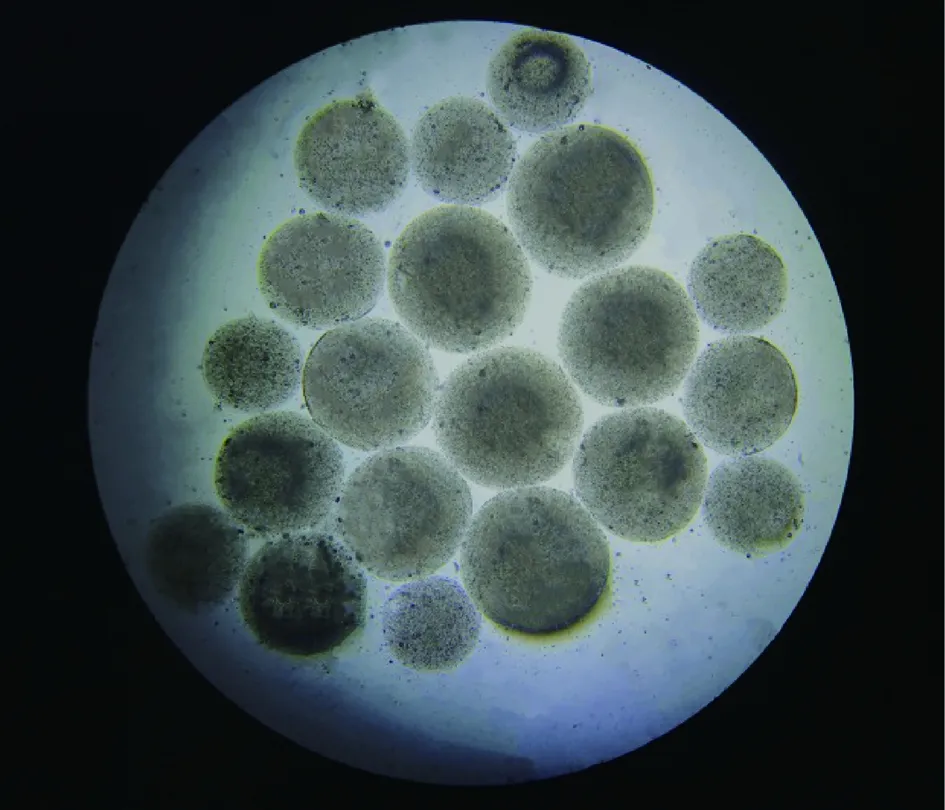
图5 光学显微镜下微胶囊形态图Fig.5 Morphology of microcapsules under optical microscope

a-放大80倍;b-放大200倍图6 微胶囊扫描电子显微镜图Fig.6 Scanning electron microscopy images of microcapsules
2.1.7 微胶囊模拟胃液中的耐受性
益生菌在模拟胃液中的存活率是确保菌体通过胃部定植肠道中发挥益生功能的保障。由图7可知,自由菌在模拟胃液中的存活率非常低,60 min后的存活率为(41.32±2.5)%,经过120 min后,检测不到活菌。微胶囊组在模拟胃液处理120 min后益生菌存活率仍为(45.65±5.0)%。结果表明,微胶囊可提高益生菌在酸性环境中的存活率。这可能是由于微胶囊结构致密,孔径较少,机械强度高,能较好地抵御胃液渗透,从而可以提高益生菌的存活率。微胶囊在水相中的收缩行为决定了外部溶液对内部包封剂的影响。微胶囊在胃液中收缩的潜在机制较复杂,可能的解释有:(1)微胶囊在胃液中收缩,是由于渗透压改变;(2)在酸性条件下,海藻酸链羧基质子化,由于静电斥力减弱,导致海藻酸钠收缩[16]。KRASAEKOOPT等[27]研究表明,只有微囊化的益生菌才能在胃肠道条件下维持生存,以海藻酸钠为壁材的益生菌微胶囊已经被证明可以提高益生菌在模拟胃条件下的生存能力。DE CASTROCISLAGHI等[28]研究了在pH值3.0和2.0条件下,自由菌和微胶囊化双歧杆菌的存活率,在pH值为3.0时,自由菌和微胶囊化双歧杆菌的存活率没有显著差异。然而,在pH值为2.0时,自由菌比微胶囊化双歧杆菌存活率下降的更大。

图7 模拟胃液中益生菌的存活率Fig.7 The survival rate of probiotics in simulatedgastric juice
2.1.8 微胶囊在模拟肠液中的释放试验


图8 微胶囊化益生菌在模拟肠液中的释放曲线Fig.8 Release of microspheres containing probioticsin simulated intestinal juice
2.1.9 微胶囊在模拟连续的胃肠道试验
益生菌要对人体发挥其益生作用,除能抵抗胃酸的环境外,还需在到达肠道时保持一定存活量。由表3可知,自由菌在模拟肠液中处理60 min后,未检测到活菌。而微胶囊化的益生菌活菌数仍达到(7.57±0.05) lg CFU/g,说明微胶囊既能抵抗胃酸的环境,还对胆盐有一定的耐受性。在肠液中微胶囊化益生菌存活率低于胃液中,这主要是由于微胶囊在胃液和肠液中溶胀性不同。在胃液中,微胶囊收缩的原因可能有两方面:一是形成的海藻酸钙凝胶是耐酸性多聚物,在酸性的环境下也能够使其较完整;另一方面,它可能是存在于胃液中的H+进一步促进凝胶网络形成微胶囊[29],有效防止H+进入微胶囊中损害益生菌;在模拟的肠液中,微胶囊溶胀的原因可能为海藻酸钙的凝胶网络结构很难在中性环境下维持,溶液的渗透压使微胶囊迅速吸收和溶胀,从而导致微胶囊的结构损坏;此外,由于磷酸根的存在,导致微胶囊瓦解,因此,不能有效保护益生菌。图9为微胶囊在模拟胃肠道中的形态图。
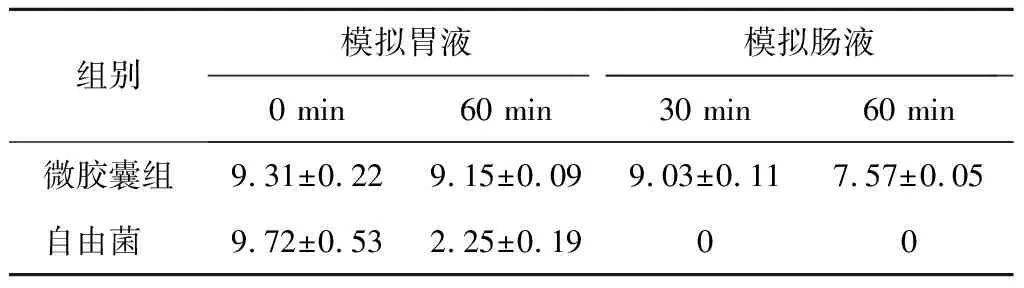
表3 模拟连续的胃肠道中益生菌存活量 单位:lgCFU/g

a-新鲜微胶囊;b-胃液浸没120 min后的微胶囊;c-肠液浸没60 min后的微胶囊图9 光学显微镜下微胶囊形态图Fig.9 Optical images of microscopes
2.2 微胶囊对小鼠生长性能的影响
2.2.1 微胶囊的安全性评价
内源乳化法制备的微胶囊灌胃小鼠进行实验,将小鼠喂养6周,在此期间,小鼠的体重增长正常,且各组期间均无死亡。精神状态、体毛、饮食、排便状况均无异常,经过解剖小鼠,肉眼观察小鼠心、肝、脾、肺、肾、肠等脏器,与对照相比,均未出现异常变化。表明制备的微胶囊不存在安全隐患,使用安全。
2.2.2 小鼠体重增加量和饲料利用效率
小鼠喂养6周后,各组小鼠的体重变化如图10-a所示,小鼠的体重总体呈增加趋势,各组相比均无显著性差异(P>0.05)。由图10-a可知,试验组小鼠体重增加量明显高于对照组,表明微胶囊对小鼠体重增加有一定影响。小鼠的饲料利用效率如图10-b所示,ALG组和ALG+KGM组的饲料利用效率高于对照组,但3组之间均无显著性差异[30](P>0.05)。

a-体重增加量;b-饲料利用率图10 各组小鼠体重增加量和饲料利用效率Fig.10 Weight gain and feed efficiency in each group of mice
2.2.3 血清生化指标检测
通过血清指标检测,可有效判断小鼠各组组织器官的病变情况。由表4可知,各组小鼠ALT、HDL-C、AST、TG、TC-C、TP、ALB与对照组相比均无统计学差异(P>0.05)。各组血清指标检测正常,表明微胶囊对小鼠各组器官无影响。测定酶活性是反映脏器损害最敏感的指标之一,在一定的范围内,能够定量评价脏器损伤的程度。酶活性的改变,通常出现在形态学改变之前,所以测定脏器酶活性的变化,能够看出药物对脏器的损害程度。丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)是检测肝细胞损伤的传统指标。由表中可看出,试验各组的酶活力与对照组相比较差异无统计学意义(P>0.05)。表明微胶囊对小鼠的肝脏、肾脏功能没有影响。

表4 各组小鼠血清生化指标Table 4 Effect of CV on the levels of serum biochemical parameter in mice
2.2.4 肝脏、肾脏组织病理学观察
小鼠肝脏、肾脏染色及显微镜观察显示,各组小鼠肝脏、肾脏均未见异常改变如图11、图12所示。镜下可见肝细胞无肿胀,边界清楚,肝小叶边界清晰,血窦内无充血,亦无异常细胞出现。肾脏皮质区可见肾小体毛细血管无异常改变,管壁细胞无肿胀,球囊界限清晰。综上所述,肝脏、肾脏均无任何特异性病理改变。

a-对照组;b-ALG;c-ALG+KGM图11 各组肝脏组织病理切片图Fig.11 Histological section of liver in each group of mice

a-对照组;b-ALG;c-ALG+KGM图12 各组肾脏组织病理切片图Fig.12 Histological section of kidney in each group of mice
2.2.5 微胶囊对小鼠肠道菌群的影响
小鼠肠道菌群门水平上相对丰度如图13所示,拟杆菌门和厚壁菌门是3组中占主导地位的2个菌门,平均占总序列的90%以上。由图13-b可知,灌胃KGM后,乳杆菌科的相对丰度升高,脱铁杆菌科、脱硫弧菌科等有害菌的相对丰度降低,说明魔芋葡甘聚糖能够促进有益菌的生长,抑制有害菌,进一步证实魔芋葡甘聚糖确实具有显著的肠道益生作用,有助于促进肠道健康。

a-门水平上的相对丰度;b-科水平上的相对丰度图13 小鼠肠道菌群相对丰度Fig.13 Relative abundance of intestinal flora in mice注:1,对照组;2,ALG组;3,ALG+KGM组
3 结论
以包埋率为指标,通过优化制备条件,在质量分数为3%的海藻酸钠、质量分数为0.6%的魔芋葡甘聚糖、水油体积比为1∶3、CaCO3与ALG质量比为 1∶3的条件下,制得微胶囊的包埋率为(76.2±5.1)%。经过包埋后的益生菌在模拟胃液中处理120 min后存活率仍为(45.65±5.0)%,表明微胶囊具有良好的耐酸性。微胶囊在肠道中具有良好的释放性,在肠液中处理60 min后,活菌数达到(2.24±0.98)×109CFU/g。在模拟连续的胃肠道试验中,微胶囊化的益生菌的活菌数仍能达到(3.72±0.41)×107CFU/g,说明微胶囊不仅能够提高益生菌在胃液中的存活率,还能够增强微胶囊对胆盐的耐受性。通过血清生化指标,组织病理切片,证明该材料对小鼠无毒性,可安全使用。将含有KGM的微胶囊灌胃小鼠,发现魔芋葡甘聚糖具有一定益生作用。
本文研究结果不仅为益生菌微胶囊的工艺优化提供了理论和实践依据,且为魔芋葡甘聚糖作为壁材使用及利用其益生作用奠定了基础。
