浓香型白酒酒醅风味物质和微生物菌群结构随发酵时间的变化规律
2019-11-14高江婧任聪刘国英葛向阳王慧琳叶方平徐岩
高江婧,任聪,刘国英,葛向阳,王慧琳,叶方平,徐岩*
1(江南大学 生物工程学院,酿造微生物学与应用酶学研究室,江苏 无锡,214122) 2(安徽古井贡酒股份有限公司,安徽 亳州,236820) 3(教育部工业生物技术重点实验室(江南大学),江苏 无锡,214122)
在浓香型白酒酿造生产实践中,通常采用“双轮底发酵工艺”来提高酒质,双轮底糟发酵实质是延长发酵期的一种工艺方法[1-2]。受夏季气温过高因素的影响,酒醅发酵温度较难控制,很多名优酒厂采取暂停生产措施以安全度夏,这势必会造成酒醅发酵周期的延长。而长期的生产经验表明,延长酒醅发酵时间后,所酿造出的浓香型原酒品质更佳。
近年来,国内学者逐步重视对浓香型白酒酒醅中的微生物菌群演替规律进行解析。多数研究表明,在发酵过程中,酒醅中的乳酸菌成为绝对优势菌群,乳酸菌在发酵初期快速繁殖,发酵中后期相对丰度呈缓慢上升趋势[3-5];刘凡等[6]通过宏基因组测序解析了浓香型白酒发酵过程中的微生物与主要有机酸合成的关系,发现窖内发酵初期(0~14 d)与主要有机酸(乳酸、乙酸、丁酸和己酸)合成相关的微生物数量显著高于发酵后期(15~60 d)。上述有关酒醅微生物菌群的研究均针对的是2个月的常用发酵周期,尚未揭示出延长发酵时间后窖内酒醅微生物菌群和风味物质的变化规律。
窖泥在浓香型白酒生产中占据重要地位,随着测序技术的快速发展,目前对窖泥的微生物菌群结构认识逐步清晰,研究发现地域、窖龄、窖内分布位置、窖泥质量均对窖泥微生物菌群结构具有较大的影响,如新窖泥以乳杆菌为主,而老窖泥以梭菌纲、拟杆菌纲和产甲烷菌为主[7-12]。王雪山等[13]分析了浓香型酒醅微生物的来源,发现大曲是酒醅中好氧和兼性厌氧菌的主要来源(占比74%),而窖泥是酒醅厌氧菌群的主要来源(占比14%),但窖泥微生物菌群对酒醅微生物菌动态变化的影响却鲜有研究。另一方面,浓香型白酒发酵窖池深达2 m,对发酵过程酒醅取样,尤其是对底层酒醅取样困难,发酵后期较多的黄水也对酒醅取样造成困难,目前尚缺少对浓香型白酒发酵窖池底层酒醅中微生物与风味物质产生动态规律的长发酵周期追踪研究。本文跟踪了发酵周期长达5个月的窖池,并重点关注了窖池下层酒醅中的主要风味物质和微生物菌群的变化规律,为解析延长发酵时间与原酒品质关系提供基础数据支撑。
1 材料与方法
1.1 材料
在浓香型白酒酿造车间,选取正常生产班组的2口老窖池,窖龄均为27年。采用自制酒醅取样器分别取样不同发酵时间点的酒醅样本,连续跟踪取样直至156 d发酵结束。本文取样的酒醅样本均为窖池下部的酒醅。发酵结束后,采用五点取样法取窖泥100 g并混合均匀。酒醅和窖泥样本均冻存于-20℃冰箱待用。
1.2 主要试剂
己酸乙酯、乳酸乙酯、乙酸、乳酸、丁酸、己酸、叔戊醇、乙酸正戊酯和2-乙基丁酸等标准品(色谱纯):购于美国Sigma-Aldrich试剂公司;无水乙醇(色谱纯):购于上海安谱公司;DNA提取试剂盒:购于美国Qiagen公司。
1.3 挥发性组分分析
称取酒醅(窖泥)样本10 g,加入60%的无水乙醇20 mL涡旋混匀,浸提30 min后,10 000 r/min离心10 min,取上清液过膜,并加入混合内标(叔戊醇、乙酸正戊酯和2-乙基丁酸)后进行气相色谱分析。色谱柱为CP-wax57CB毛细管柱(50m×0.25mm×0.25μm),气相进样口温度为230℃,检测器温度为230℃,载气为高纯氮,流速为1.0 mL/min,进样量为1 μL,分流比为30∶1。程序升温条件为:初始温度35℃,保持0 min,以4 ℃/min升到60℃,保持4 min,再以6 ℃/min升到195 ℃,保持20 min。
1.4 乳酸分析
酒醅(窖泥)样本用超纯水浸泡离心,并经适当稀释后,采用超高效液相色谱法[14]测试上清液的乳酸含量。色谱柱为Waters Acquity UPLC HSS T3(100 mm×2.1 mm×1.8 μm),流动相为0.02 mol/L KH2PO4,流速为0.1 mL/min,进样量为1 μL,二极管阵列检测器,检测波长为208 nm。
1.5 酒醅和窖泥微生物DNA的提取
对于酒醅样本,采用灭菌的PBS缓冲液多次提取酒醅中的微生物细胞,以去除杂质,收集细胞沉淀,然后采用DNeasy UltraClean Microbial Kit提取酒醅微生物总基因组DNA。窖泥微生物总基因组DNA利用DNeasy Power-Soil Kit进行提取,提取方法按照试剂公司提供的实验操作指南进行。利用琼脂糖电泳对提取的微生物DNA进行质量检测,合格后进行建库、测序。
1.6 高通量测序与数据分析
建库与测序由上海美吉生物技术有限公司完成。高通量测序针对细菌16S rRNA基因V3-V4区域,扩增引物为338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和 806R(5′-GGACTACHVGGGTWTCTAAT -3′)。测序平台为Illumina MiSeq。测序原始序列采用FLASH和Trimmomatic软件进行拼接及质控过滤,序列的质检标准为:(1)去除序列尾部质量值20以下的碱基,去除质控后50 bp以下的序列;(2)引物最大错配数为2,barcode允许的错配数为0,去除模糊碱基;(3)最小overlap序列长度为10 bp,且拼接序列的overlap区允许最大错配比率为0.2。采用Uchime软件去除嵌合体序列。使用Usearch(vsesion 7.0 http://drive5.com/uparse/)将序列按照97%相似度聚类,进行OTU(operational taxonomic units,操作分类单元)划分,提取代表序列,得到OTU表。将细菌OTU代表序列与Silva(Release132,http://www.arb-silva.de)数据库比对,进行分类学注释。细菌菌群热图(heatmap)和冗余分析(redundancy analysis,RDA)通过R语言(vegan包)分析。
2 结果与分析
2.1 酒醅主要风味物质随发酵时间的变化趋势
在浓香型白酒生产过程中,靠近窖池底部的下层酒醅质量最佳,一般用于生产优质浓香型原酒。对窖池下层酒醅的4种主要有机酸进行测试分析,结果表明乳酸含量在总酸中占有绝对优势(>85%),其次是乙酸、己酸和丁酸。在整个156 d长的发酵周期内,乳酸含量在发酵初期0 ~14 d快速增加,之后乳酸含量增速变缓,在发酵120 d后乳酸含量有略微下降的趋势(图1-A)。乙酸则在发酵初期0~21 d快速增加,之后略有缓慢增加趋势。而丁酸和己酸的含量在发酵50 d后持续增加,直至发酵结束(图1-B)。由此可知,对于较短的发酵周期(60 d以内),酒醅中的丁酸、己酸并未大量积累,这与相关文献的报道基本一致[6]。
与此同时,酒醅中的乳酸乙酯和乙酸乙酯两种风味组分与乳酸、乙酸的变化趋势基本一致,在发酵初期,乳酸乙酯和乙酸乙酯呈现显著增加趋势,20 d后则逐渐趋于平稳,而酒醅中己酸乙酯的含量则在长期发酵的后期迅速增加(图1-C),表明在浓香型白酒酿造工艺中,延长发酵周期,可以显著提高酒醅中己酸乙酯的含量。己酸乙酯含量的提高,相应提高了己酸乙酯与乙酸乙酯的比值,因而延长发酵时间,也有利于促进白酒中酯类物质的平衡。
2.2 酒醅原核微生物随发酵时间的变化趋势
为进一步认识窖池下层酒醅在长期发酵过程中的微生物变化规律,对不同发酵时间的酒醅细菌菌群结构进行分析。酒醅16S rRNA基因测序表明,酒醅中的细菌主要以芽孢杆菌纲的乳杆菌科(Lactobacillaceae)为主,乳杆菌在整个发酵过程中占有绝对优势,因而乳杆菌的代谢产物乳酸在总酸中也占有绝对优势。在发酵14 d时,乳杆菌科的相对丰度达到99%以上,这与发酵初期酒醅中的乳酸含量急剧增长相对应,表明乳杆菌科在发酵初期即大量繁殖,代谢产生高含量的乳酸。但随着发酵时间的延长,乳杆菌科的相对丰度逐渐下降至85%左右(图2)。相反,梭菌纲微生物的相对丰度则逐渐增加至8.94%。
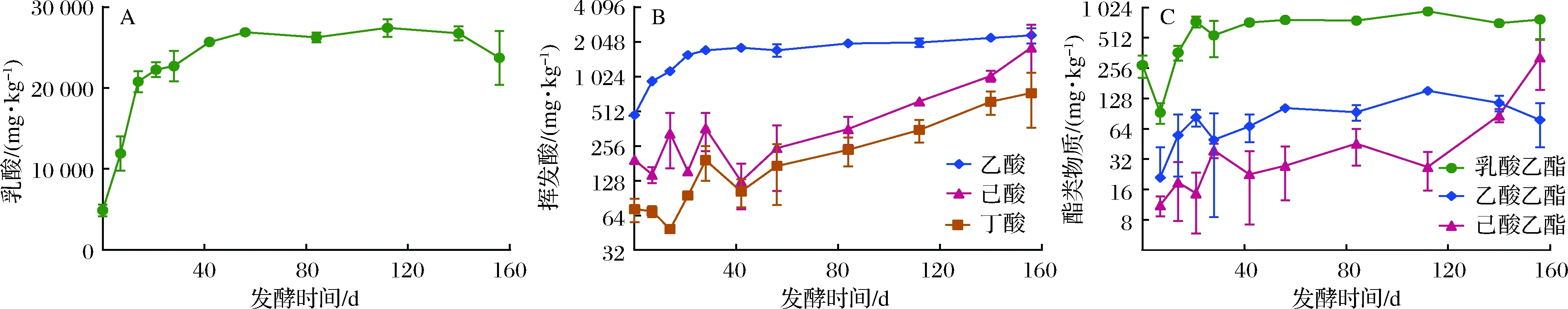
A-乳酸;B-挥发酸;C-酯类物质图1 酒醅发酵过程中主要风味物质含量变化Fig.1 Dynamics of key flavor compounds in fermented grains during fermentation

A-纲水平;B-科水平图2 酒醅细菌菌群随发酵时间变化规律Fig.2 Dynamic of bacterial community in fermented grains during fermentation注:图中数据为相同发酵时间点酒醅样本测序结果的平均值。下同。
由于乳杆菌科在整个发酵过程中占有绝对优势,其相对丰度均大于80%,当扣除乳杆菌科后,可观测到酒醅中梭菌纲微生物的相对丰度随发酵时间的延长呈现出显著递增趋势。在科水平上,梭菌纲的瘤胃菌科(Ruminococcaceae)和梭菌科(Clostridiaceae_1)的相对丰度随发酵时间的延长显著增加。除乳杆菌科的相对丰度随发酵时间延长下降外,r-变形菌纲的肠杆菌科(Enterobacteriaceae)也随发酵时间的延长而显著降低(图3)。
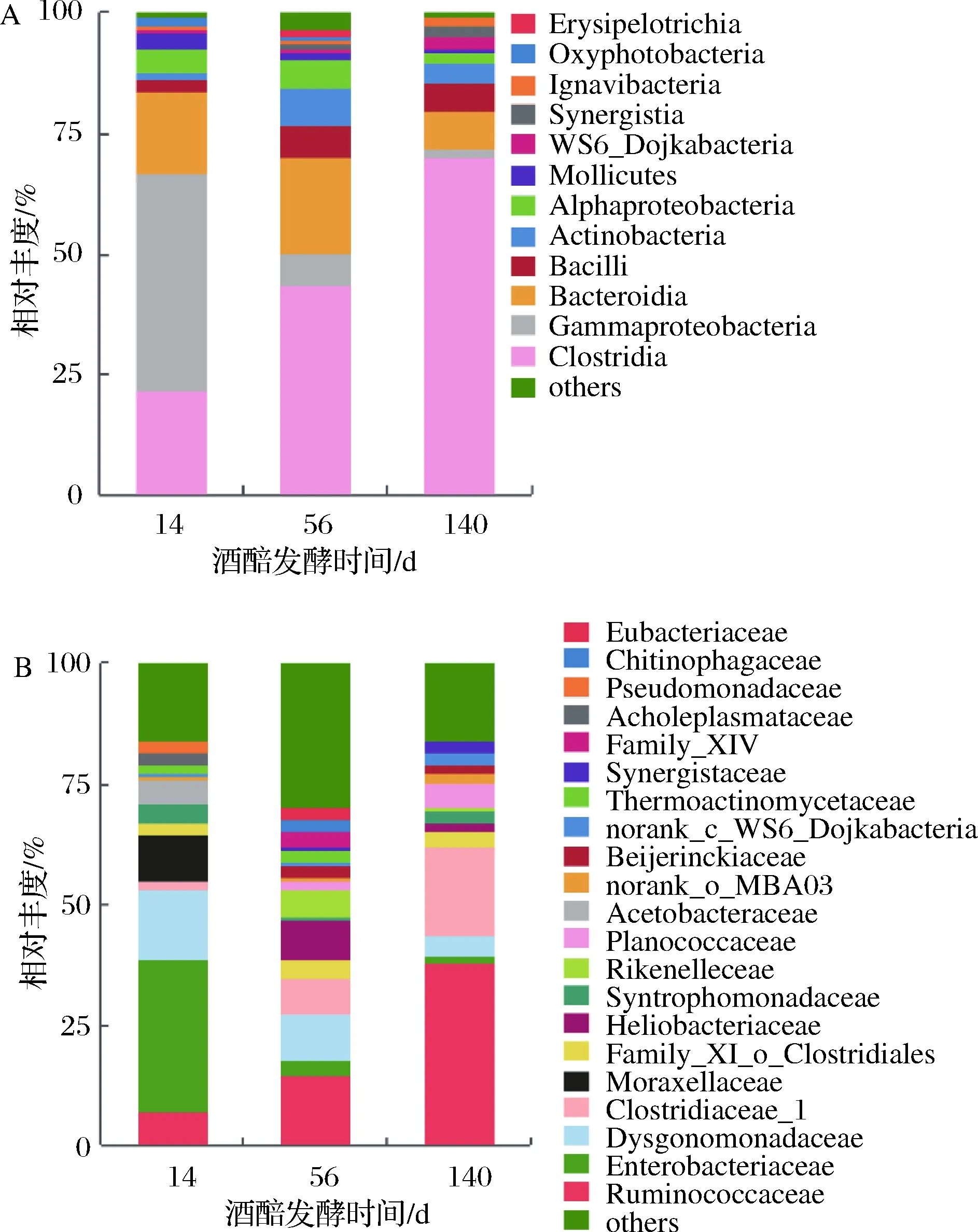
A-纲水平;B-科水平图3 酒醅扣除乳杆菌科后的细菌菌群随发酵时间变化规律Fig.3 Dynamic of bacterial community expect for Lactobacillaceae in fermented grains during fermentation
2.3 不同发酵时间酒醅微生物与窖泥微生物的相关性
由于窖泥是酒醅厌氧微生物菌群的重要来源,王雪山等通过微生物来源(SourceTracker)分析酒醅微生物的来源,发现窖泥来源厌氧菌占到酒醅原核菌群的14%[13]。将不同发酵时间的酒醅微生物与窖泥微生物的种类分别进行比较,发现随着发酵时间的延长,酒醅与窖泥中检测到的共有微生物种类逐渐增多,在科水平上,从发酵14 d的28个共有微生物增加至140 d的82个共有微生物(图4)。
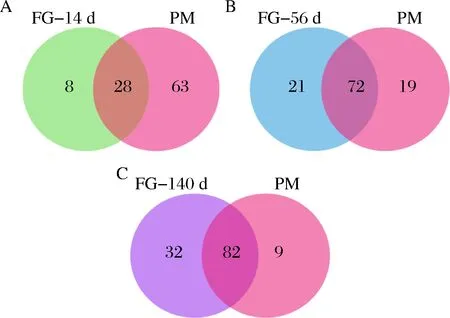
A-发酵14 d;B-发酵56 d;C-发酵140 d图4 不同发酵时间酒醅与窖泥共有微生物(科水平)比较分析Fig.4 Comparison of communal microorganisms (at family level) between pit mud and fermentedgrains at different fermentation time注:FG-14d表示发酵14 d的酒醅;FG-56d表示发酵56 d的酒醅;FG-140 d表示发酵140 d的酒醅;PM表示窖泥。下同。
通过比较窖泥和不同发酵时间酒醅的微生物差异,进一步发现,随发酵时间在酒醅中相对丰度逐渐升高的微生物,如瘤胃菌科(Ruminococcaceae)、Dysgonomonadaceae、梭菌科(Clostridiaceae_1),这些微生物也是窖泥中的高丰度微生物,它们在窖泥中的平均相对丰度分别为24.79%、22.35%、13.01%(图5)。表明在长期发酵过程中,窖泥为酒醅持续不断提供其主体的厌氧微生物菌群。值得说明的是,瘤胃菌只是细菌分类学名称,最初命名源于从牛瘤胃中发现的能产生丁酸的某种新类型厌氧菌,而窖泥中的瘤胃菌属于该科下的新成员,与定义该科源自于瘤胃的细菌并不是同属细菌,它们只是在科水平上的亲缘关系上较为接近。
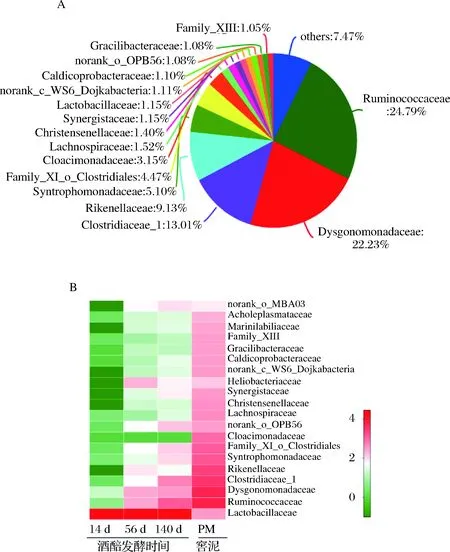
A-菌群结构;B-变化规律图5 窖泥菌群结构和对应的酒醅菌群随发酵时间变化规律Fig.5 The bacterial community of pit mud and dynamic of bacterial community in fermented grains during long-termfermentation注:数据为样本测序结果的平均值,菌群为科水平。
此外,窖泥中平均相对丰度较高的一些微生物,如Rikenellaceae (9.13%)和Cloacimonadaceae(3.15%),它们在酒醅中的相对丰度并未同比例增加,后者甚至在酒醅中检测不到;而窖泥中平均相对丰度较低的Heliobacteriaceae(0.47%)在酒醅中的相对丰度却较高。虽然窖池下部酒醅在发酵过程中呈现半固态(由于原料水解和微生物的代谢活动,酒醅中的水分含量较高),窖泥微生物可以通过迁移或扩散进入酒醅,但本文研究结果表明,从窖泥迁移至酒醅中的微生物并非是同比例增加的,酒醅的高酸高醇环境也可能影响窖泥微生物向酒醅的迁移速率和生长代谢。而与此相对的是,酒醅中虽富含有80%以上高丰度的乳杆菌,但其在窖泥中的相对丰度却仅有1%左右,表明即使在长期的发酵过程中,酒醅中占有绝对优势的乳杆菌并未能大量入侵到窖泥微生物体系中,正常窖泥微生物菌群具有较好的鲁棒性,能够抵抗酒醅中乳酸菌的入侵。
2.4 风味物质与微生物的相关性分析
上述分析比较了不同发酵时间酒醅和发酵终点窖泥细菌菌群结构的差异,发现随发酵时间的延长,相对丰度逐渐增高的物种亦是窖泥中的主体功能菌群。为进一步分析这些微生物与发酵过程中的风味物质生成是否相关,我们进行了冗余分析(RDA)(图6)。结果表明,乳杆菌科的相对丰度与乳酸含量呈强正相关,而丁酸、乙酸、己酸含量则与梭菌科、瘤胃菌科、Dysgonomondaceae的相对含量呈现正相关关系。因此,推测这些微生物对发酵后期己酸、丁酸、乙酸的合成具有重要贡献。
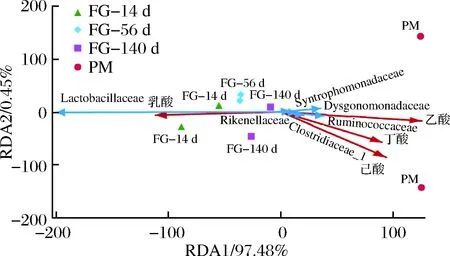
图6 微生物与风味物质相关性分析Fig.6 Correlation between microbes and flavor compounds
3 讨论
本文对长达5个月发酵周期的窖池下层酒醅进行分析,发现在发酵初期(0~14 d),由于乳杆菌的大量繁殖,酒醅乳酸含量迅速增加,此后乳杆菌在整个发酵过程中占有绝对优势。乳杆菌在发酵初期即大量繁殖,其代谢生成的高浓度乳酸抑制了无耐酸性能的微生物或有害菌的生长,避免了发酵过程受到这些微生物的污染。相对占绝对优势的乳杆菌而言,梭菌纲微生物占比较小,虽然梭菌纲微生物的相对丰度随发酵时间呈现显著递增趋势,但即使到发酵140 d时,其平均相对丰度也仅占总细菌的8.94%。虽然酒醅中的梭菌纲微生物在数量上不占优势,但其对酒醅风味物质贡献却巨大。
任聪等[15]通过对新、老窖泥的微生物菌群结构和进化关系,发现窖泥中的主体己酸菌为梭菌纲瘤胃菌科的己酸菌属(Caproiciproducens)微生物,且以乳酸和葡萄糖利用型己酸菌为主。本文通过跟踪长达5个月的发酵过程中窖池下层酒醅微生物的变化规律,发现随着发酵时间的延长,梭菌纲瘤胃菌科的微生物在酒醅中的相对丰度逐渐增加,并观测到在长期发酵的后期(120 d后),酒醅中的乳酸含量亦有略微的下降趋势,而丁酸、己酸含量则随发酵期的延长持续增加。推测窖泥中的主体产己酸菌进入酒醅后,可将乳酸底物逐渐转化为丁酸和己酸,从而为酯类物质的合成不断提供充足的前体物质。
对酒醅菌群和窖泥菌群比较可知,酒醅中占有绝对优势的乳杆菌在窖泥中的相对丰度却较低,表明即使在长达5个月的发酵过程中,酒醅中占有绝对优势的乳杆菌并未能入侵到窖泥微生物体系中。有研究表明,新窖池的窖泥以高含量的乳杆菌为主要特征[7, 15],新窖池的窖泥由于厌氧菌群物种多样性低,尚未形成稳定的菌群结构,推测在长时间的发酵过程中,新窖池酒醅中的乳杆菌可能会入侵至窖泥体系中。本文所取样的酒醅和窖泥均为老窖池的样本,老窖池的窖泥具有丰富的厌氧菌群,在长时间的酒醅发酵过程中,不仅能抵御酒醅中乳杆菌的入侵,而且老窖泥中的主体微生物能不断迁移至酒醅层中。因此酒醅的发酵期越长,从老窖泥迁移至酒醅中的窖泥微生物越多,代谢生成的丁酸、己酸等有机酸含量也越多。
综上所述,对于老窖池而言,延长酒醅发酵时间后,一方面,窖泥中的主体厌氧微生物不断迁移进入酒醅,使得酒醅中的丁酸、己酸等有机酸含量持续积累;另一方面,也为有机酸与乙醇通过酯化反应生成酯类风味物质提供了更为充足的时间,因而发酵后期(120 d后),在酒醅中检测到了己酸乙酯的大量合成。此外,己酸作为浓香型白酒重要风味物质己酸乙酯的前体物质,其可作为衡量浓香型原酒品质的重要指征性指标。本文也主要对酒醅中高含量的有机酸(乳酸、乙酸、己酸、丁酸)和相应的酯类物质进行了分析,然而很多其他微量风味物质(如戊酸、辛酸、丁酸乙酯、戊酸乙酯、辛酸乙酯、己酸丁酯等)对浓香型白酒风格的形成也具有重要作用[16-18],因此在长期发酵过程中,酒醅中其他微量风味物质的变化规律仍有待深入分析。
虽然延长酒醅发酵时间对提高酒质有诸多优势,但也存在出酒率偏低、窖池周转率偏低等问题。另外,现有对窖泥微生物的研究表明,窖泥中亦存在一些产异嗅味的微生物[19-21],这些微生物在长期发酵过程中对原酒品质的影响有待深入研究。
