近三年高考关于晶体结构的考查分析
2019-11-07湖北
湖北
《晶体结构》是《选修3》第三章的内容,也是历年高考选考题《选修3》部分的压轴考点,但因学生掌握的知识有限、思维能力和空间想象能力不足等原因,导致这部分内容成为了很多学生难以逾越的“一座高山”,甚至是“死穴”。下面我们来看看近三年高考考了些什么,我们又该怎样复习。
一、近三年高考考情分析
1.问题条件的再现
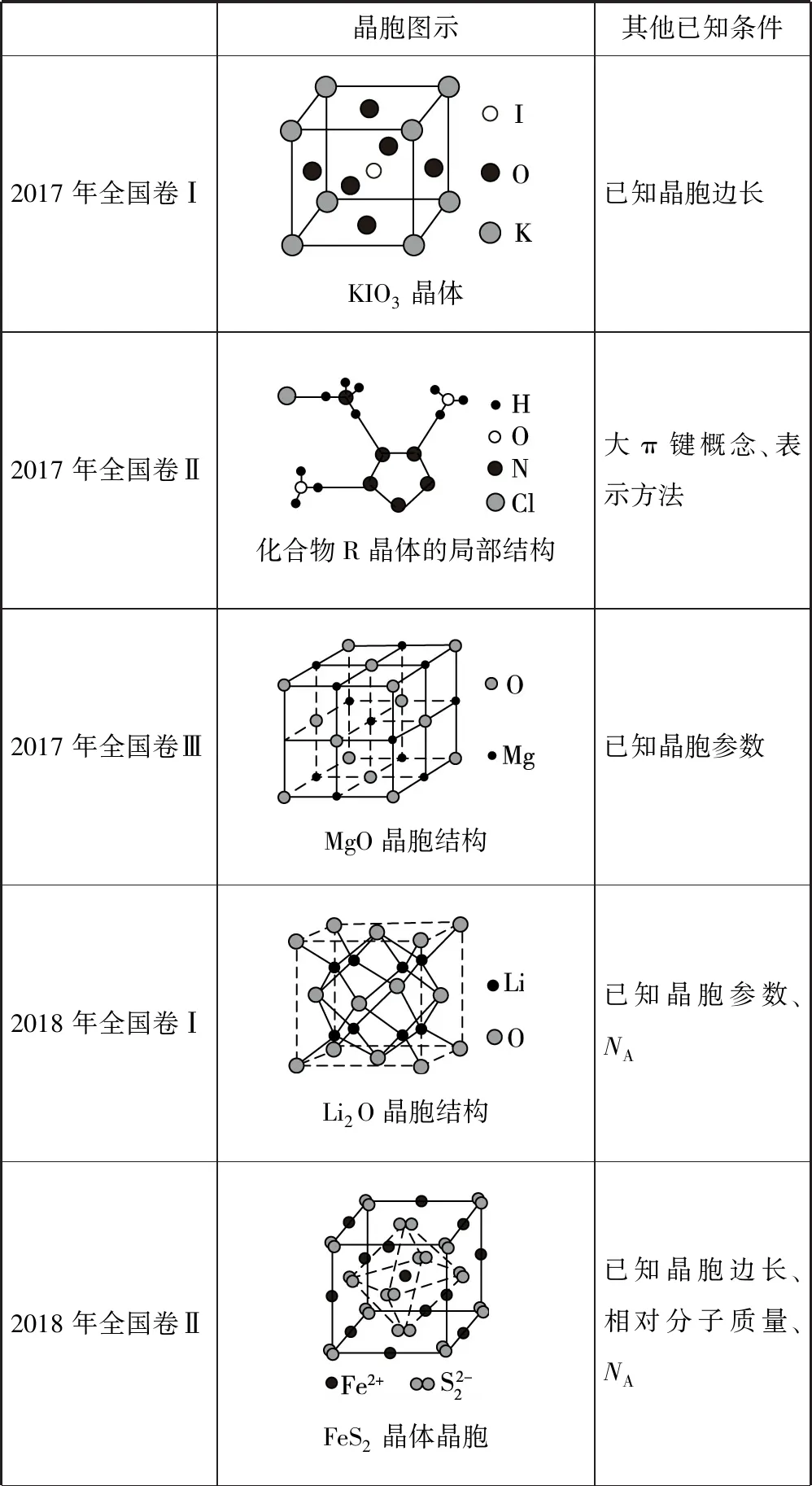
晶胞图示其他已知条件2017年全国卷ⅠKIO3晶体已知晶胞边长2017年全国卷Ⅱ化合物R晶体的局部结构大π键概念、表示方法2017年全国卷ⅢMgO晶胞结构已知晶胞参数2018年全国卷ⅠLi2O晶胞结构已知晶胞参数、NA 2018年全国卷ⅡFeS2晶体晶胞已知晶胞边长、相对分子质量、NA
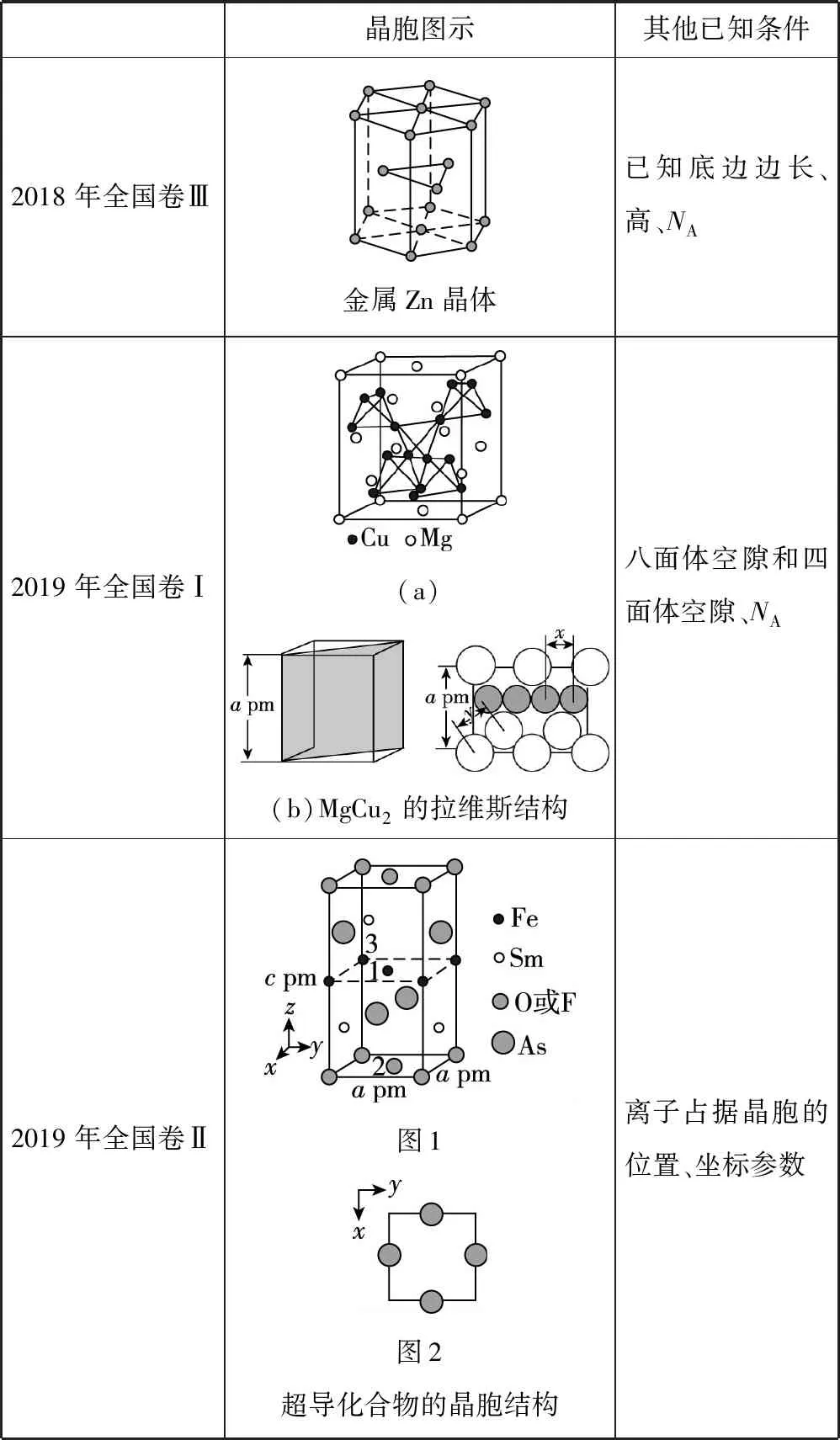
续表
备考启示:①每年的考题均给出了晶胞图示(含局部结构),有的是我们熟悉的单一图示,如MgO晶胞结构(NaCl型结构)、Li2O晶胞结构(萤石结构)、金属Zn晶体;有的是看上去不熟悉,但拆分一下就会发现它们是一些简单的、熟悉的晶胞“复合”图示,如2017年全国卷Ⅰ的KIO3晶胞图示,K、O原子围成的图形是面心立方最密堆积结构图,K、I原子围成的图形是体心立方最密堆积结构图,K原子围成的图形是简单立方结构图。所以,遇到复杂的晶胞结构图示时,一要冷静,尽可能地拆分为简单图示后,再进行分析判断;二要熟悉一些基本晶胞的结构图示,打好基础,方能由繁到简。
②平时的教学或学习中,要注意对知识或问题进行适当的拓展延伸。如2019年全国卷Ⅰ的35题第(4)问,老师和考生们都反映题很难,我以为其原型知识来源于两点:一是人教版教材《选修3》P78中的图3-28“NaCl晶体中阴、阳离子的配位数”,该图示中画出了两种八面体结构,在我们教学或学习中能不能更进一步研究一下一个NaCl晶胞中所含的八面体数、正四面体数呢?其原子的位置情况如何,这是我们要仔细研读教材的原因;二是2018年全国卷Ⅱ“FeS2晶体的晶胞”图示,该图示中画出了八面体结构,并且还要求计算八面体的边长,这个问题在2019年全国卷Ⅰ中再次出现,这提示广大教师在备考复习时一定要剖析历年高考真题。
③试题中的晶胞参数单位有nm、pm、cm等,但nm、pm这些单位是需要与cm之间进行换算的,很多同学在解答这一问题时常常出错,主要有两个原因:一是审题不细,有的同学根本不顾题中所给单位,未进行单位的转化;二是有的同学不清楚nm、pm与cm之间的倍数关系(1 nm=10-7cm、1 pm=10-10cm),常常导致求算密度(ρ)、距离或边长时出现错误。这一点也是复习备考中一定要落实到位的问题。
④有的试题中给出的晶胞是不完整的(部分)、或需要对晶胞进行拼加(平移重组)、重新切割,如2017年全国卷Ⅰ的35题第(5)问就是如此,唯有按这样的思维进行处理,才能快速确定K、O原子的正确位置。这也是备考复习中要尝试的思维训练。
⑤2019年全国卷Ⅰ的35题第(4)问出现了“沿立方格子对角面取得的截图”问题,有些学生根本未看懂图(b)的意思。展望明年的高考,“沿其体对角线垂直在纸平面上的投影图”、“六方最密堆积图示中的正八面体、正四面体”、“大π键应如何表示”等问题是否会出现,也是2020年高考备考要思考的问题。
2.涉及的考点分析
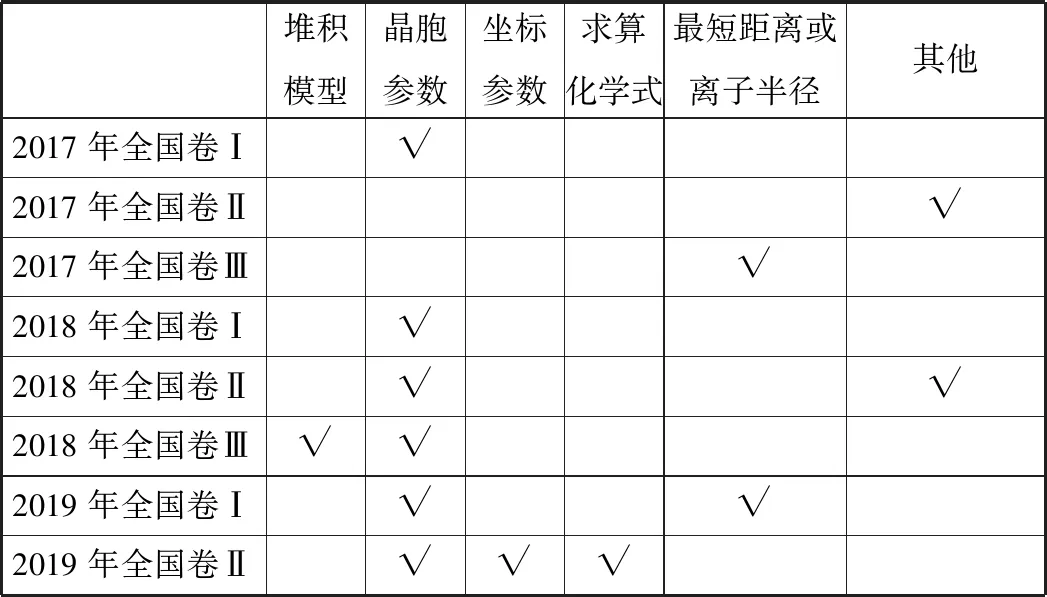
堆积模型晶胞参数坐标参数求算化学式最短距离或离子半径其他2017年全国卷Ⅰ√2017年全国卷Ⅱ√2017年全国卷Ⅲ√2018年全国卷Ⅰ√2018年全国卷Ⅱ√√2018年全国卷Ⅲ√√2019年全国卷Ⅰ√√2019年全国卷Ⅱ√√√
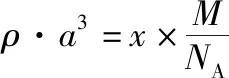
②配位数、与某微粒距离最近且距离相等的其他微粒(同种或异种)的数目、某微粒在“变形”晶胞图示中的具体位置等,是近三年高考中已考过的问题。但像空间利用率、二维空间原子在三维空间的堆积方式等还未考过,备考复习中要引起重视。
③大π键的相关知识点、面心立方(或NaCl晶胞)、六方最密堆积图示中的正八面体、正四面体情况等,这些还未考查到的知识点及一些新颖的考查形式,也是我们复习备考中应该注意的内容。
二、常见晶体的典型模型
【注】设晶胞的边长为a,球的半径为r,面对角线的距离为x,体对角线的距离为l。
1.分子晶体
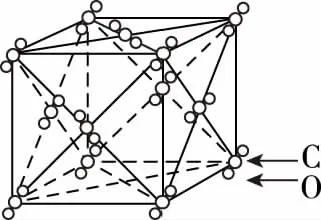
干冰晶胞(O2、C60、I2、CH4)
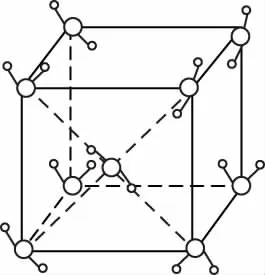
冰-Ⅶ的晶体结构
备考启示:①将一个CO2分子看成是一个质点,干冰晶胞图示就等同是(金属晶体中的)面心立方最密堆积图示,因此,CO2分子为面心立方最密堆积,且以一个CO2分子为中心,其周围有12个紧邻(距离最近且相等)的分子。
②均摊法求得一个晶胞中所含CO2分子的数目为4。
④网状结构图示中的系列问题从略,石墨结构需要关注。
⑤冰的晶体结构有多种,上述图示为其中的一种,不采用密堆积。
2.原子晶体
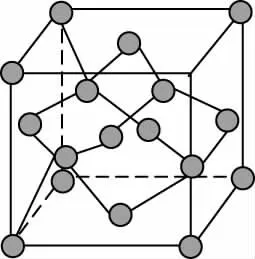
金刚石晶胞
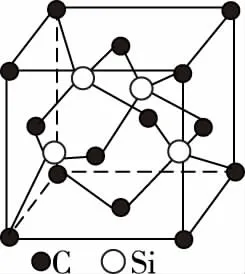
碳化硅晶胞
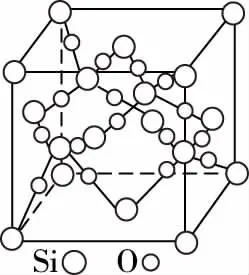
二氧化硅晶胞
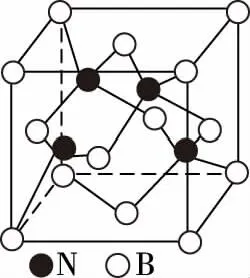
立方氮化硼
备考启示:①要弄清楚金刚石晶胞图示、SiC晶胞图示、BN晶胞图示、SiO2晶胞图示中的原子的位置关系。C、Si、N、B原子均能形成四个共价键,因此,各原子的杂化方式均为sp3杂化。
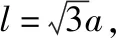
⑤C原子周围距离最近且相等的Si原子有4个,Si原子周围距离最近且相等的C原子也有4个,因此,碳化硅的化学式为SiC(电负性大的元素一般写在化学式的右边),BN也是如此。
3.金属晶体
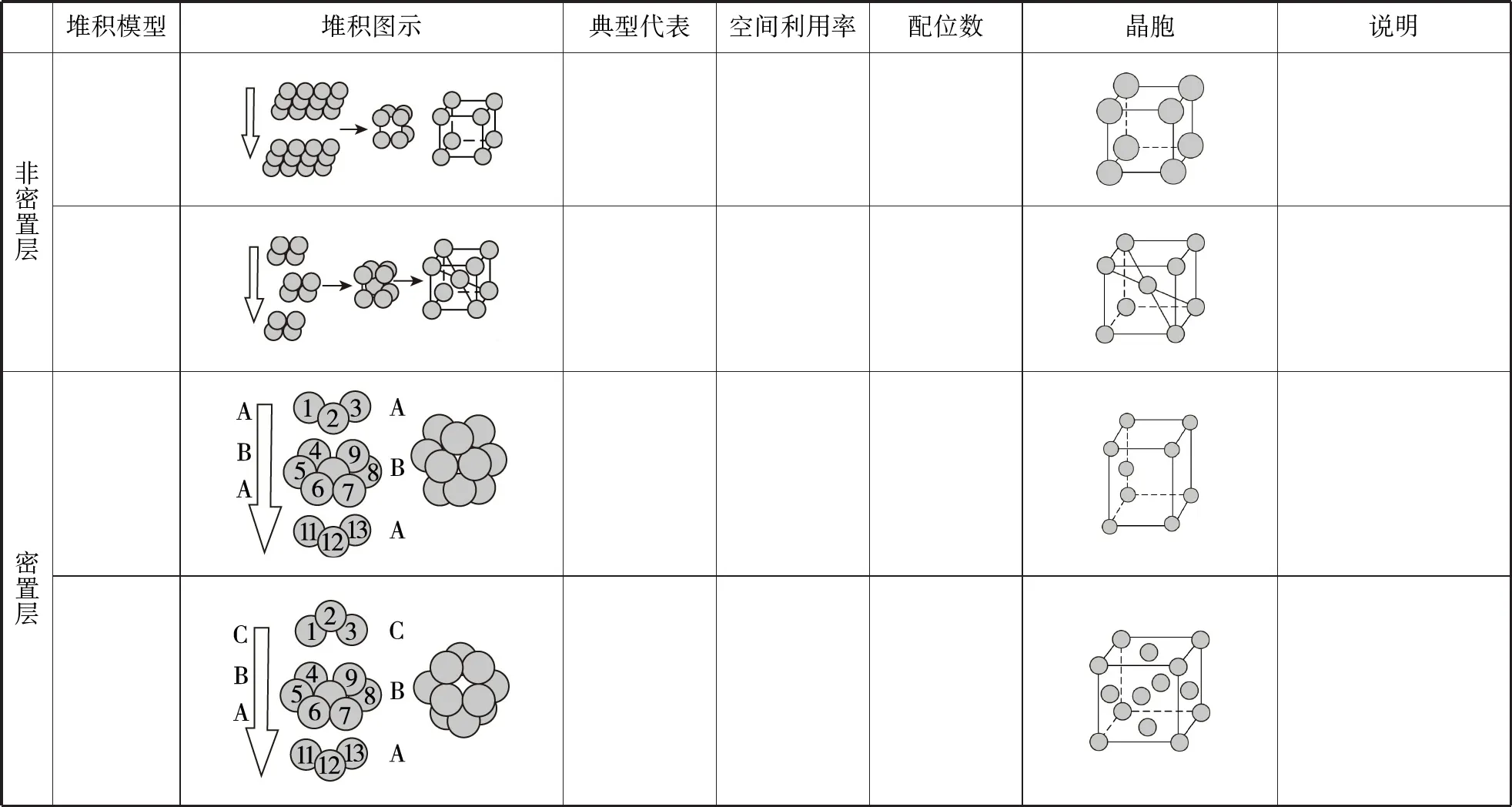
堆积模型堆积图示典型代表空间利用率配位数晶胞说明非密置层密置层
备考启示:①钾型、镁型、铜型、ABC、ABA型的堆积方式也需弄清楚,要与表格中的知识一一对应。空间利用率可用百分数或含π的分数表示。
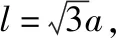

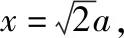
4.离子晶体
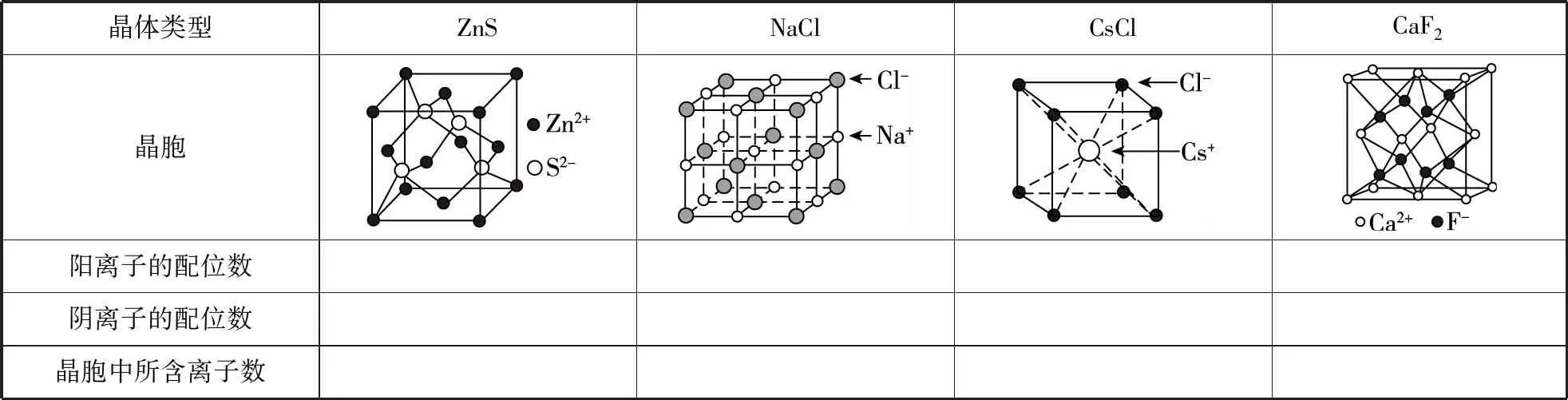
晶体类型ZnSNaClCsClCaF2晶胞阳离子的配位数阴离子的配位数晶胞中所含离子数
备考启示:①根据离子晶体结构的几何因素可知,所有离子晶体的晶胞图示中,球大一些的为阴离子,球小一些的为阳离子。
②ZnS晶胞图示:与SiC(或BN)晶胞图示相似,配位数均为4。与每个Zn2+距离最近且相等的Zn2+有12个,与每个Zn2+距离最近且相等的S2-有4个。

④CsCl晶胞图示:配位数均为8。当Cl-位于一个立方体的体心时,Cs+位于该立方体的8个顶角。
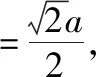
三、变式练习
1.金刚石晶胞及变式
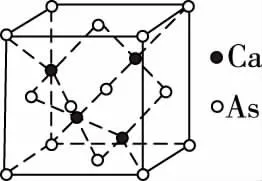
【例1】GaAs的晶胞结构如图所示,其中As原子形成的空隙类型有正八面体形和正四面体形,该晶胞中Ga原子所处空隙类型为________。已知GaAs的密度为ρg/cm3,Ga和As的摩尔质量分别为MGag/mol和MAsg/mol,阿伏加德罗常数的值为NA,则GaAs晶胞中Ga之间的最短距离为________pm(写出表达式)。
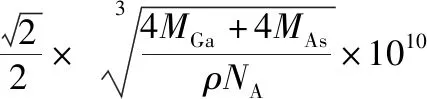
【例2】碳的第三种同素异形体——金刚石,其晶胞如图所示。已知金属钠的晶胞(体心立方堆积)沿其体对角线垂直在纸平面上的投影图如图A所示,则金刚石晶胞沿其体对角线垂直在纸平面上的投影图应该是
( )
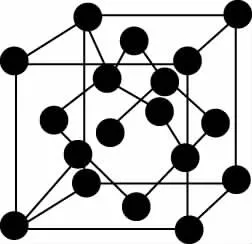
金刚石的晶胞
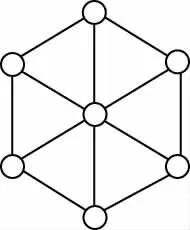
A
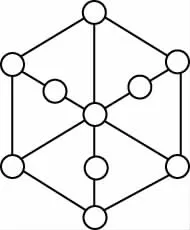
B
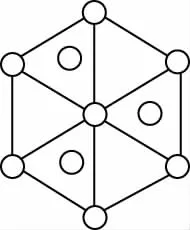
C
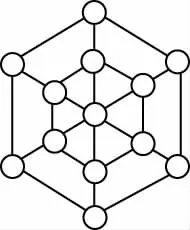
D
【答案】D
2.氯化钠晶胞及拓展
【例3】如图所示是从NaCl或CsCl的晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是
( )
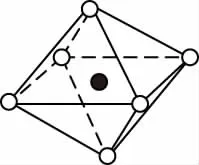
A
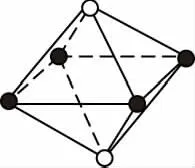
B

C
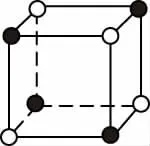
D
【答案】AD
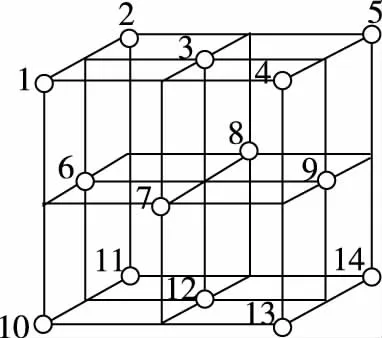
【例4】科学研究表明,Fe3O4是由Fe2+、Fe3+、O2-通过离子键而组成的复杂离子晶体。O2-的重复排列方式如图a所示,该排列方式中存在着两种类型的由O2-围成的空隙,如1、3、6、7的O2-围成的空隙和3、6、7、8、9、12的O2-围成的空隙,前者为正四面体空隙,后者为正八面体空隙,Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为________,其中有________%正四面体空隙填有Fe3+,有________%正八面体空隙没有被填充。
图a O2-的重复排列方式(白球表示O2-)

