2019年高考含量类计算题剖析
2019-11-07云南
云南
通过对2019年全国卷Ⅰ、全国卷Ⅱ、全国卷Ⅲ、北京卷、天津卷、江苏卷六套高考化学试卷上含量类型计算题的分析可以看出,这种类型的计算题是高考必考的综合类核心计算题。含量类计算题对化学系统知识的掌握和综合计算能力要求较高,但分值也就是2~3分,被称为高考化学中的“鸡肋”——弃之可惜,食之无味。本文对含量类型的综合计算题从所需的化学系统知识和综合计算能力的培养两个方面进行剖析,望对读者有所帮助。
一、2019年含量类计算高考真题
【例1】(2019·全国卷Ⅰ·27·节选)硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下(略)。回答下列问题:
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150℃时失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为________。
【例2】(2019·全国卷Ⅱ·26·节选)立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。回答下列问题:

【例3】(2019·全国卷Ⅲ·27·节选)乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:
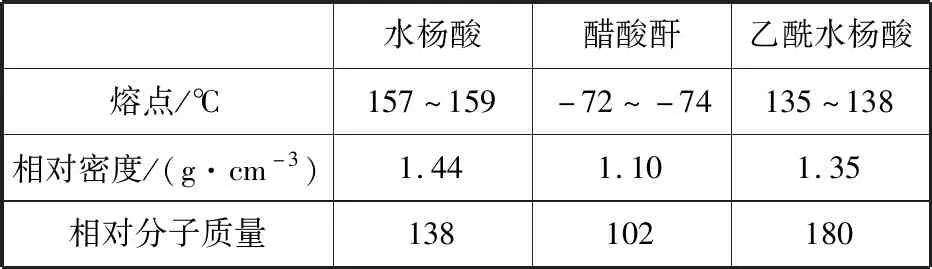
水杨酸醋酸酐乙酰水杨酸熔点/℃157~159-72~-74135~138相对密度/(g·cm-3)1.441.101.35相对分子质量138102180
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70℃左右,充分反应。稍冷后进行如下操作。
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。
回答下列问题:
(6)本实验的产率是________%。
【例4】(2019·北京卷·26·节选)化学小组用如下方法测定经处理后的废水中苯酚的含量(废水中不含干扰测定的物质)。
Ⅰ.用已准确称量的KBrO3固体配制一定体积的amol·L-1KBrO3标准溶液;
Ⅱ.取v1mL上述溶液,加入过量KBr,加H2SO4酸化,溶液颜色呈棕黄色;
Ⅲ.向Ⅱ所得溶液中加入v2mL废水;
Ⅳ.向Ⅲ中加入过量KI;
Ⅴ.用bmol·L-1Na2S2O3标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗Na2S2O3溶液v3mL。
已知:I2+2Na2S2O3=2NaI+Na2S4O6
Na2S2O3和Na2S4O6溶液颜色均为无色
(7)废水中苯酚的含量为________g·L-1(苯酚摩尔质量:94 g·mol-1)。
【例5】(2019·天津卷·9·节选)Ⅱ.环己烯含量的测定
在一定条件下,向ag环己烯样品中加入定量制得的bmol Br2,与环己烯充分反应后,剩余的Br2与足量KI作用生成I2,用cmol·L-1的Na2S2O3标准溶液滴定,终点时消耗Na2S2O3标准溶液vmL(以上数据均已扣除干扰因素)。
测定过程中,发生的反应如下:



(5)滴定所用的指示剂为淀粉溶液。样品中环己烯的质量分数为________(用字母表示)。
【例6】(2019·江苏卷·18·节选)聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m广泛用于水的净化。以FeSO4·7H2O为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。

②计算该样品中铁的质量分数(写出计算过程)。
以上六题为2019年不同省份高考试卷中的含量类计算题,通过比对可以发现:
1.六套考卷中的含量类计算题都出于工艺流程大题或实验大题;
2.除江苏卷要求写计算过程外,其他五卷都是要求直接写结果的填空题;
3.全国卷Ⅰ、全国卷Ⅲ和江苏卷是纯数值的计算,全国卷Ⅱ是数值和字母的混合计算表达,北京卷和天津卷是纯字母的计算表达;
4.除全国卷Ⅰ是用一句话说明题意(初看上去好像有点条件不足的感觉)外,其他五卷都是系统地描述实验过程,并在实验过程中又衍生出滴定终点、误差分析等常见的实验问题,稍不留神就会掉入陷进;
5.全国卷Ⅰ和全国卷Ⅲ中化学知识点的设计比较简单、直观,主要考查学生对实验数据的处理能力,而全国Ⅱ卷、北京卷、天津卷和江苏卷在化学知识点的设计上综合性较强,除考查学生对实验数据的处理能力外,还考查学生发现问题、解决问题的能力;
6.全国卷Ⅰ、全国卷Ⅲ和天津卷对考查“陌生”反应的化学方程式的书写要求不高,题中直接给出化学方程式,只需要掌握计算原理即可,而全国卷Ⅱ、北京卷和江苏卷不但考查计算原理的掌握情况,还着重考查“陌生”化学方程式的书写情况。
二、知识点剖析
1.含量计算题的常见类型
含量就是指特定物质中所包含的某种微粒成分的量。中学化学中常见含量类型的计算有:
(1)百分含量:某种微粒成分的百分含量等于该微粒成分的质量与特定物质总质量的比值,如例2、例5、例6。
(2)浓度含量:单位体积溶液里所含微粒成分的物质的量或质量,如例4。
(3)结晶水含量:晶体中所含结晶水的质量与晶体总质量的比值,如例1。
(4)产品含量:实际所得产品质量与理论可得产品质量的比值,如例3。
2.含量计算的常用方法
化学计算的核心思维过程是依据化学式或化学方程式找到物质之间的特定关系,然后根据关系式求出所需物质的质量,再用含量公式进行计算得出结果。
(2)熟练掌握化学方程式中各物理量之间的当量计算

2×27 2 2 3×Vm
m10-3cV1nV2
若Al的质量为m,NaOH溶液的浓度为c,体积为V1,生成NaAlO2的物质的量为n,生成标准状况下H2的体积为V2。则
(3)准确确定物质转换之间的数量关系。
①依据化学方程式确定
如:确定Na、Mg、Al与盐酸反应产生H2的数量关系
②依据元素原子跟踪法确定
如:确定用硫铁矿(FeS2)生产硫酸的数量关系
FeS2~2SO2、SO2~SO3、SO3~H2SO4,
所以得FeS2~2H2SO4。
③依据氧化还原反应中得失电子守恒确定
如:确定Na、Mg、Al与盐酸反应产生H2的数量关系
1 mol Na在反应中失去1 mol e-,产生1 mol H2需要得到2 mol e-,据得失守恒得:2Na~H2。
1 mol Mg在反应中失去2 mol e-,产生1 mol H2需要得到2 mol e-,据得失守恒得:Mg~H2。
1 mol Al在反应中失去3 mol e-,产生1 mol H2需要得到2 mol e-,据得失守恒得:2Al~3H2。
3.含量计算题中数值的处理方法
化学中的计算问题也可看成是对实验数据的处理,在处理实验数据时应该注意以下几个问题:
(1)注意单位的换算;
(2)根据题意合理保留有效数字,如果题目没有直接说明,通常根据题中的有效数字位数进行处理;
(3)计算时注意使用约分、化简等技巧对计算进行简化。
4.含量计算题的解题思路
(1)审题
①认真审清题中所问含量:是某种元素的含量,还是某种微粒或物质的含量;是某种微粒物质的量的含量,还是质量或体积的含量;是反应物转化为产物的量所占反应物总量的百分含量(转化率),还是实际生成的产物所占理论生成的产物的百分含量(产率)等。
②认真审清题中所给信息:是物质被溶解,还是物质被沉淀;是物质被氧化,还是物质被还原;是物质一步转化,还是物质分两步或多步转化;是同一物质连续转化,还是不同物质交叉转化等。
(2)构建物质间的定量转换关系进行当量计算
①写出物质变化过程中的化学方程式(或离子方程式)确定物质间的定量转化关系。
②根据原子守恒(原子跟踪法)确定物质间的定量转化关系。
③根据氧化还原反应中化合价升降总数相等(得失电子守恒法)确定物质间的定量转化关系。
(3)利用公式计算得出结果


三、2019高考真题剖析
1.例1的解析

2.例2的解析


32 g 1 mol 2 mol 1 mol
xgn1mol 0.1×V×10-3moln2mol

3.例3的解析
(6)设理论上生成乙酰水杨酸的质量为x,则有:

4.例4的解析


n2b×v3×10-3
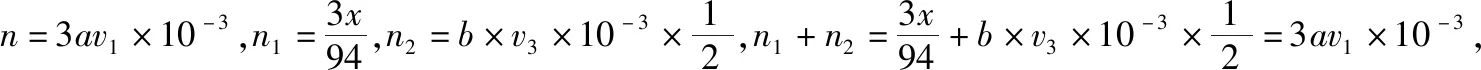
5.例5的解析
(5)此题与北京卷非常相似,但题干描述比较直白,并且直接给出所涉及的三个化学方程式,所以难度较小。根据三个化学方程式可以确定物质之间转化的定量关系。设ag环己烯样品中含环己烯的质量为xg,反应消耗Br2的物质的量为n1,I-消耗Br2的物质的量为n2,则可得:


6.例6的解析



