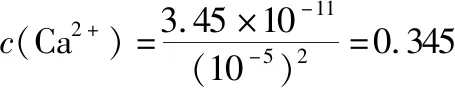难溶电解质溶解平衡知识点疑难解析
2019-11-07四川
四川
难溶电解质的沉淀溶解平衡是近年高考试题中的热点、难点问题。《普通高等学校招生全国统一考试大纲(2019)》要求“了解难溶电解质的沉淀溶解平衡。理解溶度积(Ksp)的含义,能进行相关的计算”。较修订前,删除了“了解沉淀转化的本质”,新增了“理解溶度积(Ksp)的含义,能进行相关的计算”。新增的这部分内容在试题中的呈现较为广泛,考查形式也比较多样。
一、难溶电解质的沉淀溶解平衡—教材解读
化学教材选修4《化学反应原理》第65页中对沉淀溶解平衡常数(溶度积)的概念进行了介绍:

教材第64页【实验3-4】实验现象:NaCl和AgNO3溶液混合生成白色沉淀;向所得固液混合物中滴加KI溶液,沉淀变成淡黄色;向新得固液混合物中滴加Na2S溶液,沉淀转化成黑色。结合实验现象可推出:沉淀转化的实质就是沉淀溶解平衡的移动。一般而言,溶解度小的沉淀易转化成溶解度更小的沉淀(两者的差别越大,转化越容易)。Ag2S、AgI和AgCl的溶解度分别是1.3×10-16g、3×10-7g、1.5×10-4g,Ag2S、AgI和AgCl的Ksp分别是 6.3×10-50、8.5×10-17、1.8×10-10,因此沉淀转化的实验现象比较明显。
二、难溶电解质的沉淀溶解平衡—多样性考查
2017年教育部颁布了《普通高中化学课程标准(2017年版)》(以下简称“课程标准”)提出了化学学科核心素养的基本要求,化学学科核心素养包括“宏观辨识与微观探析” “变化观念与平衡思想”“证据推理与模型认知”“科学探究与创新意识”“科学态度与社会责任”5个方面。“证据推理与模型认知”的学科核心素养要求学生“通过分析、推理等方法认识研究对象的本质特征、构成要素及其相互关系,建立认知模型,并能运用模型解释化学现象,揭示现象的本质和规律”,并将这些理论知识应用于解决实际问题。
1.难溶电解质溶解平衡图象的识别
【例1】(2019·全国卷Ⅱ·12)绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
( )
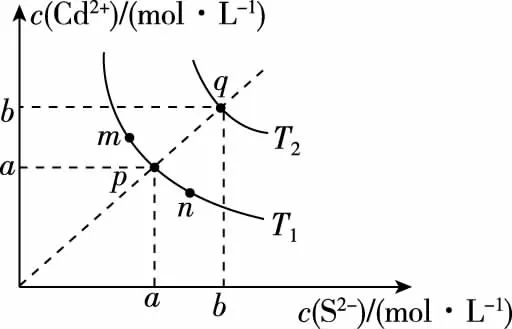
A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
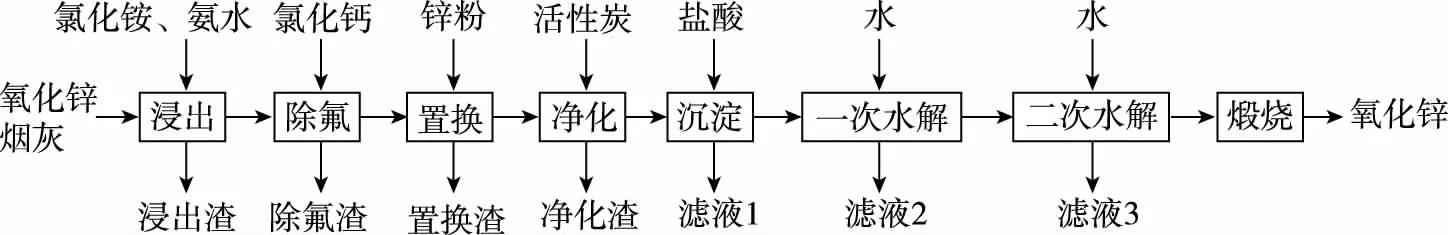
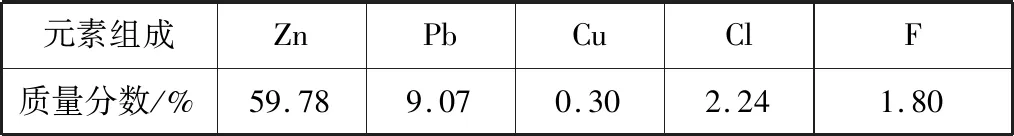
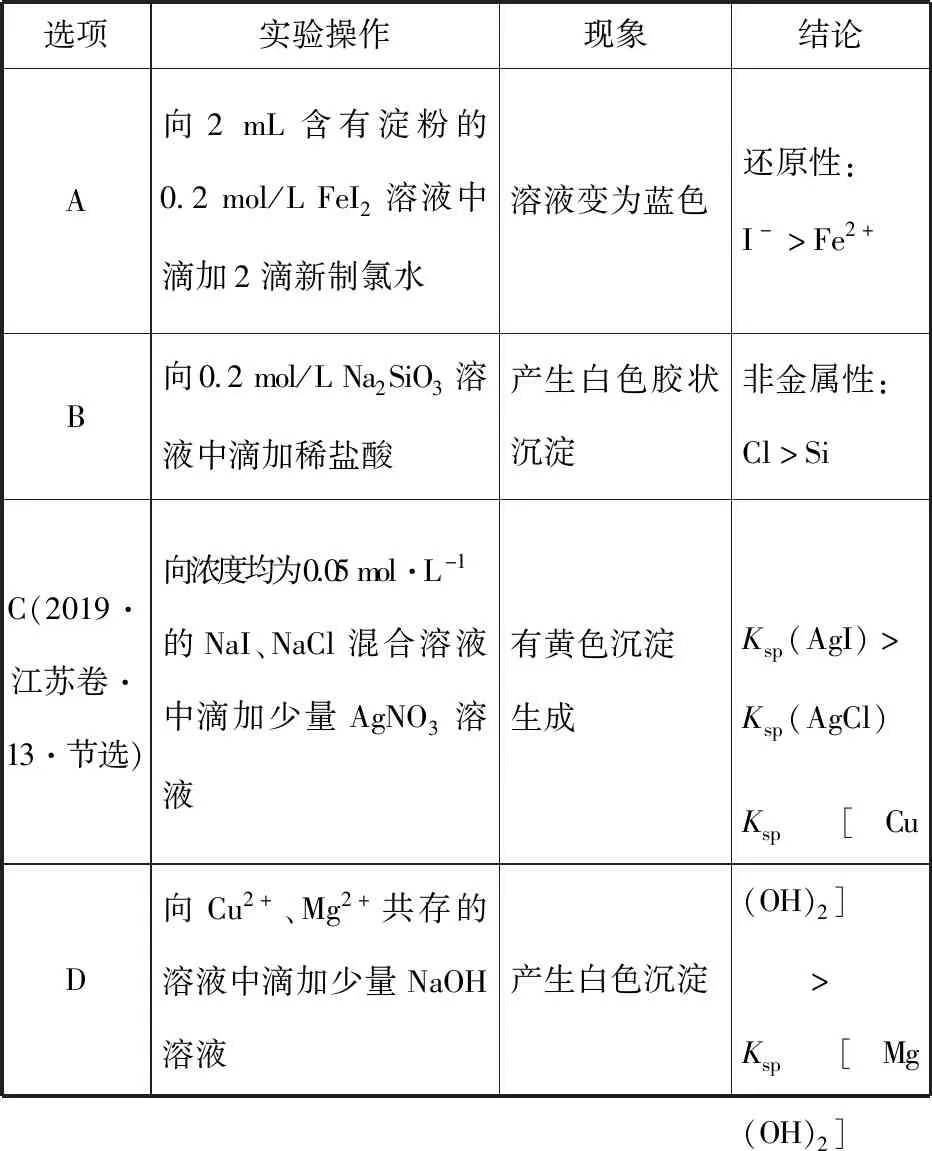
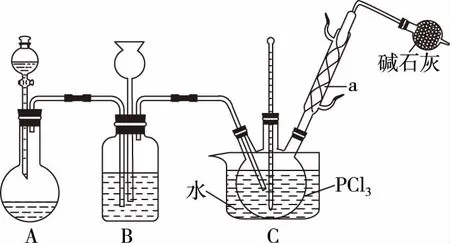
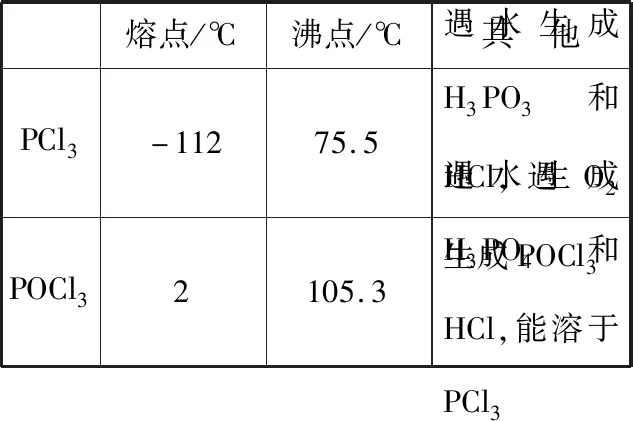
B.图中各点对应的Ksp的关系为Ksp(m)=Ksp(n) C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动 D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动 【答案】B 【试题分析】a、b两点分别表示T1、T2温度下饱和溶液中的c(Cd2+)或c(S2-),假设溶液体积为1 L,难溶电解质溶液的密度近似为1 g/mL(溶剂水的密度),结合硫化镉摩尔质量将浓度转化成每100 g水中溶解的质量,即可粗略计算该温度下硫化镉的溶解度,A项正确;Ksp仅仅是温度的函数,因此m、p、n三点的Ksp相同,B项错误;向m点溶液中加入少量Na2S固体,溶液中c(S2-)增大,由温度不变Ksp不变,可知c(Cd2+)减小,溶液组成由m沿mpn线向p方向移动,C项正确;温度降低时,CdS溶解度减小,q点的饱和溶液组成由q沿qp线向p方向移动,D项正确。 【能力提升】难溶电解质的溶解平衡是化学平衡中的一个分支,因此沉淀溶解平衡常数(溶度积Ksp)也是温度的函数,它只随温度的变化而变化,在温度不改变时Ksp不变,在温度改变时,还需根据温度的变化情况(升高或下降)以及温度与Ksp之间的影响关系确定变化情况。在讲解试题的过程中,不断培养学生的识图能力,引导学生通过图象的转化,结合清晰的变化关系,准确地解答试题。 【例2】(2019·泸州三诊·组合)下列实验操作与现象都正确,且能得出对应结论的是 ( ) 【答案】A 【试题分析】FeI2溶液中的Fe2+、I-均有还原性,滴入2滴(少量)新制氯水,还原性强的先被氯气氧化,含有淀粉的溶液变蓝,即说明I-先被氧化,生成I2遇淀粉显色,还原性:I->Fe2+,A项正确;稀盐酸与Na2SiO3溶液反应生成白色沉淀(硅酸),由此可知盐酸(非氯元素的最高价含氧酸)酸性强于硅酸,但不能比较Cl与Si的非金属性强弱,B项错误;黄色沉淀为AgI,说明加入AgNO3溶液优先形成AgI沉淀,AgI比AgCl更难溶,AgI与AgCl属于同种类型化合物,则Ksp(AgI) 【例3】(2017·福建省福州市高二期中)25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.6×10-9。该温度下,下列说法不正确的是 ( ) A.同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出 B.BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大 D.BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4不可能转化为BaCO3 【答案】D 【易错点拨】通过沉淀的转化确定Ksp的相对大小,必须确定是一种难溶电解质转化成了另一种更难溶电解质,这要求两种难溶电解质Ksp相差较大。通过例3可以发现,在两种难溶电解质的Ksp相当时,两种难溶电解质可以相互转化,也就是说,这时不能通过沉淀的转化确定Ksp的相对大小。 【例4】(2017·湖北段考·节选)(2)为了测定碳酸氢钠中杂质氯元素(离子状态)的含量,先称取ag试样用蒸馏水溶解,再用足量稀硝酸酸化,配成100 mL溶液,取出20 mL注入锥形瓶中,然后用cmol·L-1AgNO3标准溶液滴定Cl-,K2CrO4溶液为指示剂。 已知:常温下Ksp(AgCl)=2×10-10,Ksp(Ag2CrO4)=1.12×10-12,Ag2CrO4为砖红色。 ②当观察到出现白色沉淀时停止滴定,若此时消耗了AgNO3标准溶液VmL,则碳酸氢钠样品中杂质氯元素的质量分数表达式为____________________。 【答案】(2)①2.8×10-3mol·L-1 【例5】(2018·重庆一中月考·节选)三氯氧磷(POCl3)是重要的基础化工原料,广泛用于制药、染化等行业。某兴趣小组模拟PCl3直接氧化法制备POCl3,实验装置设计如下: 有关物质的部分性质如下表: 熔点/℃沸点/℃其 他PCl3-11275.5遇水生成H3PO3和HCl,遇O2生成POCl3POCl32105.3遇水生成H3PO4和HCl,能溶于PCl3 回答下列问题: (4)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下: Ⅰ.取xg产品于锥形瓶中,加入足量NaOH溶液,待完全反应后加稀硝酸至酸性。 Ⅱ.向锥形瓶中加入0.100 0 mol·L-1的AgNO3溶液40.00 mL,使Cl-完全沉淀。 Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。 Ⅳ.加入指示剂,用cmol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积VmL。 已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12 ①滴定选用的指示剂是________(填标号)。 a.FeCl2b.NH4Fe(SO4)2c.淀粉 d.甲基橙 ②Cl元素的质量百分含量为(列出算式)________。 ③在步骤Ⅲ中,若无加入硝基苯的操作,所测Cl元素含量将会________(填“偏大”“偏小”或“不变”)。 【误区警示】部分难溶电解质(或难溶电解质涉及的粒子形成的化合物)有特殊的颜色,可利用此特点进行沉淀滴定实验的设计。若沉淀自身有颜色,则可设计为滴定终点指示剂,这要求被检验离子、指示剂离子与标准液离子发生沉淀反应的顺序有先有后,被检离子先于指示剂离子沉淀(难溶电解质化学表达式类似时比较Ksp,不相似时需计算后比较);若在混合离子中检验某种离子,还需考虑离子间是否存在现象干扰,有干扰时还需设计防干扰实验。 【例6】已知:AgCl的溶解度为1.5×10-4g,AgBr的溶解度为8.4×10-6g。将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为 ( ) A.只有AgBr沉淀生成 B.AgCl与和AgBr沉淀等量生成 C.AgCl沉淀少于AgBr沉淀 D.AgCl沉淀多于AgBr沉淀 【答案】D 【试题分析】根据题意,AgBr比AgCl溶解度小,AgCl和AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,生成AgCl、AgBr两种沉淀,且c(Cl-)>c(Br-),则AgCl沉淀多于AgBr沉淀。 【易错点拨】本题是教材选修4《化学反应原理》第三章第四节——《难溶电解质的溶解平衡》的课后习题,在解答时很容易依据Ksp(AgCl)>Ksp(AgBr)直接判断AgCl沉淀少于AgBr沉淀而误选C项,本题解题关键在于“AgCl与AgBr的饱和溶液等体积混合”,混合溶液中由于溶解度之间的差异,c(Cl-)>c(Br-),因此AgCl沉淀多于AgBr沉淀。 【例7】(2018·河北模拟·27·节选)氧化锌是一种常用添加剂,广泛应用于塑料、合成橡胶、电池等产品的制造。一种利用氧化锌烟灰制备活性氧化锌的工艺流程如下: 已知:Ⅰ.氧化锌烟灰的主要化学组成如下: 元素组成ZnPbCuClF质量分数/%59.789.070.302.241.80 (3)若“浸出”后,所得溶液中c(F-)=0.02 mol·L-1,向其中加入等体积的氯化钙溶液(忽略溶液体积变化),使F-沉淀完全即溶液中c(F-)<10-5mol·L-1,则所加氯化钙溶液的浓度最小为________。已知:Ksp(CaF2)=3.45×10-11 【答案】(3)0.70 mol·L-1 【能力提升】结合溶度积Ksp的化学计算题是高考的热点、难点问题。要想解决此类问题,首先应关注化学计算中的数据,Ksp属于平衡常数,因此选取各粒子的浓度是平衡时的浓度;其次还应注意问题中要求计算的量是平衡时溶液中的粒子浓度,还是反应前溶液的粒子浓度,前者直接依据数据计算,后者包括平衡时溶液中的粒子浓度和沉淀中的粒子浓度。 本文系全国教育科学“十三五”规划2018年度教育部重点课题《模型认知在普通高中化学教学中的应用研究》(课题批准号:DHA180440)的阶段成果之一。2.应用沉淀的转化比较Ksp的大小
3.利用Ksp的大小设计定量实验
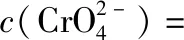
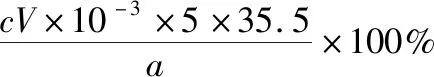
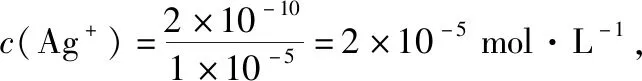
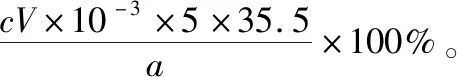
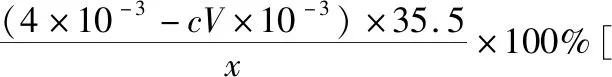

4.难溶电解质溶解平衡的疑难解析