MUC1蛋白在非小细胞肺癌早期诊断中的临床价值
2019-11-06付红艳王义勇张科东周凤
付红艳,王义勇,张科东,周凤
肺癌已成为多数国家恶性肿瘤死亡的首要原因,非小细胞肺癌(NSCLC)是肺癌的一种常见类型[1],发病隐匿,多数患者诊疗时已属于晚期,无手术治疗指征[2]。因此寻找非小细胞肺癌相关的分子标志,以便预测肿瘤进展情况,进而早期诊断、早期治疗对于改善患者预后尤为重要[3]。黏蛋白1(MUC1)是一种主要分布于器官上皮细胞近管腔或腺腔面的跨膜糖蛋白,可介导信号转导和细胞黏附[4]。研究发现,乳腺癌组织中MUC1的表达与乳腺癌的分化程度及临床分期存在相关性[5]。但是关于MUC1表达在NSCLC中的研究较少。本研究采用酶联免疫吸附法及免疫组织化学染色法检测NSCLC患者血清及癌组织中MUC1蛋白的表达,分析其表达水平与NSCLC临床特征的关系,进一步明确其在NSCLC患者临床早期诊断及治疗中的预测价值。
1 资料与方法
1.1一般资料 选取2017年12月—2018年12月宁夏医科大学总医院普胸外科和呼吸与危重症医学科收治的119例患者为研究对象。根据病理类型分为肺鳞癌组34例,其中男29例,女5例,高分化5例,低中分化29例,Ⅰ~Ⅱ期18例,Ⅲ~Ⅳ期16例;肺腺癌组65例,其中男38例,女27例,高分化15例,低中分化50例,Ⅰ~Ⅱ期35例,Ⅲ~Ⅳ期30例;非肺癌组20例,其中男10例,女10例,肺炎性假瘤5例,肺良性结节4例,肺结核3例,肺硬化性血管瘤2例,干燥综合征2例,良性肿瘤4例,此类患者均高度怀疑肺部恶性肿瘤,经术中病理检查排除。所有患者入院后空腹采集外周静脉血后分离血清,手术时或支气管镜检查时切除肺癌组织和正常肺组织,-80℃冰箱保存备用。病理分化程度按照WHO病理分化标准,临床分期按照国际第八版肺癌TNM分期标准。
1.2纳入及排除标准 所有纳入患者均经病理学检查确诊为NSCLC和肺部良性病变,排除存在气道炎症的肺部疾病如肺炎、哮喘、慢性阻塞性肺疾病等,排除心、肝、肾等器官功能衰竭患者,排除既往其他类型肿瘤病史患者。所有研究对象均对本研究知情并签署知情同意书,研究方案获得医院伦理道德委员会批准(伦理编号:2018-288)。
1.3主要试剂 MUC1兔抗人单克隆抗体购自美国Affinity公司;辣根过氧化物酶标记的羊抗兔IgG二抗购自美国Abbkine公司;人MUC1酶联免疫吸附法(ELISA)检测试剂盒购自上海宝曼生物科技有限公司,酶标仪(型号ELx800)购自BIO-TEK公司,电子显微镜购自日本Olympus公司,低温离心机购自德国Sigma公司。
1.4方法
1.4.1ELISA检测各组血清MUC1蛋白水平 将收集到的血清标本严格按照试剂盒说明书操作。将标准品孔各加入不同浓度的标准品50µL,样本孔加入待测样本血清10µL,再加血清稀释液40µL;标准孔及样本孔中每孔加入辣根过氧化物酶标记的MUC1抗体100µL,封闭后37℃恒温箱温育60 min后洗涤5次。每孔继续加入底物A、B各50µL,37℃避光孵育15 min。每孔加入终止液50µL,10 min后,用酶标仪测定各孔在450 nm波长下的光密度(OD)值。
1.4.2HE染色 将收集的肺组织标本经二甲苯固定、石蜡包埋,并进行连续切片,厚度为3µm,切片经二甲苯Ⅰ、Ⅱ各脱蜡10 min后,依次放入100%、95%、85%、70%乙醇各5 min,经蒸馏水冲洗后转入苏木素染液染色1~2 min,用分化液分化数秒后流水冲洗2 s,返蓝液返蓝数秒至细胞核呈蓝色后流水冲洗10 min,继而入伊红染色液10 min,再次流水冲洗后,依次放入70%、85%、95%、100%乙醇各5 min脱水后经二甲苯透明2次,每次约5 min,最后经中性树胶封固,光学显微镜下观察拍照。
1.4.3免疫组织化学染色 将肺组织切片经二甲苯脱蜡、浓度梯度乙醇至蒸馏水水化,再经3%甲醇双氧水室温孵育20 min消除内源性酶,高压修复之后放入PBS洗3次,每次5 min,滴加MUC1兔抗人一抗(1∶50),次日再次放入PBS洗3次,每次5 min,切片上滴加二抗辣根过氧化物酶标记羊抗兔IgG二抗,37℃避光20 min后,放入PBS洗3次,每次5 min,滴加DAB染液显色5~10 s,水洗终止显色,最后经苏木素复染、梯度乙醇脱水、二甲苯透明、封片、显微镜下随机读取5个高倍视野对阳性细胞比例和染色强度进行半定量测定。染色强度评分标准:0分(未着色),1分(橘黄色),2分(棕黄色),3分(黄褐色)。阳性细胞所占比例评分标准:0分(<5%),1分(5%~25%),2分(26%~50%),3分(51%~75%),4分(>75%)。2种评分相加总分<2分为阴性,≥2分为阳性。
1.5统计学方法 运用SPSS 19.0软件对采集数据进行统计学分析,符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,组间多重比较采用LSD-t法,计数资料均以例(%)表示,组间比较采用χ2检验。受试者工作特征(ROC)曲线用于分析血清MUC1蛋白对不同类型NSCLC诊断价值,P<0.05为差异有统计学意义。
2 结果
2.13组患者血清MUC1蛋白表达水平比较 肺鳞癌组、肺腺癌组、非肺癌组血清中MUC1蛋白的表达水平分别为(35.70±9.17)U/mL、(37.08±10.24)U/mL、(26.83±2.93)U/mL,组间比较差异有统计学意义(F=9.775,均P<0.05);肺鳞癌组、肺腺癌组血清MUC1蛋白表达水平均高于非肺癌组,而肺鳞癌组、肺腺癌组血清MUC1蛋白表达水平差异无统计学意义。
2.2血清MUC1蛋白对不同类型NSCLC的诊断效能分析 ROC曲线分析结果显示,血清MUC1蛋白诊断肺鳞癌的ROC曲线下面积(AUC)为0.774(95%CI:0.651~0.896),以MUC1蛋白>33.23 U/mL为阳性临界值,其诊断敏感度为52.94%,特异度为100%,见图1A。血清MUC1蛋白诊断肺腺癌的AUC为0.785(95%CI:0.690~0.880),以MUC1蛋白>31.31 U/mL为临界值,其诊断敏感度为61.54%,特异度为95%,见图1B。

Fig.1 ROC curve of serum MUC1 protein in diagnosis of different types of NSCLC图1 血清MUC1蛋白诊断不同类型NSCLC的ROC曲线
2.3不同类型NSCLC癌组织病理表现 HE染色结果显示,肺鳞癌细胞多呈巢状分布,中央分布环状红染的角化物,见图2A;肺腺癌细胞多呈小条索状排列,形成腺管样结构,见图2B。
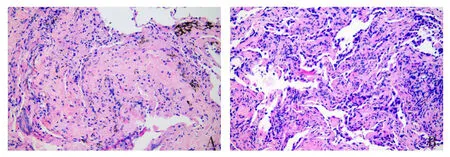
Fig.2 Different types of NSCLC cancer tissue under HE staining(×200)图2 不同类型NSCLC癌组织经HE染色(×200)
2.4MUC1蛋白在不同类型NSCLC组织中的表达情况 MUC1蛋白主要在胞质及胞膜中表达,阳性颗粒呈棕黄色或黄褐色分布,见图3。肺鳞癌组癌组织中MUC1蛋白阳性率为64.71%(22/34),肺腺癌组癌组织中MUC1蛋白阳性率为73.85%(48/65),非肺癌组肺组织中MUC1蛋白阳性率为5%(1/20),肺鳞癌及肺腺癌组癌组织中MUC1蛋白的阳性表达率均高于非肺癌组,差异有统计学意义(χ2分别为18.36、29.69,均P<0.017),而肺鳞癌组、肺腺癌组癌组织中MUC1蛋白表达水平比较差异无统计学意义(χ2=0.90,P>0.05)。
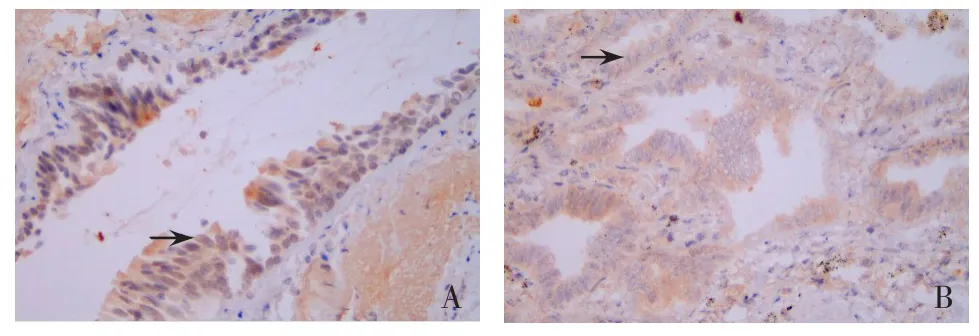
Fig.3 Expression of MUC1 protein in different types of NSCLC cancer tissues(×400)图3 MUC1蛋白在不同类型NSCLC癌组织中的表达(×400)
2.5MUC1蛋白表达与不同类型NSCLC临床特征的关系 肺鳞癌组中不同性别、年龄、分化程度、TNM分期分组患者血清及癌组织MUC1蛋白阳性表达率比较差异无统计学意义(P>0.05),见表1。肺腺癌组中-低组织分化、TNM分期Ⅲ~Ⅳ期组患者血清及癌组织的MUC1蛋白阳性表达率分别高于高组织分化、TNM分期Ⅰ~Ⅱ期组(P<0.05);而不同性别、年龄分组患者血清及癌组织MUC1蛋白阳性表达率差异无统计学意义(P>0.05),见表2。

Tab.1 The relationship between the expression of MUC1 protein and the clinical characteristics of lung squamous cell carcinoma表1 MUC1蛋白表达与肺鳞癌临床特征的关系 例(%)
3 讨论
我国每年新增约65.3万例肺癌患者,其中NSCLC患者占到了80%以上[6]。自靶向药物出现以来,NSCLC的治疗取得了一定的进展[7],但由于临床中早期预测、诊断NSCLC的手段有限,导致NSCLC患者远期生存改善并不明显。MUC1是分布于机体各种上皮表面的高度糖基化的糖蛋白,可介导信号转导和细胞黏附功能等[8]。Ma等[9]研究发现,MUC1的高表达与唾液腺腺泡细胞癌组织学类型、病变部位、颈淋巴结转移、局部复发和远处转移有关,提示与唾液腺腺泡细胞癌的发生发展有关。Jing等[5]研究发现,MUC1的过度表达与乳腺癌患者预后不良相关,并与MUC1启动子甲基化状态有关,提示可能是乳腺癌的潜在预后因素和治疗靶点。Li等[10]研究发现MUC1高表达与结直肠癌坏死、分期、浸润深度和淋巴结转移相关,可预测结直肠癌预后不良和生存结局。这些研究表明MUC1在腺上皮来源的肿瘤中存在高表达,且与不同腺上皮来源肿瘤的预后存在相关性,提示MUC1在NSCLC中可能存在高表达,且与其恶性程度及不良预后可能存在一定相关性。本研究中,ELISA和免疫组化染色结果显示肺腺癌组患者血清及癌组织中MUC1蛋白的表达水平均高于非肺癌组。肺腺癌组内中-低组织分化、TNM分期Ⅲ~Ⅳ期组患者血清及癌组织MUC1蛋白阳性表达率高于高组织分化、TNM分期Ⅰ~Ⅱ期组,提示MUC1蛋白在腺上皮来源的肺腺癌进展中起到一定作用,高水平的MUC1蛋白表达可能提示肺腺癌恶性程度及预后不良,与上述研究结果基本一致。肺鳞癌组患者血清及癌组织中MUC1蛋白的表达水平同样高于非肺癌组,但肺鳞癌组患者血清及癌组织的MUC1蛋白阳性表达率与不同分化程度、TNM分期无明显关系,提示MUC1蛋白在鳞状上皮来源的肺鳞癌中也存在一定的表达,但无法预测肺鳞癌恶性程度及预后不良。
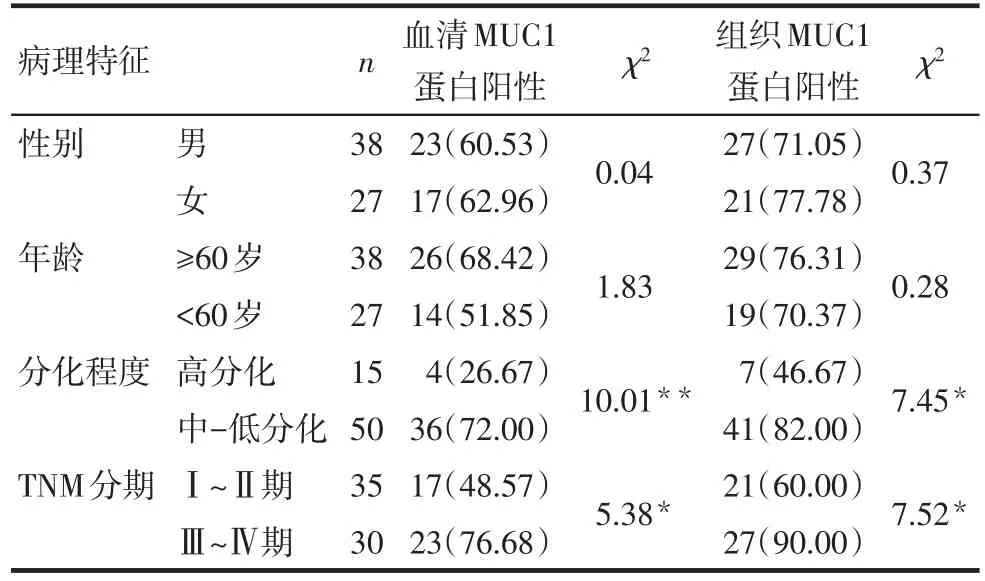
Tab.2 The relationship between expression of MUC1 protein and clinical characteristics of lung adenocarcinoma表2 MUC1蛋白表达与肺腺癌临床特征的关系 例(%)
本研究中采用ROC曲线分析血清MUC1蛋白对不同类型NSCLC诊断价值,发现MUC1蛋白诊断肺鳞癌、肺腺癌具有中等诊断效率(AUC分别为0.774、0.785),提示血清中MUC1蛋白表达水平的高低可能成为NSCLC的非侵入性生物标志物,可用于NSCLC早期检测,但MUC1蛋白诊断肺鳞癌的敏感度低于60%,而其诊断肺腺癌敏感度大于60%,可能原因为MUC1蛋白在腺上皮来源的肿瘤中存在更高表达,而肺鳞癌为鳞状上皮来源的肿瘤,同时与检测样本中鳞癌数目较少可能也有一定关系。
综上所述,NSCLC患者血清及癌组织中MUC1蛋白呈高表达,高水平的MUC1蛋白表达提示肺腺癌恶性程度及预后不良,可用于预测肺腺癌早期临床诊断,但对肺鳞癌恶性程度及预后不良预测意义有限。本研究的局限性在于只检测了MUC1蛋白在NSCLC血清及癌组织中表达异常,不足以完全解释MUC1与NSCLC发生发展及侵犯、转移的相关性,有待于今后在细胞、基因水平进行更深层次的研究。
