白细胞介素-4负调控NF-κB通路抑制炎症反应的机制研究
2019-11-06黄洁媛刘文明
黄洁媛,刘文明
既往研究证实,炎症反应继发的免疫失衡是重症感染病理生理过程的重要特点,也是重症感染患者病情加重的重要原因[1]。肺部严重感染时极易诱发急性肺损伤,这与机体免疫防御机制过度激活、促炎/抑炎反应失衡和氧化应激损伤有关[2]。因此在抗感染的基础上,恢复促炎/抑炎反应平衡,阻断炎症级联反应是急性肺损伤早期治疗的关键。白细胞介素(interleukin,IL)-4是重要的抑炎细胞因子,由CD4+T细胞分泌,对淋巴细胞的迁移具有重要作用。既往已有研究证明,IL-4可以下调炎症反应强度,降低严重感染小鼠的死亡率[3],但是其抑炎机制目前尚未明了。髓样分化因子88(myeloid differentiation factor 88,MyD88)是Toll样受体信号通路中的重要接头分子,可以与核因子(NF)-κB形成炎症反应通路,导致NF-κB p65蛋白从细胞质转入细胞核,从而诱导 IL-1、IL-6、肿瘤坏死因子(tumor necrosis factor,TNF)-α等促炎细胞因子的转录和表达,放大炎症信号。MyD88/NF-κB信号通路在感染性疾病的发生和发展中占有重要地位[4-5]。已有研究证明,IL-4可以抑制IκB激酶(IKK)的活性,进而抑制NF-κB活化。另外,IL-4对NF-κB的作用不仅局限于下游水平,对上游也会造成影响[6-7]。因此笔者推测,IL-4可能作用于MyD88/NF-κB信号通路,进而影响NF-κB活性及p65蛋白的核移位以下调炎症反应。本研究以脂多糖(lipopolysaccharides,LPS)启动小鼠巨噬细胞株Ana-1的炎症反应,分析IL-4预处理对LPS诱导的巨噬细胞MyD88/NF-κB信号通路的影响,探讨IL-4抑制炎症的可能机制。
1 材料与方法
1.1主要材料和仪器 小鼠巨噬细胞Ana-1购自上海信裕生物科技有限公司(货号XY-M001);小鼠IL-4购自上海恒斐生物科技有限公司(货号130-097-760);DMEM培养基购自杭州仟诺生物科技有限公司;胎牛血清购自杭州四季青生物工程有限公司;兔抗鼠MyD88和NF-κB p65单克隆抗体购自上海生物工程有限公司;羊抗兔生物素化IgG购自北京中杉金桥公司;小鼠TNF-α和IL-6酶联免疫吸附法(ELISA)检测试剂盒购自上海哈灵生物科技公司;小鼠NF-κB p65 ELISA检测试剂盒购自上海酶联生物科技公司;胞浆和胞核蛋白提取试剂盒购于武汉博士德有限公司。ABI 7500实时荧光定量PCR仪(ABI),半干转印仪(Bio-Rad),垂直电泳仪(Bio-Rad),HBS-1096A酶标仪(南京德铁实验设备有限公司)。
1.2方法
1.2.1细胞培养和构建LPS±IL-4处理Ana-1细胞模型 Ana-1巨噬细胞采用DMEM培养基培养,内含10%灭活胎牛血清、100 U/mL链霉素和100 mg/L青霉素,37℃,5%CO2常规细胞培养,隔日换液。当细胞贴壁融合度达到90%以上时,用0.25%胰蛋白酶进行传代。传代细胞接种于6孔板(1×106个/孔)。取对数生长期的Ana-1巨噬细胞,将6孔板中的Ana-1细胞分为2组:分别为LPS组(给予50µg/L LPS刺激)、LPS+IL-4组(10µg/L IL-4预培养1 h后给予LPS刺激)。在0、0.5、1和2 h时收集细胞培养上清液,用于后续实验。
1.2.2RT-PCR检测MyD88、NF-κB mRNA表达水平 TRIzol法提取Ana-1巨噬细胞总RNA,按逆转录试剂盒说明将其逆转录为cDNA。以β-actin为内参,通过ABI 7500实时荧光定量PCR仪分别进行荧光定量PCR反应。引物由上海生工生物工程股份有限公司合成并提供,序列见表1。RT-PCR反应条件为:预变性95℃30 s;95℃5 s,60℃30 s,共计40个循环。每个样本至少重复3次。2-ΔΔCt法计算mRNA的相对表达量。
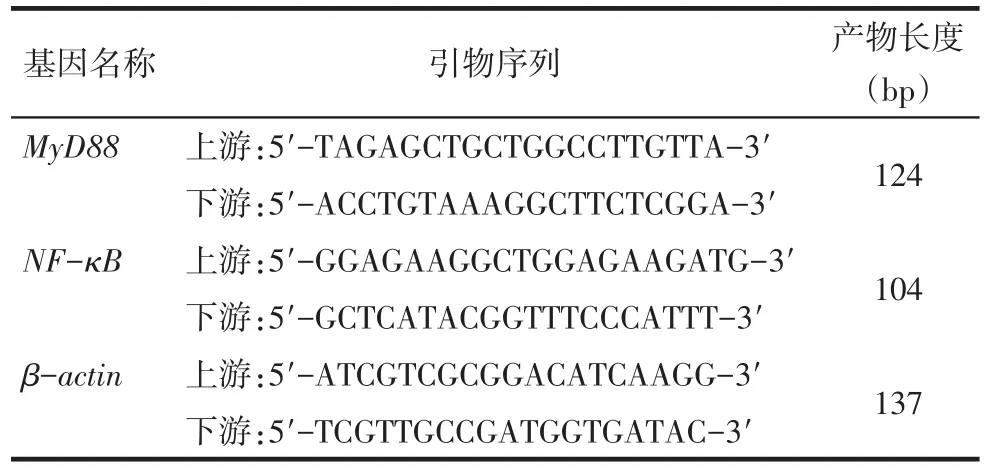
Tab.1 The primer sequence of MyD88,NF-κB and actin表1 RT-PCR引物序列
1.2.3Western blot检测MyD88和NF-κB蛋白表达水平 按照试剂盒说明书分别提取总蛋白、胞浆蛋白和胞核蛋白,BCA法进行蛋白定量。取20µL样品加入5×SDS缓冲液,煮沸5 min使蛋白变性。经十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后将蛋白转移至PVDF膜上,5%脱脂奶粉封闭1 h,孵育一抗(兔抗鼠MyD88或NF-κB p65单克隆抗体,1∶1 000),4 ℃过夜,弃去一抗,TBST洗膜3次,每次5 min。室温孵育二抗(羊抗兔生物素化IgG,1∶1 000)2 h,弃去二抗,TBST洗膜3次,每次5 min。ECL显色,同期以β-actin作内参。显影后通过Quantity One软件分析各条带,以各条带与内参吸光度的比值表示MyD88/NF-κB p65的相对表达量。
1.2.4ELISA检测NF-κB p65胞核/胞浆比例 按照试剂盒说明书分别提取胞浆蛋白和胞核蛋白,BCA法进行蛋白定量。按照NF-κB p65 ELISA检测试剂盒说明书分别检测NF-κB p65在细胞核及细胞浆中的含量,检测时波长设置为450 nm,并计算NF-κB p65胞核/胞浆比例。
1.2.5ELISA检测IL-6和TNF-α含量 收集各组细胞的培养液,3 000 r/min离心10 min,取上清液,按照TNF-α和IL-6 ELISA检测试剂盒说明书进行IL-6和TNF-α含量的检测,检测波长设置为450 nm。
1.3统计学方法 采用SPSS 17.0统计学软件进行数据分析。符合正态分布的计量数据以均数±标准差(±s)表示,2组不同时间点间比较采用重复测量设计的方差分析,同一时间点组间比较行t检验。P<0.05为差异有统计学意义。
2 结果
2.1IL-4对LPS活化的Ana-1细胞表达MyD88的影响 随着Ana-1细胞培养时间的延长,LPS组MyD88 mRNA和蛋白表达水平均呈逐渐升高趋势(P<0.05)。而LPS+IL-4组MyD88 mRNA表达水平无明显变化(P>0.05),MyD88蛋白表达水平则呈先升高后下降趋势(在0.5 h时最高,2 h时下降至最低)。LPS+IL-4组MyD88 mRNA和蛋白表达水平在0 h和0.5 h时与LPS组差异无统计学意义(P>0.05),在1 h和2 h时显著低于LPS组(P<0.05)。见图1、表2。
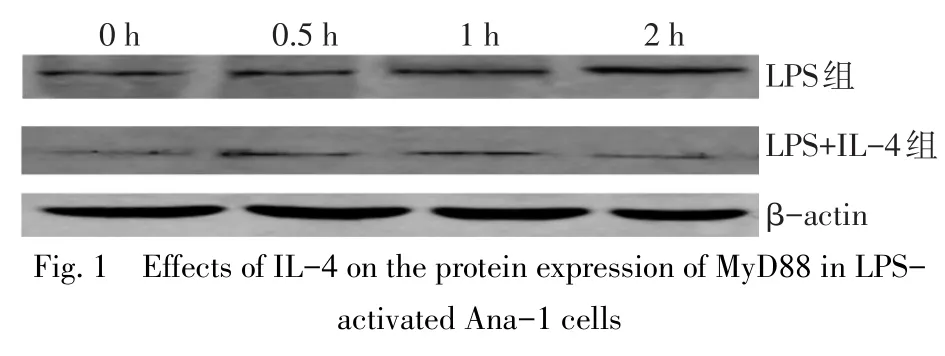
图1 IL-4对LPS活化的Ana-1细胞表达MyD88蛋白的影响
2.2IL-4对LPS活化的Ana-1细胞NF-κB表达的影响 随着Ana-1细胞培养时间的延长,无论是LPS组还是LPS+IL-4组,NF-κB mRNA和蛋白表达水平均呈现明显升高趋势(P<0.05)。而2组不同时间点NF-κB mRNA和蛋白表达水平比较差异均无统计学意义(P>0.05)。见图2、表3。
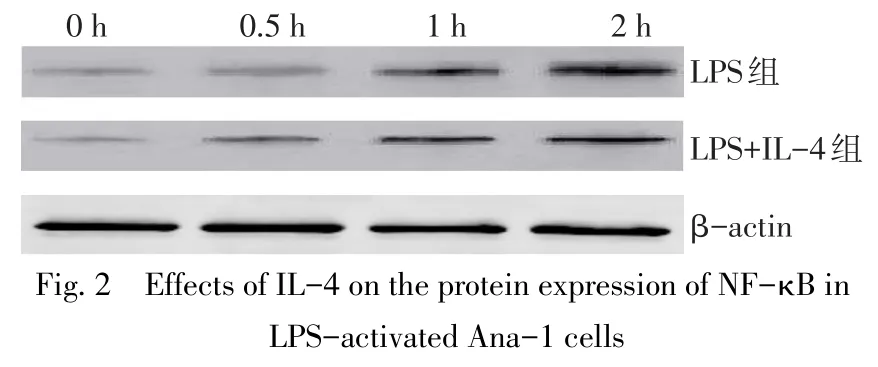
图2 IL-4对LPS活化的Ana-1细胞表达NF-κB蛋白的影响
Tab.2 Effects of IL-4 on the mRNA and protein expression of MyD88 in LPS-activated Ana-1 cells表2 IL-4对LPS活化的Ana-1细胞表达MyD88 mRNA和蛋白的影响 (n=5,±s)

Tab.2 Effects of IL-4 on the mRNA and protein expression of MyD88 in LPS-activated Ana-1 cells表2 IL-4对LPS活化的Ana-1细胞表达MyD88 mRNA和蛋白的影响 (n=5,±s)
*P<0.05;a与0 h比较,b与0.5 h比较,c与1 h比较,P<0.05
组别LPS组LPS+IL-4组t MyD88 mRNA 0 h 1.30±0.34 1.26±0.48 0.152 0.5 h 1.68±0.12 1.72±0.43 0.200 1 h 2.14±0.30a 1.52±0.21 3.786*2 h 2.67±0.43ab 1.21±0.14 3.063*F 10.372*1.415 MyD88蛋白(%)0 h 7.36±0.61 7.29±1.01 0.133 0.5 h 15.37±0.44a 16.01±0.84a 1.509 1 h 17.00±0.81ab 12.64±0.32ab 11.942*2 h 19.37±1.24abc 7.01±0.97abc 17.555*F 117.998*82.627*
Tab.3 Effects of IL-4 on the mRNA and protein expression of NF-κB in LPS-activated Ana-1 cells表3 IL-4对LPS活化的Ana-1细胞表达NF-κB mRNA和蛋白的影响 (n=5,±s)
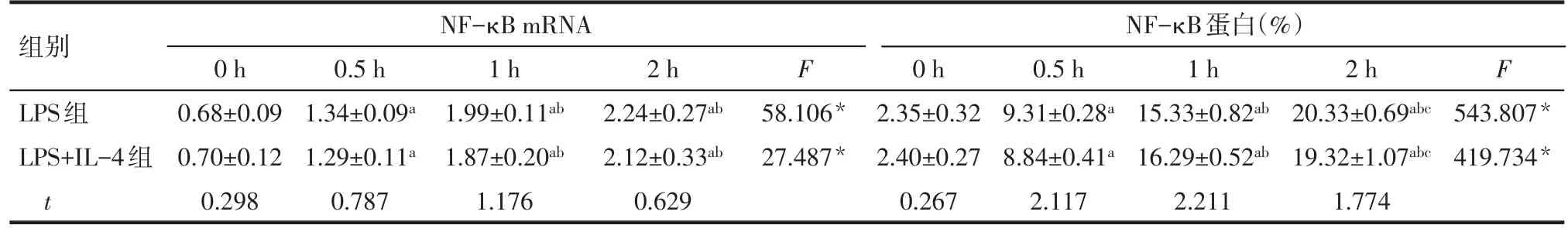
Tab.3 Effects of IL-4 on the mRNA and protein expression of NF-κB in LPS-activated Ana-1 cells表3 IL-4对LPS活化的Ana-1细胞表达NF-κB mRNA和蛋白的影响 (n=5,±s)
*P<0.05;a与0 h比较,b与0.5 h比较,c与1 h比较,P<0.05
组别LPS组LPS+IL-4组t NF-κB mRNA 0 h 0.68±0.09 0.70±0.12 0.298 0.5 h 1.34±0.09a 1.29±0.11a 0.787 1 h 1.99±0.11ab 1.87±0.20ab 1.176 2 h 2.24±0.27ab 2.12±0.33ab 0.629 F 58.106*27.487*NF-κB蛋白(%)0 h 2.35±0.32 2.40±0.27 0.267 0.5 h 9.31±0.28a 8.84±0.41a 2.117 1 h 15.33±0.82ab 16.29±0.52ab 2.211 2 h 20.33±0.69abc 19.32±1.07abc 1.774 F 543.807*419.734*
2.3NF-κB p65胞核/胞浆比例变化 随着Ana-1细胞培养时间的延长,LPS组NF-κB p65胞核/胞浆比例呈逐渐上升的趋势(P<0.05);而LPS+IL-4组呈先上升后下降的趋势(P<0.05)。LPS+IL-4组NF-κB p65胞核/胞浆比例在0 h和0.5 h时与LPS组差异无统计学意义(P>0.05),在1 h和2 h时明显低于LPS组(P<0.05),见表4。
2.4IL-4对LPS诱导的IL-6和TNF-α水平的影响 随着Ana-1细胞培养时间的延长,LPS组IL-6和TNF-α水平呈逐渐升高的趋势(P<0.05);LPS+IL-4组则呈先升高后下降的趋势(P<0.05)。LPS+IL-4组IL-6和TNF-α水平在0 h和0.5 h时与LPS组差异无统计学意义(P>0.05),在1 h和2 h时明显低于LPS组(P<0.05),见表5。
Tab.4 Changes of nuclear/cytoplasmic ratio of NF-κB p65表4 NF-κB p65胞核/胞浆比例变化 (n=5,±s)
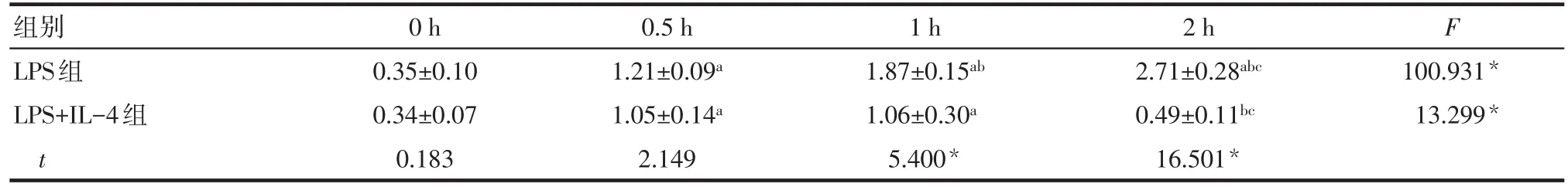
Tab.4 Changes of nuclear/cytoplasmic ratio of NF-κB p65表4 NF-κB p65胞核/胞浆比例变化 (n=5,±s)
*P<0.05;a与0 h比较,b与0.5 h比较,c与1 h比较,P<0.05
组别LPS组LPS+IL-4组t 0 h 0.35±0.10 0.34±0.07 0.183 0.5 h 1.21±0.09a 1.05±0.14a 2.149 1 h 1.87±0.15ab 1.06±0.30a 5.400*2 h 2.71±0.28abc 0.49±0.11bc 16.501*F 100.931*13.299*
Tab.5 Effects of IL-4 on the levels of IL-6 and TNF-α in LPS-activated Ana-1 cells表5 IL-4对LPS诱导的Ana-1细胞中IL-6和TNF-α蛋白表达水平的影响 (ng/L,n=5,±s)

Tab.5 Effects of IL-4 on the levels of IL-6 and TNF-α in LPS-activated Ana-1 cells表5 IL-4对LPS诱导的Ana-1细胞中IL-6和TNF-α蛋白表达水平的影响 (ng/L,n=5,±s)
*P<0.05;a与0 h比较,b与0.5 h比较,c与1 h比较,P<0.05
组别LPS组LPS+IL-4组t IL-6 0 h 60.21±22.58 60.08±18.37 0.01 0.5 h 193.26±17.68a 189.47±24.31a 0.282 1 h 245.36±22.58ab 164.21±15.24a 6.665*2 h 276.34±26.00ab 142.36±18.67ab 9.359*F 56.847*24.972*TNF-α 0 h 47.25±8.31 46.85±6.37 0.085 0.5 h 211.64±24.80a 208.36±30.33a 0.187 1 h 298.31±40.02ab 176.34±18.64a 6.155*2 h 381.11±21.22abc 163.24±14.08ab 19.13*F 89.495*39.592*
3 讨论
抗炎细胞因子IL-4主要由CD4+T细胞产生的,可以促进T淋巴细胞活性并增强巨噬细胞吞噬功能。研究表明,IL-4对B细胞、T细胞、肥大细胞和单核巨噬细胞都有免疫调节作用[8]。有研究发现,重症肺炎患者血清中IL-4水平明显升高,提示IL-4可能参与了机体的抗炎过程[9-10],但其具体抗炎机制尚未明确。
本研究采用LPS刺激Ana-1细胞以激活NF-κB炎症信号通路,结果显示,在LPS的诱导下,小鼠炎症反应细胞模型建立成功:MyD88和NF-κB的mRNA和蛋白表达水平均明显升高,NF-κB p65蛋白核移位增加,同时上调了细胞中IL-6和TNF-α的表达,这与以往文献报道的LPS诱导发生的炎症反应表现一致[11-12]。Toll样受体4(TLR4)/NF-κB信号通路是LPS胞内信号转导的关键途径。LPS通过与TLR4结合,从而诱导TLR4聚合使得信号转导至胞内,胞内TIR区与MyD88的羧基端结合,同时MyD88通过氨基端的死亡域与白细胞介素1受体相关激酶(IRAK)的死亡结构域结合,激活IRAK的自身磷酸化,获得游离的IRAK继而激活肿瘤坏死因子受体相关因子-6(TRAF-6),TRAF-6激活NF-κB二聚体的抑制蛋白家族(IκB)激酶(IKKs)。IκB由于磷酸化、泛素化后降解,使得NF-κB从静息状态下受IκB结合处于的抑制状态解除,进而导致NF-κB p65转入细胞核中诱导基因转录,启动IL-6、TNF-α等促炎细胞因子基因的表达[13-15]。
Lai等[16]研究显示,IL-4可通过抑制炎症细胞因子的基因转录,影响其mRNA的稳定性,进而下调炎症细胞因子的表达。本研究通过加入IL-4进行干预LPS诱导的炎症反应细胞模型,结果显示,在IL-4干预下,MyD88的mRNA和蛋白表达水平呈先升高后下降的趋势,提示LPS诱导下NF-κB激活导致p65入核增加,使得NF-κB p65胞核/胞浆比例增高;在IL-4的干扰下,进入胞核的p65蛋白减小,活化受到抑制,从而导致NF-κB p65胞核/胞浆比例的下调。
此外,本研究结果显示,在IL-4的干扰下,促炎细胞因子IL-6和TNF-α表达水平也随之出现逆转。而IL-4作用下的TLR4/NF-κB信号通路中只有MyD88发生显著变化,提示IL-4可能通过抑制MyD88而下调NF-κB活性,从而影响IL-6和TNF-α的表达,抑制LPS启动的炎症反应。MyD88作为TLR4/NF-κB信号通路中的关键接头分子,已有研究表明在MyD88基因敲除小鼠中,LPS并不能使血清中IL-6和TNF-α水平增加[17],提示MyD88在LPS诱导产生炎症反应中发挥着重要作用,而本研究结果进一步提示IL-4可能作用于MyD88而参与抗炎反应。
综上,本研究通过构建IL-4干扰的LPS诱导炎症反应细胞模型,发现IL-4可以逆转由于LPS诱导的促炎细胞因子IL-6和TNF-α的表达上调,可能具有抗炎作用。此外通过检测MyD88/NF-κB信号通路中MyD88和NF-κB的表达和NF-κB p65的核移位,发现IL-4参与的抗炎机制可能与该通路中MyD88的表达下调及NF-κB p65蛋白的核移位有关。但其具体机制还需要进一步研究。
