可可碱、茶碱和咖啡碱的快速测定及其色谱保留行为
2019-10-29聂吉语汤书华姜子涛
聂吉语,李 荣,*,王 颖,汤书华,谭 津,包 荣,姜子涛,2,*
(1.天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134;2.天津天狮学院食品工程学院,天津 301700)
生物碱是一类于植物体内广泛存在的含氮杂环的碱性天然有机物,其中绝大部分具有重要的医疗价值[1-5]。可可碱、茶碱和咖啡碱是天然甲基黄嘌呤类生物碱,具有能够使中枢神经系统、心脏和骨骼肌兴奋,血管达到舒张状态、平滑肌得到松弛和利尿等生理作用[6]。三者母体结构相同,但甲基取代基的位置和数目存在差异。可可碱与茶碱分别为3,7位和1,3位的二甲基取代,二者为同分异构体,而咖啡碱为1,3,7位的三甲基取代。作为一类具有显著生物活性作用的生物碱,可可碱、茶碱和咖啡碱普遍存在于茶叶、咖啡、可可和糖果等食品中[7-8]。近年来,其制品在食品工业中更是得到了广泛应用,并且国标中明确规定咖啡碱可用于可乐型饮料。但如果对以上3 种物质的摄入量未加控制而过量食用,则会产生一定的毒副作用[9-11],因此建立一种简便、快速检测可可碱、茶碱和咖啡碱的方法非常必要。
高效液相色谱(high performance liquid chromatography,HPLC)法是测定可可碱、茶碱和咖啡碱的最常用的方法[12-14],检测一般采用C18反相色谱柱[15-18]。王增盛[19]采用μ Bondapak C18柱,以N-二甲基甲酰胺、甲醇、冰醋酸溶液为流动相,同时测定了茶叶中的咖啡碱、茶碱和可可碱的含量;梁燕妮[20]采用C18柱,以甲醇和水为流动相,梯度洗脱测定了不同厂家六堡茶中可可碱、茶碱、咖啡碱的含量;刘志彬等[21]采用Symmetry C18柱,以乙腈和乙酸溶液为流动相,梯度洗脱测定了10 种典型武夷岩茶叶片及冲泡茶汤中可可碱、茶碱和咖啡碱的含量;陈静等[22]采用Unitary C18柱,以甲醇和0.5%甲酸溶液为流动相,同时测定了可可碱和咖啡碱的含量。
以上报道中虽可同时检测1~3 种生物碱,但流动相条件复杂,含有酸或盐且需要调节pH值,以及需要梯度洗脱等。这些分离分析方法均建立在以硅胶为基质的色谱柱基础上,其游离的硅羟基会导致非特异性吸附,可可碱、茶碱和咖啡碱等一些极性较强的生物碱色谱峰会严重拖尾,甚至会因强吸附而不能洗脱[23],从而使分离效率降低,同时使色谱柱的使用寿命大幅缩短。而作为近年发展起来的新型色谱填料,钛胶基质固定相既可以作为Lewis酸,也可以作为Lewis碱,较传统的硅胶基质固定相优势明显。并且其不存在硅胶固定相的“第2效应”,同时在pH 1~14范围内均非常稳定,对生物样品中带有磷酸基团的物质还具有特殊的吸附能力,分离选择性也很高,而硅胶固定相则仅适用于pH 3~9的范围内。
本实验采用钛胶基质色谱固定相建立的反相HPLC可同时分离,分析结构相似的3 种生物碱——可可碱、茶碱和咖啡碱,该法流动相成分简单且不含盐,仅为5%甲醇溶液,且采用等度洗脱,检测效率高、分离灵敏度高、检出限低、稳定性好。将此法应用于6 种饮料样品中可可碱、茶碱和咖啡碱的测定,在重复性、回收率等方面均表现优异,结果令人满意。另外,本实验也研究了3 种生物碱保留的熵、焓和吉布斯自由能,从热力学的角度探讨3 种生物碱在HPLC上的保留行为。
1 材料与方法
1.1 材料与试剂
可可碱标准品(99%)、茶碱标准品(99%)、咖啡碱标准品(99%) 上海源叶生物科技有限公司;甲醇(色谱级) 美国Sigma公司;6 种饮料样品 市购。
1.2 仪器与设备
1200系列HPLC仪 美国安捷伦公司;Sachtopore-RP色谱柱(250 mm×4.6 mm,5 μm,300 Å) 美国Zirchrom公司;Lambda 25紫外-可见分光光度计 珀金埃尔默仪器有限公司;H2050R-1离心机 长沙湘仪离心机仪器有限公司;AUY120万分之一天平 日本岛津公司。
1.3 方法
1.3.1 标准溶液的配制
1.0 mg/mL可可碱标准储备液:准确称取0.100 0 g可可碱标准品,用超纯水溶解并定容至100 mL容量瓶中;2.0 mg/mL茶碱标准储备液:准确称取0.100 0 g茶碱标准品,用超纯水溶解并定容至50 mL容量瓶中;3.0 mg/mL咖啡碱标准储备液:准确称取0.150 0 g咖啡碱标准品,用超纯水溶解并定容至50 mL容量瓶中,以上各储备液均置于4 ℃冰箱保存备用。
1.3.2 样品处理
饮料样品:准确量取5 mL已提前超声脱气20 min的样品,稀释2 倍,过0.45 μm微孔滤膜,进行HPLC分析。固体饮料样品:准确称取0.500 0 g样品,加水溶解并转移至25 mL容量瓶中定容,在60 ℃条件下采用超声波提取30 min,随后在4 000 r/min条件下离心10 min,上清液过0.45 μm微孔滤膜,进行HPLC分析。
1.3.3 色谱条件
流动相为水-甲醇(95∶5,V/V),等梯度洗脱;流速1.0 mL/min;进样量20 μL;检测波长273 nm;柱温60 ℃。
1.3.4 标准曲线的绘制
将可可碱的标准储备液稀释至500、100、50、20、10 μg/mL和5
μg/mL,茶碱的标准储备液稀释至1 000、500、100、50、20、10 μg/mL和5 μg/mL,咖啡碱的标准储备液稀释至1 200、600、120、60、24、12 μg/mL和6 μg/mL,取20 μL进行HPLC分析,以各标准品的质量浓度(μg/mL)为横坐标,色谱峰的峰面积为纵坐标绘制标准曲线,计算回归方程。不同质量浓度的混合标准溶液由上述各标准溶液以相似水平配制而成,质量浓度由低到高依次编号为1~7。
1.3.5 热力学参数的测定
参考文献[23-25],并按照1.3.3节色谱条件分别在30、45、50、55 ℃和60 ℃测定可可碱、茶碱和咖啡碱的热力学参数。
2 结果与分析
2.1 流动相中甲醇比例的确定
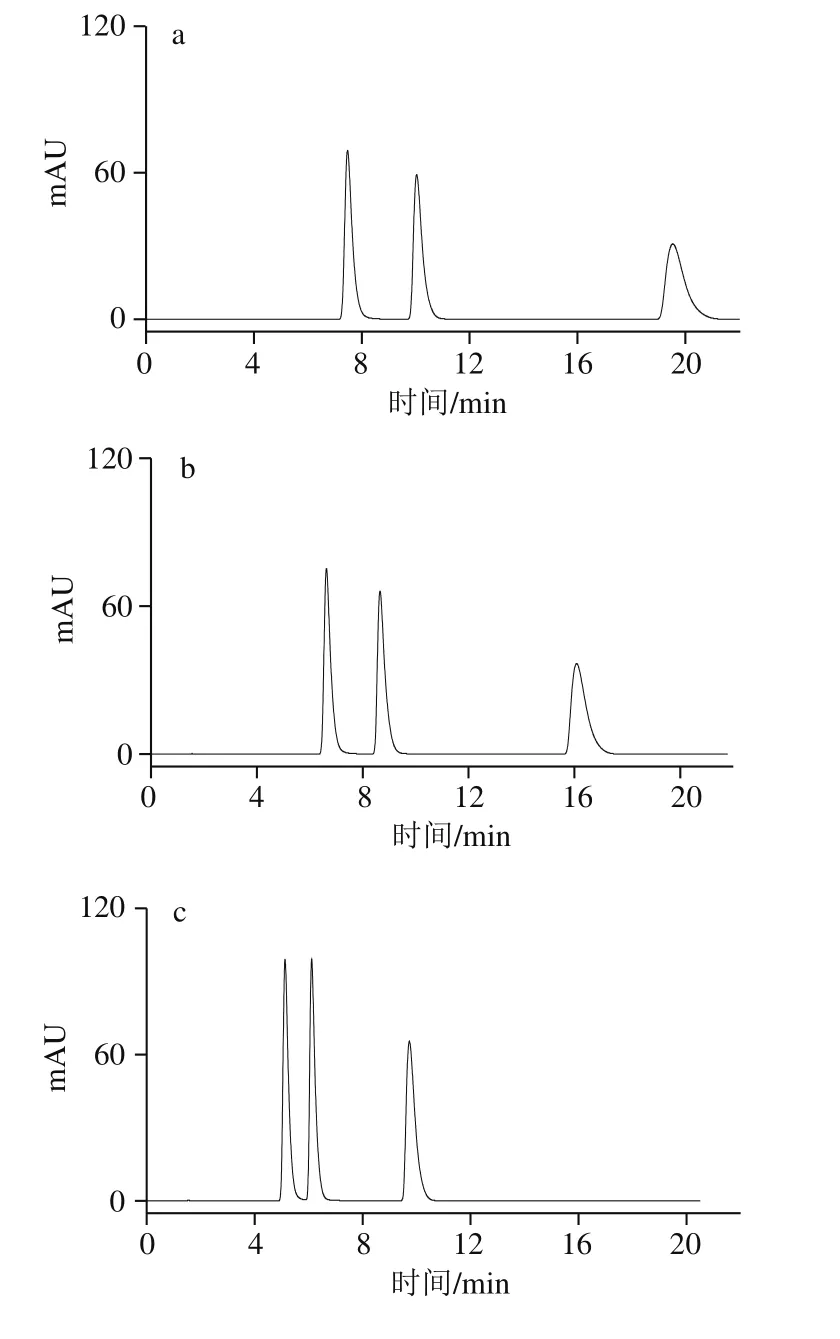
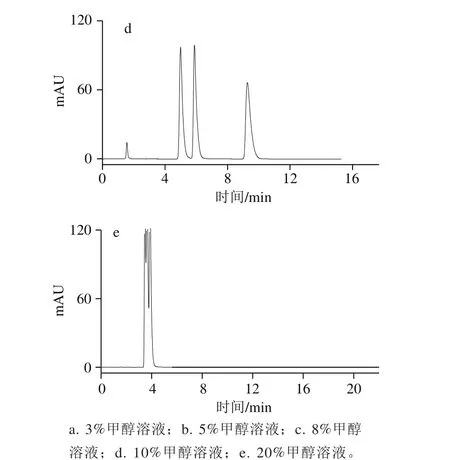
图1 不同体积分数甲醇溶液的HPLC图Fig. 1 HPLC profiles with different proportions of methanol in mobile phase
本实验中流动相仅为甲醇和水,配制甲醇溶液体积分数分别为3%、5%、8%、10%和20%,按照1.3.3节色谱条件进样分析,如图1所示。随着流动相中甲醇溶液体积分数的增大,流动相的极性变小,可可碱、茶碱和咖啡碱的保留时间也逐渐减小。保留时间短,虽然能够使分析速度加快,但3 种生物碱的分离效果也会发生比较大的变化。当甲醇溶液体积分数为8%和10%时,可可碱和茶碱的分离度减少,当甲醇溶液体积分数达到20%时,可可碱、茶碱和咖啡碱三者已经不能实现完全分离。且它们的保留时间仅有4 min左右,较短的保留时间容易造成样品制备过程中的杂质、保留较弱的非极性或弱极性物质对实验结果产生干扰。但当甲醇溶液体积分数过低,仅为3%时,咖啡碱的保留时间与前两者相比又过长,浪费分离时间,且存在溶质峰展宽的现象。因此,最终选择流动相中甲醇溶液体积分数为5%,可达到各物质在基线分离的情况下,保留时间相对较短。
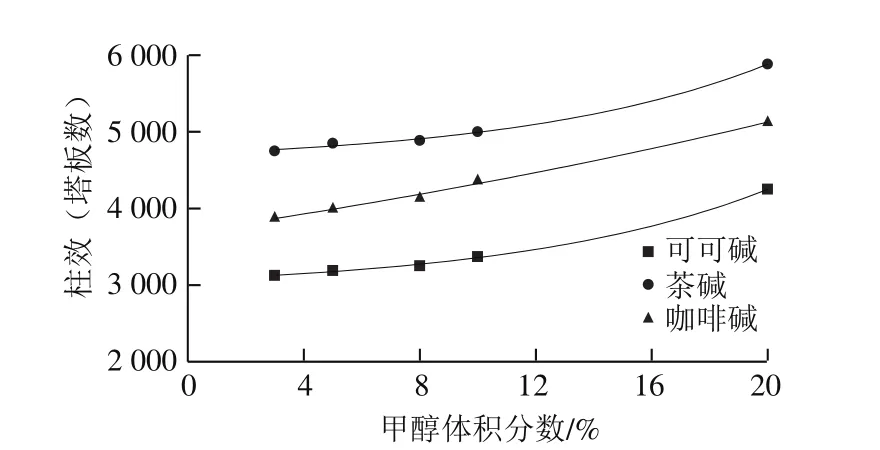
图2 甲醇体积分数对柱效的影响Fig. 2 Effect of methanol proportion in mobile phase on number of plates
随着流动相中甲醇溶液体积分数的增大,半峰宽也随之减小(图1),在同一保留时间下,半峰宽越小,柱效越高[26-27]。如图2所示,随着甲醇体积分数的增大,3 种碱的柱效也随之增大;在同一甲醇体积分数下,柱效由大到小为茶碱>咖啡碱>可可碱。
2.2 柱温的影响
2.2.1 柱温的选择
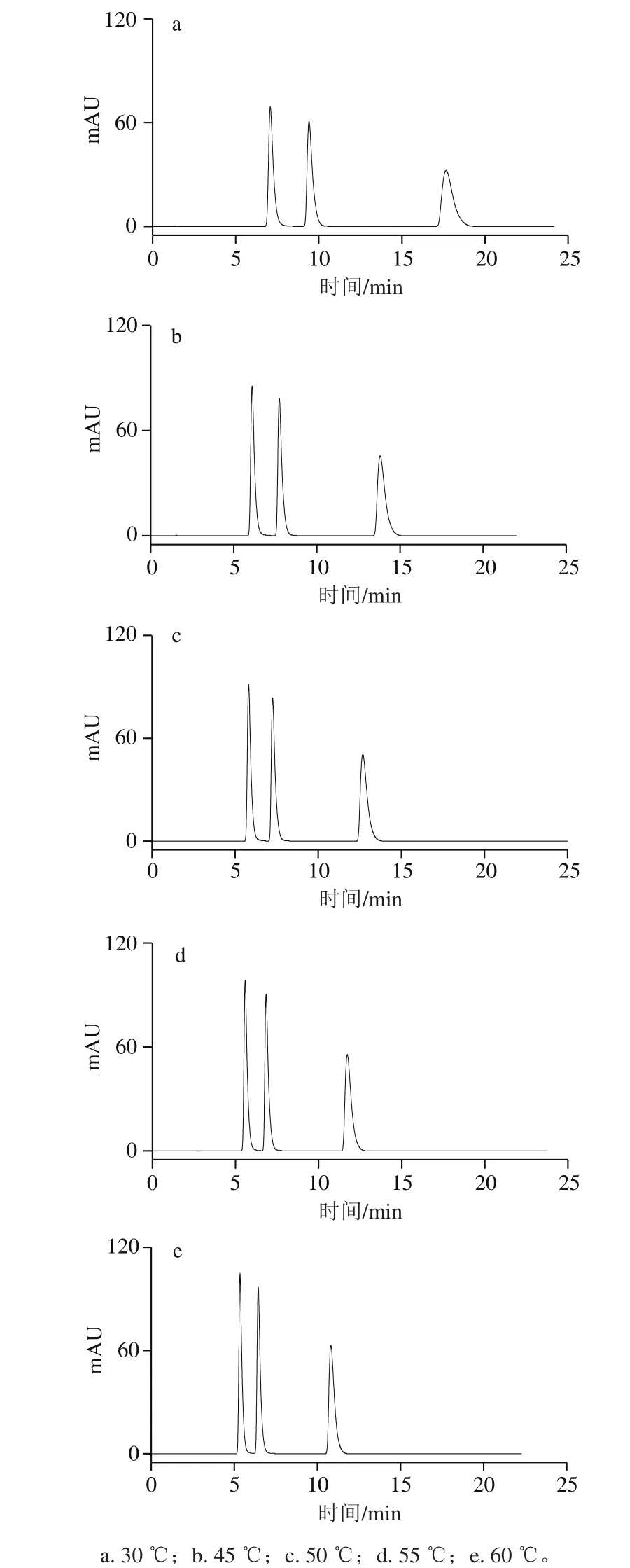
图3 不同柱温HPLC图Fig. 3 HPLC profiles at different column temperatures
按照1.3.3节色谱条件,分别调节柱温为30、45、50、55 ℃和60 ℃进样分析,如图3所示。柱温对可可碱、茶碱和咖啡碱3 种物质的保留时间和分离度也有较大的影响,但柱温对三者的影响稍低于流动相中甲醇溶液体积分数的影响。随着柱温的升高,3 种物质的保留时间也越来越小,可可碱和茶碱的保留时间减小幅度不大,咖啡碱的保留时间减少明显,说明它们在钛胶反相色谱柱上的保留过程是放热的,且热效应也有所不同。同时,增加柱温可以减小柱压,峰形变好,在60 ℃以上,钛胶柱更能发挥其优良的色谱性能,然而甲醇的沸点(64.5 ℃)限制本研究最终选择柱温为60 ℃而不宜更高。
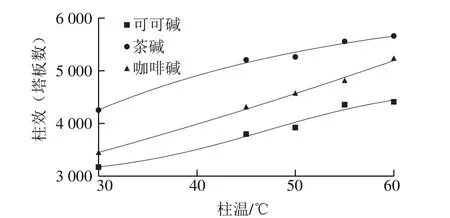
图4 柱温对柱效的影响Fig. 4 Effect of column temperature on number of plates
随着柱温的升高,可可碱、茶碱和咖啡碱的半峰宽呈减小趋势,表明柱效不断提高。如图4所示,随着柱温的升高,3 种碱的柱效也随之增大;在同一柱温下,柱效由大到小为茶碱>咖啡碱>可可碱。
2.2.2 热力学参数测定结果
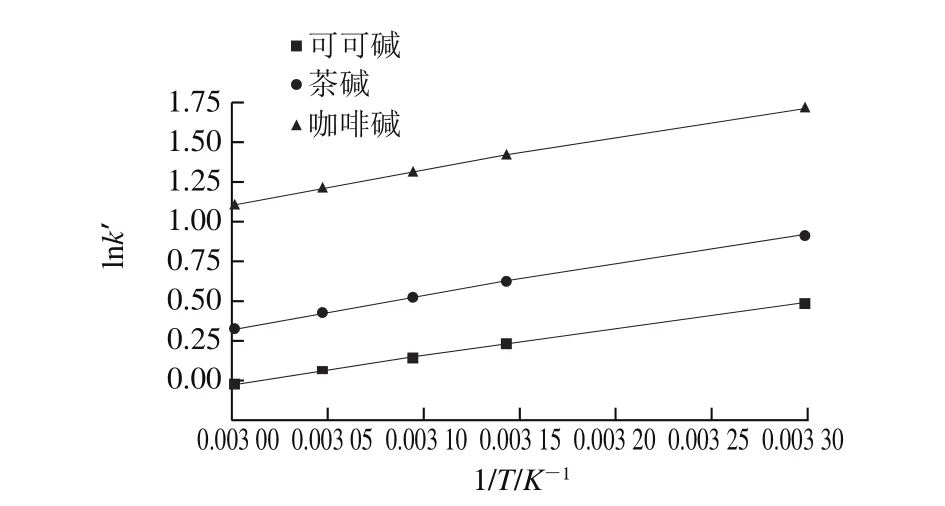
图5 不同柱温可可碱、茶碱和咖啡碱的Van’t Hoff曲线Fig. 5 Van’t Hoff plots for theobromine, theophylline and caffeine at different column temperatures

表1 可可碱、茶碱和咖啡碱的回归参数Table 1 Regression parameters for theobromine, theophylline and caffeine
按照1.3.5节方法在30~60 ℃条件下对可可碱、茶碱和咖啡碱进行分析,如图5和表1、2所示。由图5和表1可知,在不同温度下,可可碱、茶碱和咖啡碱在钛胶色谱柱上的分离效果呈现良好线性,表明在本实验所选定的温度范围内其在钛胶柱上具有一致的分离机制。

表2 可可碱、茶碱和咖啡碱在333.15 K的熵、焓和吉布斯自由能Table 2 Standard entropy (ΔS0), enthalpy (ΔH0) and Gibbs free energy(ΔG0) of theobromine, theophylline and caffeine at 333.15 K
钛胶色谱柱对可可碱、茶碱和咖啡碱的分离是由ΔG0决定的,而ΔG0又与ΔH0和ΔS0有关。由表2可知,3 种生物碱的ΔH0和ΔS0均为负值,又根据文献[25]可知:当ΔG0为正值时,表明主要由ΔS0来驱动分析物的保留行为;当ΔG0为负值时,说明此时ΔH0在它们的保留行为中起主要作用。
熵代表了体系的混乱程度,当分析物被固定相吸附时体系混乱度较小,因为此时被吸附的物质倾向于较整齐的排列;而当分析物从固定相上解吸下来时,此时被吸附的物质趋向于做杂乱无章的布朗运动,因此体系混乱度增大[28]。由表2可以看出,3 种生物碱吸附与解吸的总熵变ΔS0为负值,并且ΔS0的顺序为茶碱<可可碱<咖啡碱,说明在解吸过程中茶碱的混乱度减少最多导致其最不易被解吸,从熵变角度表明茶碱的吸附能力最强,咖啡碱的吸附能力最弱,保留顺序为咖啡碱、可可碱、茶碱。
焓代表了体系的热效应,当体系为吸热过程,焓值升高;当体系为放热过程,焓值降低。由表2可以看出,3 种生物碱的总焓变ΔH0为负值,说明溶质在HPLC中的保留过程为放热过程[29-30],即吸附的贡献大于解吸的贡献,并且ΔH0的顺序为咖啡碱<茶碱<可可碱,从焓变角度表明咖啡碱的吸附能力最强,可可碱的吸附能力最弱,保留顺序为可可碱、茶碱和咖啡碱。
当分析物从流动相进入固定相为热力学自发过程时ΔG0为负值,ΔG0越小,表明分析物越容易从流动相转移到固定相中,即分析物在固定相上的保留会相对更强。可可碱、茶碱和咖啡碱的ΔG0均为负值,且依次减小,即咖啡碱在固定相中保留最强,茶碱次之,可可碱保留最弱,这也说明3 种碱在钛胶固定相中的保留行为是由焓变ΔH0驱动的,实验结果也表明焓变的数值远大于熵变的数值,从热力学角度阐明了分析物的保留机理。
2.3 流速的选择
考察流速分别为0.5、0.8、1.0、1.2 mL/min和1.4 mL/min时的影响,按照方法1.3.3节色谱条件进样分析,如图6所示。流动相的流速对化合物的保留时间有较大影响。随着流速的增大,可可碱、茶碱和咖啡碱的色谱峰前移,保留时间均缩短,同时其半峰宽也变小。而对于分离度而言,在5 种流速下,3 种生物碱均达到了完全分离,即分离度大于1.5。当流速小于1.0 mL/min时,保留时间过长;但当流速达到1.2 mL/min特别是1.4 mL/min时,可可碱的保留时间偏小,同时在增大流速时会导致柱压明显增加,从而大大降低色谱柱的使用寿命,不利于色谱仪的正常使用。因此,流动相的流速最终确定为1.0 mL/min。
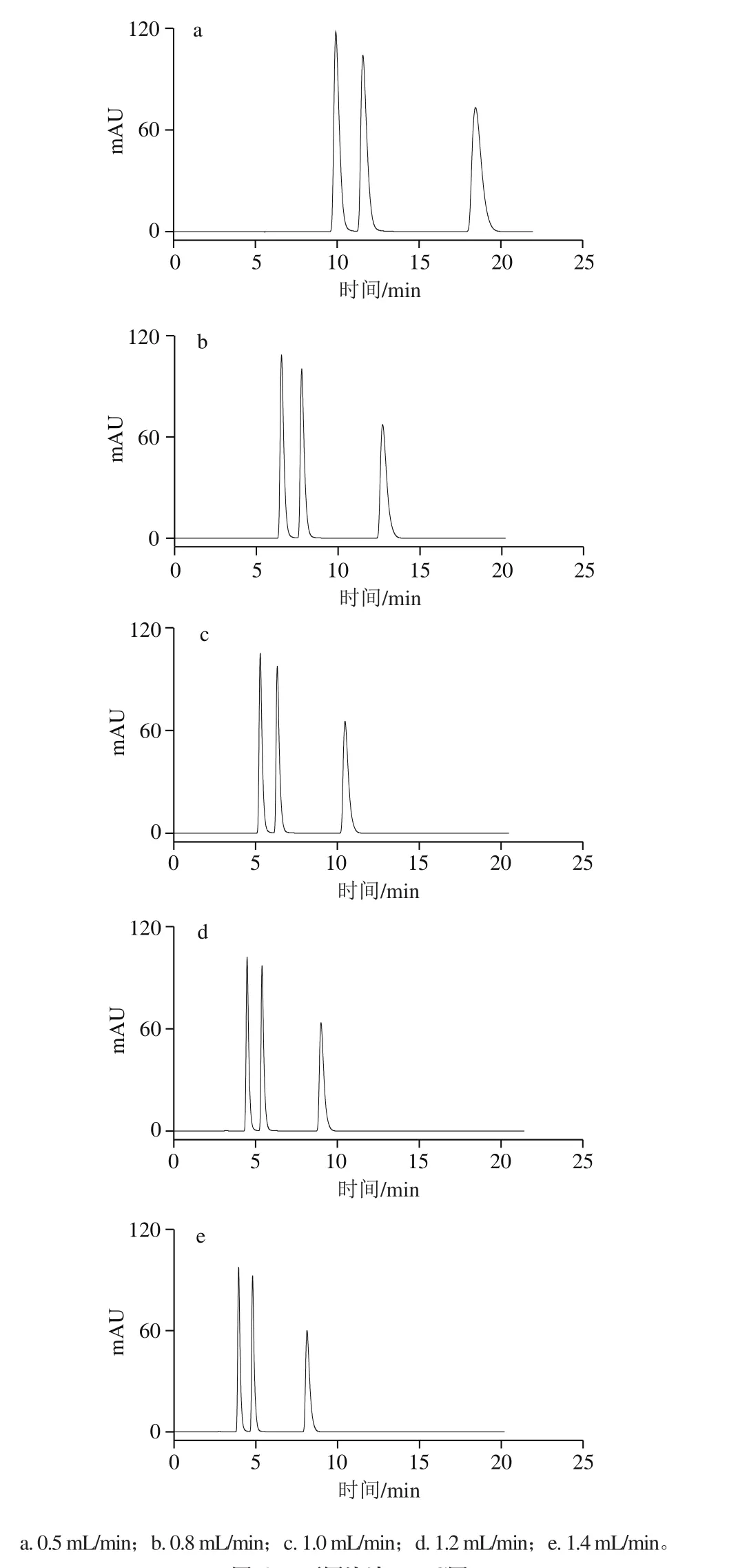
图6 不同流速HPLC图Fig. 6 HPLC pro fi les at different flow rates
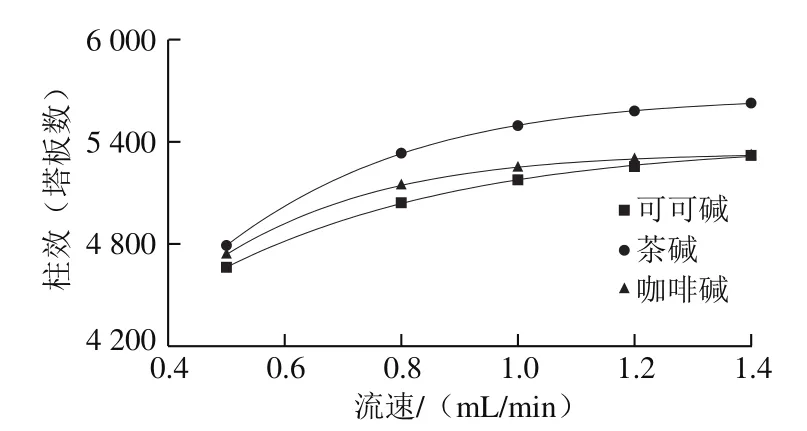
图7 流速对柱效的影响Fig. 7 Effect of flow rate on number of plates
同样,在流速不断增大的情况下,理论塔板数也不断升高,即柱效呈现增大的趋势。如图7所示,在同一流速下,柱效由大到小为茶碱>咖啡碱>可可碱(1.4 mL/min除外);在流速为1.4 mL/min时,可可碱和咖啡碱的柱效几乎一致。
综合考虑以上因素,最终确定HPLC分离分析可可碱、茶碱和咖啡碱的最佳条件为流动相水-甲醇(95∶5,V/V),柱温60 ℃,流速1.0 mL/min,检测波长273 nm,在此条件下三者混标与单标的HPLC图见图8。
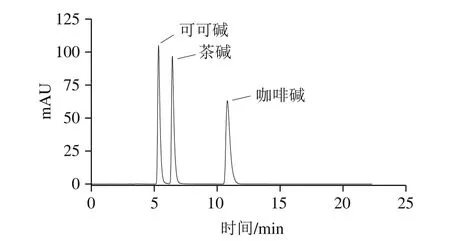
图8 可可碱、茶碱和咖啡碱的HPLC图Fig. 8 HPLC profiles of theobromine, theophylline and caffeine
2.4 检出限及线性范围结果
按照1.3.4节方法进行实验,测定可可碱、茶碱和咖啡碱的线性范围。结果显示,可可碱、茶碱和咖啡碱三者分别在质量浓度范围为5~500、5~1 000 μg/mL和6~1 200 μg/mL时,标准曲线线性良好,其回归方程、相关系数和检出限如表3所示。
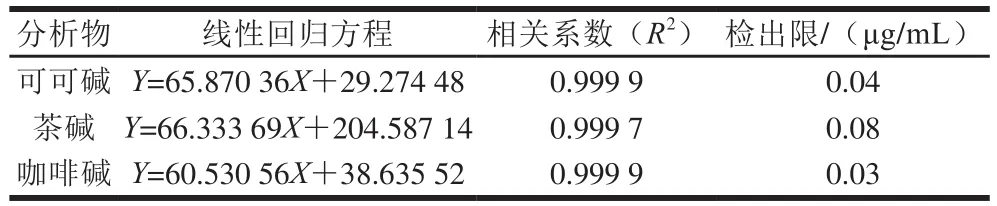
表3 可可碱、茶碱和咖啡碱的线性回归方程、相关系数和检出限Table 3 Linear regression equations, correlation coefficients and LODs of theobromine, theophylline and caffeine
2.5 方法精密度和准确度结果
从1.3.4节中选取3号和4号混合标准溶液在最优色谱条件下重复进样9 次,计算得相对标准偏差即精密度小于0.23%。将可可碱、茶碱和咖啡碱加入需要测定的6 个饮料样品中进行加标回收实验,如表4所示,6 种样品的色谱图见图9。由表4可知,可可碱、茶碱和咖啡碱的回收率范围分别为99.0%~102.0%、96.7%~106.7%和99.4%~102.3%。由图9可知,本法可实现对可可碱、茶碱和咖啡碱的同时分离检测。
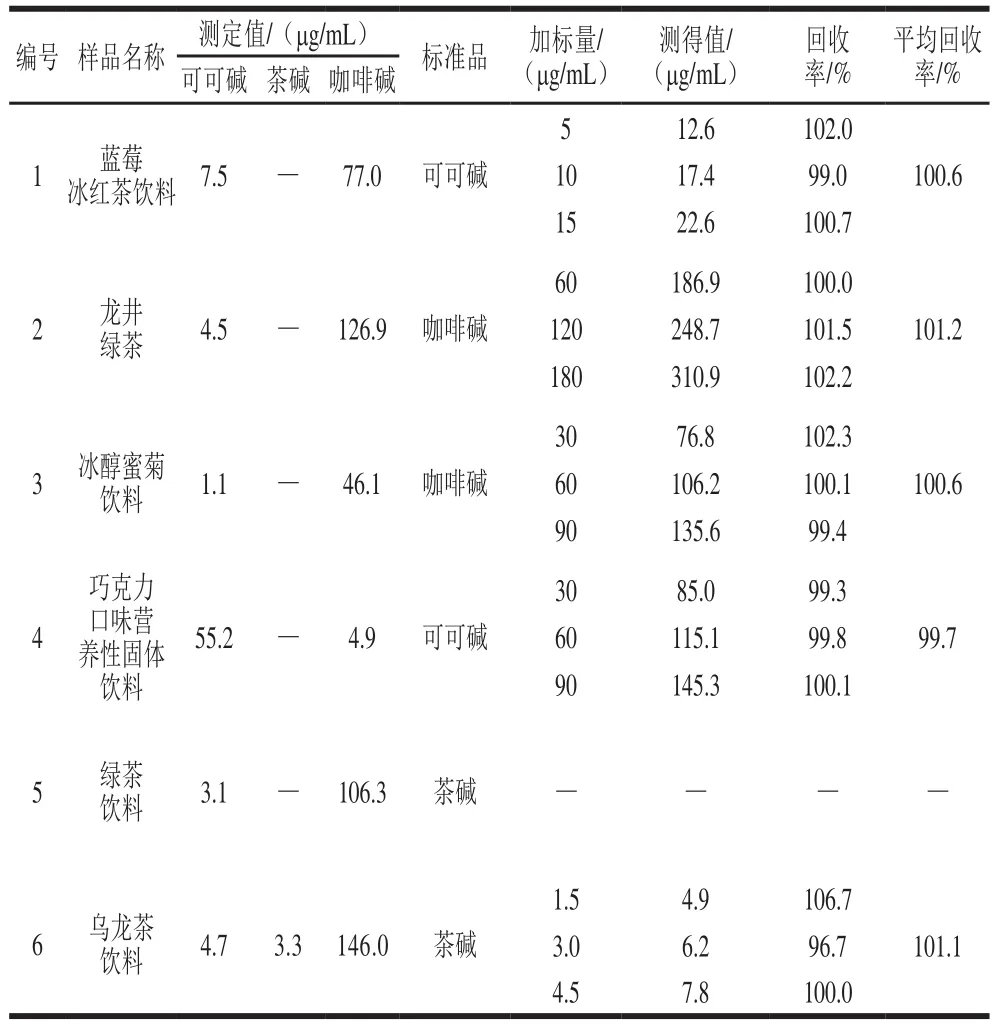
表4 实验结果和回收率Table 4 Results and recoveries
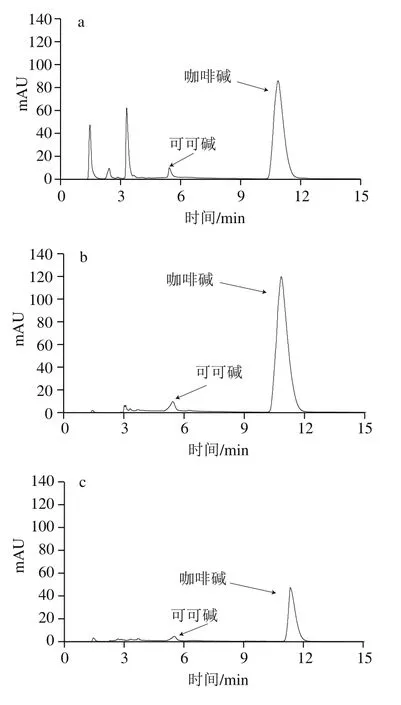
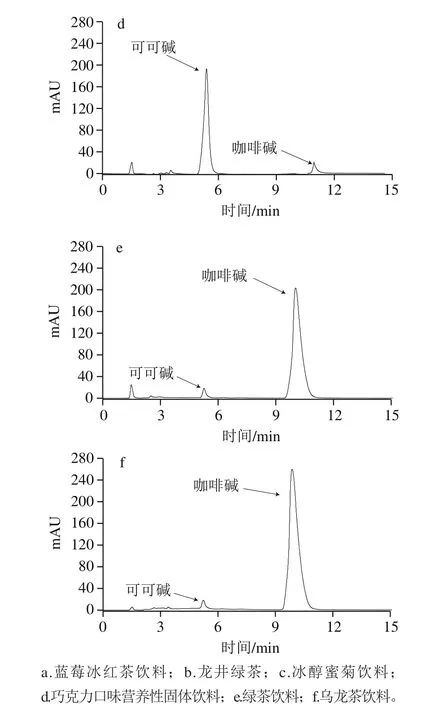
图9 样品HPLC图Fig. 9 HPLC profiles of samples
3 结 论
钛胶基质色谱固定相在天然甲基嘌呤类生物碱如可可碱、茶碱和咖啡碱的快速、同时分析检测中展现出了优异的色谱性能,检测结果显示色谱峰峰形较好,可达到理想的测定效果,且其在线性范围、检出限以及加标回收率等方面均可达到分析要求。此外,HPLC条件(尤其是流动相)在较大程度上影响化合物的分离,流动相的试剂种类、梯度比例以及酸溶液的种类和浓度均可影响分离效果。在本实验提出的色谱条件中,流动相中甲醇的比例仅占5%,无需添加任何缓冲盐,采用等度洗脱简便、快速。同时,可以避免碱性物质的不可逆吸附以及色谱柱的寿命随使用而快速缩短等弊端,充分体现了绿色高效、保护环境、节约资源等优点,适于推广普及。
