大豆分离蛋白-花青素共价复合物制备纳米颗粒及其Pickering 乳液特性分析
2019-10-29鞠梦楠刘英杰董亚博江连洲隋晓楠
鞠梦楠,祝 钢,刘英杰,董亚博,兰 天,江连洲,隋晓楠*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
Pickering乳液是一种不经过常规乳化剂分子稳定,而是通过被水和油部分润湿的固体胶体颗粒充当稳定剂所形成的乳液[1]。水包油型Pickering乳液的主要稳定机制发生在连续相或液滴表面,这取决于稳定系统物质组分的化学性质。乳化剂和稳定剂分别是水包油型乳液中的两种成分。乳化剂是小的表面活性分子,能够通过降低油-水界面处的表面张力和油表面的成膜性在短时间内稳定乳液[2]。稳定剂通常是生物聚合物,例如蛋白质或多糖,其通过改变水相黏度赋予乳液长期稳定性[3]。
大豆分离蛋白主要由7S和11S构成,在加热时由于其球蛋白的组成和结构,使埋藏在蛋白分子内部的疏水基团暴露出来,形成较大的聚集体颗粒,此颗粒可以作为Pickering乳液的稳定剂[4]。
花青素是天然存在的生物活性物质,广泛分布在植物衍生的食品中[5]。同时,花青素是一种强有力的抗氧化剂,能够保护人体免受自由基等有害物质的损伤;此外,花青素还可以增强血管弹性,改善循环系统,抑制炎症和过敏等。花青素作为一种有良好蛋白亲和性的小分子物质,可通过共价结合与蛋白形成稳定的复合体系[6]。
近年来,食品级纳米颗粒稳定的Pickering乳液备受关注[7]。丁群文等[8]研究发现通过加热处理大豆球蛋白形成的颗粒及其Pickering乳液,颗粒大小明显增加,表面疏水性显著提升;乳液的乳化性能和稳定性得到提高。陈硕等[9]以植物球蛋白为材料制备荷载姜黄素蛋白纳米复合物,研究表明,荷载后的蛋白比原蛋白乳化活性略低。Shah等[10]观察到通过壳聚糖-三聚磷酸盐纳米颗粒稳定的Pickering乳液作为姜黄素的递送系统,具有长期稳定性。Zhou Fuzhen等[11]认为麦醇溶蛋白与原花青素复合形成的Pickering乳液在贮藏过程中和模拟胃肠道消化过程中,脂质氧化均被延迟。然而对于大豆分离蛋白与花青素共价复合后制备Pickering乳液的基础特性尚不清楚。因此,本实验主要研究大豆分离蛋白与不同浓度花青素共价复合后的颗粒制备Pickering乳液的基础特性,以通过提供一种新型稳定剂类型提高两相湿润性,为食品工业提供一种绿色健康的稳定剂[12]。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白由实验室自制;大豆油 市购;花青素黑米提取物 陕西天之润科技有限公司;氯化钠、盐酸、氢氧化钠(均为分析纯) 天津基准化学试剂有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
RO5磁力搅拌器、T18分散机 德国IKA公司;BX41正置显微镜 日本奥林巴斯公司;FD5-3型冷冻干燥机 美国SIM公司;WAT023635高效液相色谱仪美国Waters公司;C18反向色谱柱(250 mm×4.6 mm,5 μm,Sunfire) 美国Waters公司;固相萃取装置上海兴纳生物科技有限公司;Mastersizer 2000激光粒度仪 英国马尔文仪器有限公司。
1.3 方法
1.3.1 大豆分离蛋白的制备
参考Huang Liurong等[13]的方法稍作修改。按1∶3(g/mL)的比例用正己烷对粉碎后得到的豆粉进行3 次脱脂,并放在通风橱中除去正己烷。将除去正己烷的大豆粉末按1∶15(m/m)溶于蒸馏水中,用2 mol/L NaOH溶液将pH值调节至8.0,并将所得浆液在25 ℃搅拌2 h,随后在14 000 r/min离心15 min,收集上清液并用2 mol/L HCl溶液调节pH 4.5,然后在4 000 r/min离心15 min。将获得的沉淀物溶于蒸馏水中,用2 mol/L NaOH溶液中和至pH 7.0,在4 ℃用蒸馏水透析24 h,然后于-40 ℃预冻后冻干,研磨以得到大豆分离蛋白粉末。
1.3.2 花青素的纯化与定量
花青素的提取参考Sui Xiaonan等[14]的方法,将黑米提取物粉末溶于蒸馏水中以制备浓缩的花青素溶液。将溶液减压抽滤后,用Sep-Pak柱进行固相萃取,随后旋转蒸发除去有机溶剂得到花青素提纯样品,将样品存放于-20 ℃备用。
根据Sui Xiaonan等[15]的方法对花青素成分进行定量。使用高效液相色谱-二极管阵列检测器在520 nm波长处检测,使用花青素-3-葡萄糖苷和花青素-3-芸香苷标准曲线对花青素中主要成分进行定量。经鉴定,黑米提取物粉末中主要成分为矢车菊素-3-O-葡萄糖苷,根据标准曲线计算,其纯度为53.8 mg/mL。
1.3.3 大豆分离蛋白-花青素共价复合颗粒的制备
参照Liu Fu等[16]的方法稍作修改。称取大豆分离蛋白粉末溶于0.01 mol/L磷酸缓冲溶液中(pH 7.0)配制成6 g/100 mL大豆分离蛋白溶液,室温磁力搅拌2 h,在4 ℃放置过夜以使蛋白质完全水合,加入叠氮化钠0.2 g/L以抑制微生物生长。蛋白溶液与花青素共价复合参照Sui Xiaonan等[17]的方法,用0.1 mol/L的NaOH溶液调节pH 9.0,将花青素(0.05%、0.15%、0.25%,分别为颗粒1、颗粒2、颗粒3)按体积比例分别溶于蛋白溶液并在室温下混合搅拌20 h,由此可得大豆分离蛋白-花青素共价复合物。其中,未经处理的大豆分离蛋白溶液作为空白对照(颗粒0)。随后,将所有样品在95 ℃水浴15 min,然后立即在冰水浴中冷却至室温,调节pH 7.0,分别加入300 mmol/L NaCl溶液增加粒子强度。
1.3.4 大豆分离蛋白-花青素共价复合结合率的测定
参照Rodríguez等[18]的方法稍作修改,测定复合物中花青素的结合率。将复合后的样品在4 ℃通过截留分子质量为3.5 kDa的透析袋16 h,取其透析液用高效液相色谱-二极管阵列检测器在520 nm波长处测量样品中花青素吸光度,使用矢车菊素-3-葡萄糖苷的标准曲线计算透析液浓度,复合物中花青素结合率按式(1)计算,每毫克大豆分离蛋白共价复合结合花青素的含量按式(2)计算:

式中:R花青素为复合物中花青素与蛋白结合率/%;M总花青素为总花青素含量/mg;M透析为透析液外未被结合的游离花青素含量/mg;MSPI为大豆分离蛋白含量/mg。
1.3.5 颗粒表征(粒径、Zeta电位)
参考Yang Tao等[19]的方法稍加修改。利用Mastersizer 2000激光粒度仪对所有样品进行粒径分布和Zeta电位测定。为避免多个颗粒的相聚产生影响,将样品用0.01 mol/L缓冲溶液稀释100 倍后测量粒径,稀释1 000 倍后过0.45 μm水系膜后测量电位。
1.3.6 蛋白颗粒清除自由基能力的测定
2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azinobis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除实验,参照Zhang Qiaozhi等[20]的方法稍作修改。混合制备7.4 mmol/L ABTS和2.45 mmol/L过硫酸钾溶液于黑暗中放置12~16 h形成ABTS工作液。稀释ABTS工作液使其在630 nm波长处的吸光度为0.70±0.02。样品组的处理方法是向40 μL样品溶液中加入4 mL稀释的ABTS工作液;空白对照组的处理方法是向40 μL 0.01 mol/L缓冲溶液中加入4 mL稀释的ABTS工作液,所有组别于黑暗处反应6 min。在630 nm波长处测量所得溶液的吸光度。ABTS阳离子自由基清除率按式(3)计算:
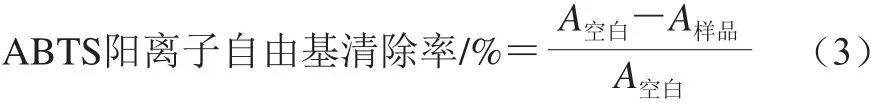
式中:A空白为空白样品的吸光度;A样品为样品的吸光度。
1.3.7 大豆分离蛋白-花青素颗粒稳定Pickering乳液的制备
参考De Folter等[21]的方法进行修改。将大豆油滴入颗粒溶液中直至油相比(大豆油和蛋白复合液体积比)为0.2,用IKA分散机经10 000 r/min分散2 min,制得新鲜乳液(乳液为对应蛋白颗粒制备而成,分别为乳液0、乳液1、乳液2、乳液3)。具体流程参照图1。
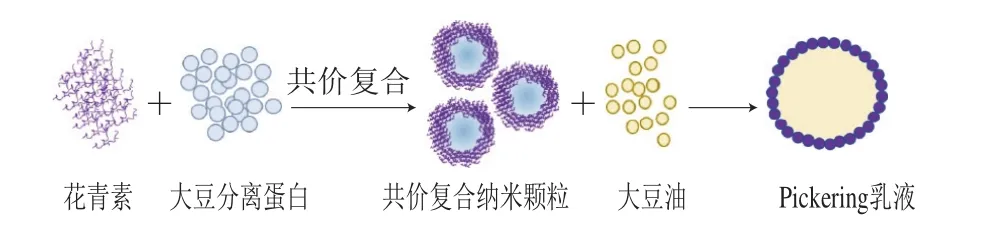
图1 制备大豆分离蛋白-花青素共价复合纳米颗粒及其Pickering乳液Fig. 1 Preparation of SPI-ACN covalent composite nanoparticles and Pickering emulsions
1.3.8 Pickering乳液类型判断
通过观察1滴乳滴在水或油中的分散情况,以此判断乳液的类型。若将乳滴滴入水中迅速扩散,则证明是水包油(O/W)型乳液;反之,若将乳滴滴入油中迅速扩散,则证明是油包水(W/O)型乳液。
1.3.9 Pickering乳液表征(粒径、Zeta电位)
参考Liu Fu等[22]的方法稍加修改,利用Mastersizer 2000激光粒度仪对所有样品进行粒径分布和Zeta电位测定。
1.3.10 乳液微观观察
参考Wang Pengjie等[12]的方法稍加修改,以用于乳液微观观察。用0.01 mol/L pH 7.0的磷酸缓冲溶液将样品适度稀释,取1 滴适度稀释的乳液放置在载玻片上,并用盖玻片固定,在40 倍光学显微镜下进行观察。
1.4 数据统计及分析
所有的实验至少进行3 次重复,利用SPSS Statistics 24软件对数据进行ANOVA差异显著性分析,P<0.05,差异显著。采用Origin 8.5软件进行图表处理。
2 结果与分析
2.1 复合体系结合率分析
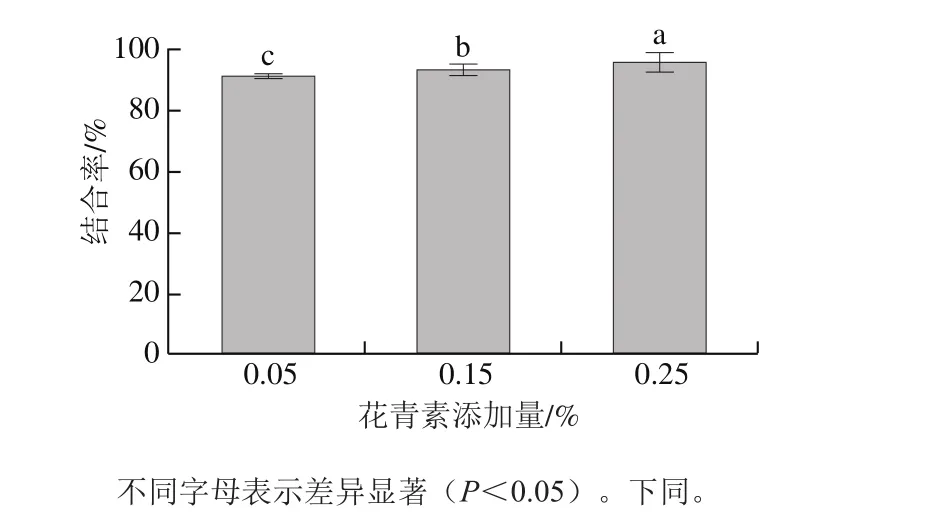
图2 大豆分离蛋白-花青素共价复合体系结合率Fig. 2 Binding percentage of SPI-ACN covalent interactions

表1 大豆分离蛋白结合花青素的含量Table 1 Amounts of soy protein isolate combined with anthocyanins
复合物经透析后可以获得未与蛋白质复合的游离花青素,通过测定游离花青素的含量,进而计算出花青素-大豆分离蛋白的结合度。由图2可知,共价复合后的样品结合率在91%~96%之间,该结果与Rodríguez等[18]的结果一致,花青素在碱性环境下被氧化,生成的醌类物质与大豆分离蛋白相互作用进而生成共价键。同时,由表1可知,随着花青素添加量的增加,共价复合的结合率也逐渐增加。当花青素添加量增大4 倍(0.25%)时,每毫克大豆分离蛋白结合花青素的含量增加了51 倍。这一现象与Sui Xiaonan等[17]得到的结果一致。
2.2 蛋白纳米颗粒粒径分布
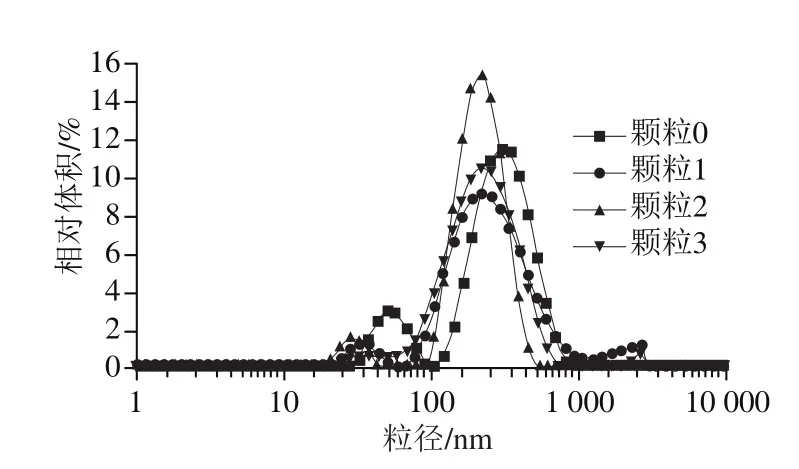
图3 大豆分离蛋白-花青素复合纳米颗粒粒径分布Fig. 3 Size distribution profiles of SPI-ACN nanoparticles
由图3可以看出,蛋白颗粒主要呈单峰分布,未加入花青素的蛋白颗粒0分布在100~800 nm范围内,主要集中在300 nm,这主要是因为加热后蛋白粒径分布会向高尺寸转移,加热诱导蛋白质聚集。这一现象与Liu Fu等[16]观察结果一致,与未加热的蛋白质相比,95 ℃加热15 min的蛋白质粒度明显增大,加热导致天然大豆蛋白成分聚集。加入花青素后,蛋白颗粒分布较为均一,该现象说明复合后溶液中的液滴具有相似的粒径,稳定性较强。与未加入花青素的蛋白颗粒相比,加入花青素的蛋白颗粒的粒径稍有减小(90~700 nm),Yuksel等[23]表示,蛋白与多酚复合后,会较为明显地改变蛋白质的性质,改变溶液中粒径分布情况,并且二者复合后粒径分布会随着多酚浓度的增大而左移,本实验观察结果与该现象一致。同时,随着花青素添加量的增大,粒径相对体积先增大后减小,当花青素添加量为0.15%时(颗粒2),颗粒横坐标宽度最窄,相对体积最大,颗粒分布最为均一,这可能是因为蛋白质与该浓度的花青素共价复合后,二者形成的物质更为均一,内部连接更为紧密,因此改善了纳米颗粒粒径分布。Wang Xiaoya等[24]研究发现,pH 8.0时表没食子儿茶素没食子酸酯与α-乳白蛋白共价复合后显著改善了α-乳白蛋白的粒径分布,使乳白蛋白粒径分布更为均一。
2.3 蛋白纳米颗粒Zeta电位分析

图4 大豆分离蛋白-花青素复合纳米颗粒Zeta电位Fig. 4 Zeta potential of SPI-ACN nanoparticles
如图4所示,未加入花青素的蛋白颗粒0呈现较低的负电性。与花青素共价复合后,蛋白颗粒的Zeta电位绝对值开始增大。参考Jiang Lianzhou等[25]的结论,可能是由于花青素带负电荷,当pH 7.0时,花青素中的酚羟基去质子化,由此产生的氧中心输出高密度负电荷,与蛋白的正电基团结合,使得大豆蛋白的负电荷相对增加。此外,因为与花青素复合后,蛋白质上带正电荷的基团较少暴露出来,从而使大豆蛋白负电性增强。与花青素共价复合后蛋白颗粒的稳定性得到了显著提升。同时,随着花青素含量的提升,蛋白颗粒的电位绝对值呈现先增大后减小的趋势,此结果说明颗粒2的稳定性优于颗粒1和颗粒3,该结果与蛋白颗粒粒径结果一致。
2.4 蛋白纳米颗粒抗氧化能力分析
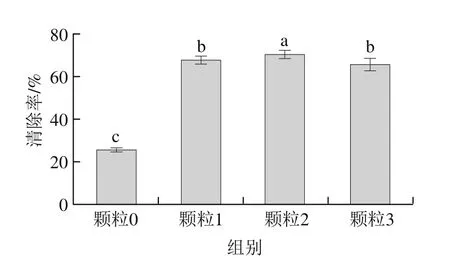
图5 大豆分离蛋白-花青素纳米颗粒清除ABTS阳离子自由基能力Fig. 5 ABTS radical cation scavenging capacity of SPI-ACN nanoparticles
由图5可见,未添加花青素的颗粒0自由基清除能力较低,仅为27.78%。与未添加花青素的对照组相比,添加花青素的颗粒,随着花青素添加量的增加,蛋白颗粒自由基清除能力先上升后略有下降,且颗粒1~3号样品自由基清除能力均明显高于颗粒0(P<0.05)。这说明蛋白与花青素共价复合后,花青素抗氧化,清除自由基的能力得到体现。其中颗粒2自由基清除能力最强,为70.37%。这说明添加量0.15%的花青素与蛋白共价复合后形成更好的相互作用,形成更稳定的颗粒体系。这一现象与Zhang Yan等[26]研究结果一致,花青素与蛋白结合后形成的乳液同样具有显著的抗氧化性,其清除自由基的能力高于未添加花青素制备的乳液。所以,当花青素的添加量在一定范围内时,可以明显增强蛋白颗粒的自由基清除能力,这主要是因为花青素与蛋白结合后形成了颗粒度更均一,粒度更小,电位绝对值更大的颗粒。
2.5 乳液的类型
通过观察乳滴在水或者油中的分散情况判断乳液的类型(图6)。把大豆分离蛋白-花青素共价复合颗粒稳定的Pickering乳液滴到水中后,液滴快速分散,证明此乳液是O/W型乳液。

图6 大豆分离蛋白-花青素共价复合Pickering乳液Fig. 6 Pickering emulsions stabilized by SPI-ACN covalent composite nanoparticles
2.6 乳液粒径分析
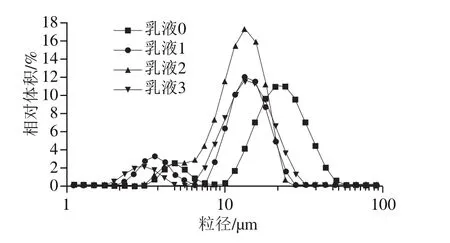
图7 Pickering乳液粒径分布Fig. 7 Droplet size distribution profiles of Pickering emulsions
由图7可知,未添加花青素的Pickering乳液粒径范围主要分布在10~60 μm之间;添加花青素的Pickering乳液粒径范围主要分布在4~20 μm之间。可见添加花青素后乳液粒径有向左转移的趋势。这说明花青素与大豆分离蛋白共价复合后,可有效改善共价体系的粒径分布。Jiang Lianzhou等[25]研究也表明此观点,花青素可明显改善复合体系的粒度分布。此外,乳液2呈单峰分布且相对体积最大,说明乳液2与其他3 种样品相比形成了更加均一稳定的乳液,说明该添加量的花青素与蛋白复合后形成的乳液稳定性最好。这因为颗粒2较稳定,所以形成的乳液较稳定。与Karnaukhova等[27]研究发现向大分子蛋白质中添加适量的小分子物质可以改善蛋白质乳滴分布的结论相符合。
2.7 乳液Zeta电位分析

图8 Pickering乳液Zeta电位Fig. 8 Zeta potential of Pickering emulsions
如图8所示,Zeta电位负值证明乳液表面存在阴离子[28]。未与花青素复合的乳液0 Zeta电位为-12.37 mV,与花青素复合后的乳液Zeta电位绝对值都显著增加(P<0.05)。其中,乳液2 Zeta电位绝对值增加最为明显,为-25.47 mV,说明乳液2较为稳定,这也与乳液粒径结果一致。由图8可知,随着花青素添加量的增大,乳液Zeta电位呈现先增大后减小的趋势。当花青素添加量达到0.25%时,乳液3 Zeta电位的绝对值有所下降,但仍大于未与花青素复合的乳液0。这可能是因为,大豆分离蛋白与花青素共价复合后,通过共价键之间的相互作用,使蛋白结构发生改变,负电荷露出。同样地与Mikulcová等[29]研究发现,乳液Zeta负电位绝对值越大,乳液的稳定性越优良的现象相符合。乳液Zeta电位的结果与乳液粒径结果一致,说明大豆分离蛋白-花青素共价复合稳定的Pickering乳液通过影响乳液的Zeta电位值优化乳液的稳定性。
2.8 Pickering乳液光学显微镜观察分析
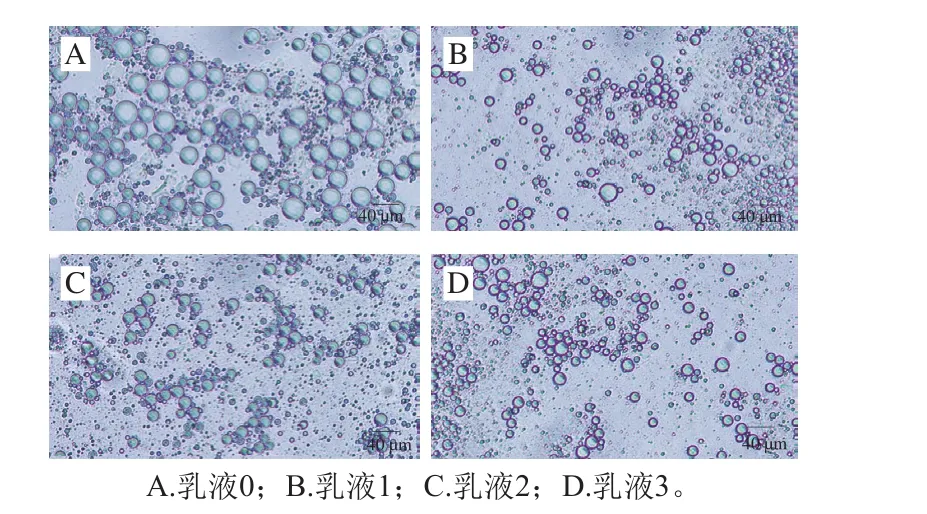
图9 Pickering乳液光学显微镜观察图(×40)Fig. 9 Observation of Pickering emulsions under optical microscope (× 40)
由图9可知,全部样品微观结构均呈现液滴状,乳液2的液滴最为均匀,没有产生聚集,乳滴与乳滴之间重叠部分较少,排列整齐,与之前粒径、电位结果一致。这一现象与Wang Pengjie等[12]得到相似的结论,经过京尼平与酪蛋白共价交联稳定的Pickering乳液比只由酪蛋白形成的Pickering乳液表现出更好的抗絮凝稳定性。较为明显的是乳液0的液滴相比于乳液1~3大很多,相比于乳液0,其他3 种乳液的乳滴更小,稳定性更强。已有研究表明,这是由于大豆分离蛋白稳定的乳液中,水相中未吸附的蛋白分子增加了油滴之间的吸引力,进而引起蛋白分子的渗透作用,这种渗透作用会加速絮凝过程,形成较大乳滴[30]。
3 结 论
大豆分离蛋白与花青素共价复合颗粒为Pickering乳液稳定剂,制备出无表面活性剂的食品级Pickering乳液。通过调节花青素添加量,得到了粒度较小的纳米颗粒,并以该添加量的颗粒制备出稳定性较强的水包油型Pickering乳液。
当花青素添加量为0.15%时,纳米颗粒粒度较小,仅为200 nm;Zeta电位绝对值最大为18.56 mV;同时该添加量下蛋白颗粒自由基清除能力最强。根据光学显微镜观察可知,由此纳米颗粒制备的Pickering乳液最为稳定,没有产生聚集现象。
与未添加花青素的空白对照组相比,添加花青素的实验组纳米颗粒在粒径分布、Zeta电位、自由基清除能力都优于空白组;同时,实验组制备的Pickering乳液在光学显微观察中,显示出优良的稳定性,而对照组则较易聚集。
