角鲨烯/γ-环糊精包合物制备及分子模拟
2019-10-29张光杰谷令彪周民生刘金洲
张光杰,谷令彪,周民生,袁 超,刘金洲
(1.安阳工学院生物与食品工程学院,河南 安阳 455000;2.齐鲁工业大学食品科学与工程学院,山东 济南 250353)
角鲨烯又名鲨烯、三十碳六烯、鱼肝油萜,化学名为2,6,10,15,19,23-六甲基-2,6,10,14,18,22-二十四碳六烯,由Tsujimoto于1906年在黑鲨鱼肝油中发现,是一种高度不饱和烃类化合物[1]。在常温下,角鲨烯为油状的无色液体,不溶于水,难溶于冰醋酸、乙醇和甲醇,易溶于四氯化碳、乙醚、丙酮、石油醚等有机溶剂,因其含6 个非共轭双键,因此极不稳定,很容易氧化。角鲨烯具有提高体内超氧化物歧化酶活性、增强机体免疫能力、改善性功能、抗衰老、抗疲劳、抗肿瘤等多种生理功能[2],因此,被广泛应用于医药、化妆品和食品行业[3],但由于其水溶性较差、易被氧化等,使其在具体应用过程中受到了严峻挑战。虽然已有胶囊产品问世,但多数以保健品形式销售,产品品种单一。笔者前期研究发现可以通过环糊精分子包埋技术改善其水溶性并已成功应用于营养果冻的研发制作。
环糊精是由环糊精葡萄糖残基转移酶[4]作用于淀粉、糖原、麦芽寡聚糖等葡萄糖聚合物后形成的由6~12 个D-吡喃葡萄糖基以α-1,4-糖苷键连接而成的低聚糖,由于其具有内疏水外亲水的特性,所以可通过氢键、范德华力、疏水作用等分子间作用力与多种有机化合物形成包合物,并可改变被包合物的物理及化学性质。常见的环糊精种类主要有α-、β-、γ-环糊精。其中,γ-环糊精因其分子内腔空间较大而被广泛应用于食品及医药[5-7]等领域。而有关环糊精包埋角鲨烯的文献鲜有报道,已有研究制备了角鲨烯/环糊精包合物[8],但是并未对其包合机理进行相关研究。
鉴于此,本实验通过水溶液法结合冷冻干燥法制备角鲨烯/γ-环糊精包合物,并对其进行相溶解度、傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)分析、氢谱核磁共振(hydrogen nuclear magnetic resonance,1H NMR)分析及分子模拟,以期探索包合物的形成机理,改善角鲨烯在水溶性环境中的溶解效果,并为扩大角鲨烯的应用范围提供理论依据及参考。
1 材料与方法
1.1 材料与试剂
角鲨烯标准品(纯度>99%) 北京寰宇科创生物科技发展有限公司;γ-环糊精(纯度>99.0%) 东京化成工业株式会社;正己烷(色谱纯) 天津赛孚瑞科技有限公司。
1.2 仪器与设备
2010-Plus气相色谱仪(配有氢火焰离子检测器和色谱工作站) 日本岛津企业管理有限公司;Tensor II FTIR仪、AM-400型1H NMR分析仪 德国布鲁克科技有限公司;FA2004B电子天平 上海佑科仪器仪表有限公司;KQ-200VDE型三频数控超声波清洗器 昆山市超声仪器有限公司;TH70-85-2磁力搅拌器 余姚市东方电工仪器有限公司。
1.3 方法
1.3.1 包合物的制备
采用水溶液法参考相关文献[9]制备包合物。称量一定量的γ-环糊精溶于25 mL蒸馏水中,使其形成40 mmol/L的γ-环糊精溶液,将角鲨烯缓慢滴加在γ-环糊精溶液中(参照文献[8]按照主客物质的量比为3∶1添加)并超声振荡15 min。在40 ℃条件下磁力搅拌72 h即可得到包合物溶液。静置1 h,用吸油纸去除溶液表面未包合的角鲨烯油滴,置于-60 ℃、100 Pa条件下冻干,得到角鲨烯/γ-环糊精包合物粉末。
1.3.2 包合物的表征
1.3.2.1 相溶解度测定
参照相关文献[10-11]对包合物进行相溶解度测定。称取一定量的γ-环糊精溶于25 mL蒸馏水中,分别配制浓度为0、10、20、30 mmol/L和40 mmol/L的环糊精溶液,并按主客物质的量比1∶1.5的比例向其中滴加过量的角鲨烯,超声振荡15 min,分别在25、40 ℃及55 ℃条件下磁力搅拌72 h,得到包合物溶液。取5 mL包合物溶液,向其中加入10 mL正己烷,超声萃取10 min。静置后经0.45 μm有机滤膜过滤后用气相色谱检测得到包合物中角鲨烯含量。
气相色谱条件参照相关文献[12-14],具体条件如下:Rtx-5毛细管柱(30 m×0.25 mm,0.25 μm);升温程序:150 ℃维持1 min,15 ℃/min升温至250 ℃维持12 min;载气为99.999% N2,空气流速400 mL/min,氢气流速40 mL/min,分流比1∶10;进样口温度250 ℃;进样口压力204 kPa;氢火焰离子检测器温度290 ℃;进样量1 μL;定量方法为峰面积归一化外标法。
以环糊精的浓度为横坐标,角鲨烯的溶解度为纵坐标,绘制相溶解图,并计算包合常数、增溶因子(S/S0,S及S0分别为角鲨烯在环糊精溶液及水中的溶解度)[15]及热力学参数,按式(1)~(3)计算:
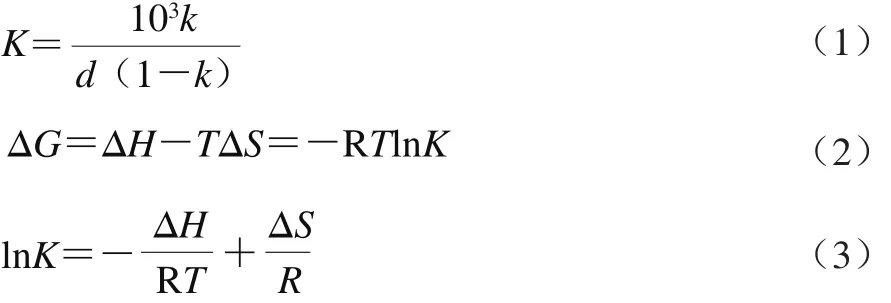
式(1)中:K为包合常数/(L/mol);k为相溶解度图中线性回归方程的斜率;d为相溶解度图中线性回归方程的截距/(mmol/L)。
式(2)中:ΔG为反应的吉布斯自由能/(J/mol);Δ H为反应的焓变/(J/m o l);R为气体常数,8.314 J/(K·mol);T为热力学温度/K;ΔS为反应的熵变/(J/(K·mol))。
根据式(3),将lnK对1/T作图,通过线性拟合得到直线的截距可计算ΔS。
1.3.2.2 FTIR分析
将约1 mg样品(γ-环糊精和角鲨烯/γ-环糊精包合物)置于盛有约100 mg干燥溴化钾的玛瑙研钵中充分混合并研磨成细粉末。然后将样品装入模具中压成片状,并置于FTIR仪中进行测试。通过向溴化钾片剂中加入1滴角鲨烯制备角鲨烯片剂样品。
1.3.2.31H NMR分析
用核磁共振波谱仪在500 MHz、25 ℃条件下记录1H NMR谱。将角鲨烯、包合物和γ-环糊精分别溶解在氘代二甲基亚砜中,置于内径为5 mm的核磁管中,分别进行测试。并根据包合物1H NMR图谱中呈现的各基团图谱的积分面积计算包合物中主客物质的量比[16-17]。
1.3.3 分子模拟
用Hyperchem8.0构建角鲨烯、γ-环糊精及不同主客物质的量比(1∶1、2∶1、3∶1、4∶1、5∶1)包合物的分子结构模型,并选择PM3方法用共轭梯度优化器对各分子模型的能量进行最小化运算,直到得到0.01 kcal/(mol·Å)的均方根值[18]。模拟条件为300 K,1 个大气压,最小能量模型的ΔE按式(4)计算:

式中:E主、E客和E包分别为γ-环糊精、角鲨烯和包合物的计算能量/(kcal/mol)。
2 结果与分析
2.1 相溶解度分析

图1 角鲨烯在不同温度下γ-环糊精溶液中的相溶解图Fig. 1 Phase dissolution diagrams of squalene in γ-cyclodextrin solutions at different temperatures
由图1可知,在25、40 ℃及55 ℃下,在0~40 mmol/L范围内,角鲨烯在γ-环糊精溶液中的相溶解图为AL型[19],即形成的包合物主客物质的量比为1∶1,不同于文献[8]报道的γ-环糊精与角鲨烯可形成主客比近似为2.68∶1的包合物,这可能与包合物制备条件不同有关。

表1 角鲨烯在不同温度下γ-环糊精溶液中的包合常数、增溶因子及热力学参数Table 1 Inclusion constants, solubilization factors and thermodynamic parameters of squalene in γ-cyclodextrin solution at different temperatures
包合过程是一个动态平衡的过程,即包合与解离同时存在。而包合常数K值是决定包合物性质的一个重要参数,其大小能够反映环糊精和角鲨烯形成包合物过程中结合力的强弱,所以,K值可对包合过程作出定量描述。一般K值越大说明环糊精的包合效果越明显,增大客体分子溶解度的能力越强。由表1可看出,包合常数K随着温度的升高而增大,表明所形成的包合物越来越稳定,这是由于分子热运动随温度的升高变得更加剧烈,有利于角鲨烯进入环糊精的空腔内,从而使反应向有利于包合的方向进行,这与相关研究[20-21]结论一致。
通过比较表1中各增溶因子可知,在本实验条件下,γ-环糊精对角鲨烯的增溶效果随温度的升高和浓度的增加而增强,且最大可使角鲨烯的溶解度提高为原来的309 倍。这个结果可能与温度升高使分子运动更加剧烈及环糊精浓度增加使主客体包合的几率增加有关。
由表1可看出,ΔH为正值,表明包合反应为吸热反应,ΔS为正值,表明包合过程是无序化程度升高的熵增加的过程。由热力学第2定律可得,当环糊精的空腔容纳疏水性客体分子前需要脱去水壳,此时会释放结合水,进而被客体分子取代,这个过程会引起熵的正变,说明疏水作用在整个包合过程中起着重要作用[22]。此外,该过程是吸热反应,但客体分子与环糊精空腔内壁之间通过范德华力和分子间氢键力的相互作用是放热反应。本实验中,熵增加期间吸收的热量可能大于主-客体络合反应释放的热量,从而导致正焓变[23-24],即温度升高所带来的无序化增加较之包合过程释放的反应热而引发的焓变更为明显,因此,熵增加对整个包合反应的影响更大些。ΔG为负值表明包合反应是一个自发过程[25],ΔG随着温度的升高而呈负增加,表明温度的升高增加了形成包合物的自发倾向,而温度升高也是增加无序化(熵增加)的过程。因此,从能量变化可以推断,无序化增加(熵增加)是角鲨烯分子进入环糊精空腔的主要驱动力。
2.2 FTIR分析

图2 角鲨烯(A)、包合物(B)及γ-环糊精(C)的FTIR图谱Fig. 2 FTIR spectra of squalene (A), inclusion complex (B) and γ-cyclodextrin (C)
FTIR可通过分子的振动和旋转跃迁识别和分析化合物。主体和客体分子的IR吸收峰的变化可以提供关于包合物形成的重要信息。
如图2A线所示,2 968 cm-1和2 853 cm-1处非常强的吸收峰为—CH3的伸缩振动峰,2 919 cm-1处为—CH2—的不对称伸缩振动峰,1 669 cm-1处为=CH—的伸缩振动峰,1 444 cm-1处为与双键相连的CH2的变形振动峰,1 381 cm-1处为—CH3中C—H的变形振动峰,836 cm-1处为=CH—中C—H的非平面摇摆振动峰,上述结果与文献[26]报道一致。
另外,包合物的红外光谱(图2B线)与γ-环糊精(图2C线)非常相似。γ-环糊精的主要特征吸收峰有:3 384 cm-1左右为γ-环糊精上—OH的伸缩振动;2 926 cm-1为—CH3及—CH2—中C—H的伸缩振动;1 645 cm-1左右为结合水的振动;1 367、1 336、1 304 cm-1为—CH3及—CH2—中C—H的弯曲振动;1 156 cm-1左右为C—O—C的反对称伸缩振动;1 079、1 026 cm-1左右为C—C或C—O的伸缩振动,此结果与文献[27]报道相符。而在包合物的红外谱图中角鲨烯的部分特征吸收峰(2 919、1 669 cm-1及1 444 cm-1)消失,这些谱带由于与更强的γ-环糊精谱带重叠而被掩盖。然而,在836 cm-1处的吸收峰表现出强度降低及轻微的偏移,这可能与角鲨烯分子中双键上的C—H的非平面摇摆振动在包含物形成后受限制并且包合物中的客体含量较低有关。上述信息表明角鲨烯分子中的双键进入γ-环糊精的空腔,间接证实了角鲨烯被γ-环糊精成功包埋。
2.3 1H NMR分析
1H NMR可以提供关于客体分子在环糊精腔内空间位置的有价值的信息。H-3和H-5是环糊精腔内壁中的质子,当客体分子进入环糊精空腔时,由于客体分子与环糊精疏水内腔之间的相互作用,会使H-3和H-5质子的化学位移发生变化[28]。结合图3、表2可以看出,角鲨烯分子进入γ-环糊精分子空腔后,γ-环糊精的质子发生明显的化学位移,角鲨烯的质子在包合物的图谱上峰高和峰面积也发生很大变化。γ-环糊精的质子H-3和H-5、OH-2和OH-3及OH-6均发生明显偏移,分析原因可能是包合物形成后,角鲨烯分子进入γ-环糊精空腔内部,由于客体分子双键环电流的影响使得位于γ-环糊精空腔内壁的H-3和H-5电子屏蔽作用减小,移向低场,化学位移值增大,且二者化学位移相差不大,可见角鲨烯分子进入γ-环糊精空腔内的入口(大口端或小口端)是没有明确的选择性的[29-30]。同时由于角鲨烯分子上双键的屏蔽效应,使得OH-2、OH-3及OH-6周围的电子云密度增加,化学位移减小,移向高场,这些变化表明包合物已成功形成。结合上述红外光谱分析结果及角鲨烯的结构特点,可以推测角鲨烯的部分双键结构进入γ-环糊精空腔内部。而对于H-2和H-4,由于δ3.3附近水分的强质子峰(可能与样品未充分干燥有关)的存在覆盖了H-2和H-4的质子信号,无法对其进行准确分析。

图3 角鲨烯(A)、包合物(B)及γ-环糊精(C)的1H NMR图谱Fig. 3 1H NMR spectra of squalene (A), inclusion complex (B) and γ-cyclodextrin (C)

表2 γ-环糊精及角鲨烯分子中特征基团的化学位移Table 2 Chemical shifts of characteristic groups in γ-cyclodextrin and squalene molecules
另根据包合物1H NMR图谱中呈现的各基团图谱的积分面积计算包合物中主客物质的量比约为3.45∶1,此结果既不同于上述相溶解度结果显示的1∶1,也不同于相关文献[8]报道的2.68∶1。这进一步印证了环糊精分子包合客体分子是一个复杂的动态过程,不同的客体分子结构、主客体的相对用量、不同的包合条件都会影响到包合物的分子结构。上述主客物质的量比差异可能是由于分子结构呈链状的角鲨烯分子在溶液环境中的分子热运动很容易进入γ-环糊精相对宽广的内腔,但是也很容易“溜走”,即包合解离同时存在,并且相溶解度实验中角鲨烯过量,因此更多的包合物主客物质的量比近似为1∶1形式;而本研究中用于1H NMR分析的角鲨烯/γ-环糊精包合物样品在制备过程中是按照主客物质的量比3∶1添加的,可以有更多γ-环糊精空腔可供选择,且一旦形成多个环糊精分子包合同一个角鲨烯分子的包合物结构,相对于主客物质的量比1∶1的包合物要稳定一些,另3.45∶1的主客物质的量比为平均值,说明形成的包合物是含有多个主客物质的量比的混合物;与文献[8]报道的2.68∶1的差异主要与包合物的制备条件(主客物质的量比、包合时间、温度、主客体搅拌的激烈程度等)差异有关。
2.4 分子模拟结果

图4 角鲨烯(A)、γ-环糊精(B)及不同主客物质的量比的包合物分子(C~F)模拟模型Fig. 4 Molecular simulation models of squalene (A), γ-cyclodextrin (B)and inclusion complex (C-F) with different host to guest molar ratios

表3 不同主客物质的量比包合物的最小能量模型的ΔETable 3 ΔE of minimum energy model for inclusion complexes with different host to guest molar ratios kcal/mol
目前,基于分子力学的分子模拟已被广泛应用于表征包合物与环糊精的三维结构[31]。通过上述FTIR和1H NMR分析,可以基本确定角鲨烯/γ-环糊精包合物的主客体分子结合形式,角鲨烯链状分子通过大口端(或小口端)进入γ-环糊精空腔,且部分双键位于γ-环糊精的H-3及H-5附近,而其余长链部分位于空腔外。通过Hyperchem 8.0构建并优化的角鲨烯和γ-环糊精的结构见图4A、B,不同主客物质的量比的包合物分子模型及其ΔE分别见图4C~F及表3。结果表明,角鲨烯分子呈稍弯曲的链状时较为稳定,且随着主客物质的量比的增加,角鲨烯分子将γ-环糊精分子均匀地“串联”在一起形成包合物分子,包合物的ΔE逐渐降低,分子结构趋于稳定,但是当主客比增加到5∶1时,E包及ΔE突然增大为正值,且包合物分子模型中主客体相互远离(图4未显示),包合物变得不稳定。究其原因可能是由于虽然角鲨烯链状分子可以同时“串联”多个γ-环糊精分子,但是当“串联”的γ-环糊精分子过多时会导致相邻的环糊精分子间斥力增大,而主客体结合的作用力又比较弱,导致分子间距离突然增大,并影响到整个包合物的稳定。因此,从分子模拟角度而言,最佳主客物质的量比为4∶1,这与上述1H NMR图谱积分分析的的结果(3.45∶1)较为接近。
3 结 论
应用水溶液法结合冷冻干燥法制备角鲨烯/γ-环糊精包合物,并通过相溶解度、FTIR、1H NMR分析及分子模拟对γ-环糊精包合角鲨烯的机理进行研究。结果显示,角鲨烯被γ-环糊精成功包埋,且在客体分子过量的情况下,可与γ-环糊精形成主客物质的量比1∶1的包合物,而当γ-环糊精过量时,可形成主客物质的量比3.45∶1的包合物。相溶解度及热力学参数分析结果表明,γ-环糊精对角鲨烯增溶效果明显,最大可提高至原来的309 倍;包合常数随温度升高而增大,整个包合过程释放的反应热较小,呈自发的吸热反应,温度升高导致的无序化增加(熵增加)是包合反应的主要驱动力。分子模拟结果表明,包合物的分子结构为角鲨烯链状分子将γ-环糊精环状分子均匀地“串联”在一起,且最佳主客物质的量比为4∶1,但大于4∶1后包合物分子结构突然变得不稳定,具体机理仍有待进一步研究。本研究对于进一步阐明环糊精包合角鲨烯的机理具有重要的指导意义,并可为扩大角鲨烯在食品、化妆品及医药等领域水溶性环境中的应用提供理论依据及参考。
