蝴蝶兰原球茎组织防褐化研究
2019-10-25韩思仪崔永一
韩思仪 崔永一
摘要:以蝴蝶兰Taisuco Hatarot类原球茎(PLB)為试材,主要探讨培养基成分、凝胶剂、吸附剂、抗氧化剂、PLB团块大小、培养条件等培养因子对PLB团块增质量、PLB增殖量、PLB分化和褐化的影响。结果显示,在培养基为 1/2 MS+10 mg/L 6-苄氨基腺嘌呤(6-BA)+玉米素(adenine sulfate)10 mg/L+15%椰汁+15 g/L蔗糖+1 g/L活性炭+0.8 mg/L硝酸银+60 g/L玉米粉,pH值为5.5,切割PLB团块大小为1 cm×1 cm以上等培养条件下,既可使蝴蝶兰PLB增殖与分化保持在较高水平,又能有效地控制褐化现象。
关键词:蝴蝶兰;类原球茎(PLB);褐化防治
中图分类号: S682.310.4+3 文献标志码: A 文章编号:1002-1302(2019)13-0067-05
蝴蝶兰是单子叶植物纲天门冬目兰科蝴蝶兰属多年生附生植物,主要分布在泰国、菲律宾、马来西亚、印度尼西亚及中国台湾等地。其花形奇特,花姿高雅,色泽艳丽,花期持久,有“兰中皇后”的美誉,通常以盆景方式摆放于家居、中高档商场和会议等重要场合,形成具有艺术性的空间主景[1],不仅丰富了植物景观内容[2],而且具有极高观赏价值和经济价值。蝴蝶兰属单茎性气生兰,再生能力弱,组织培养是其主要繁殖方式,具有增殖率高、繁殖速度快、不受季节变化影响等诸多优点,实现了蝴蝶兰繁殖的大规模生产。类原球茎易于增殖分化培养,是蝴蝶兰快繁过程中常见的外植体选择对象。褐变现象、菌类污染和玻璃化现象为蝴蝶兰类原球茎组织培养过程中的三大难题,尤其是褐变,严重影响了类原球茎增殖分化。
褐变现象是指外植体向培养基中释放褐色物质,使培养基逐渐变成褐色,反过来抑制外植体生长,致其死亡的过程[3-4]。朱志国认为,采用1/2MS+1 mg/L NAA+0.5 mg/L BA培养基成分,pH值为5.5,液体培养20 d,春石斛类原球茎(PLB)增殖效果最佳,且没有明显的褐化现象[5]。Degl等认为,将蝴蝶兰PLB放置在温度为15~20 ℃的环境下,培养基的pH值为5.5,可以有效减少褐变物质的排出[6]。刘福平等认为,在培养基中添加100 mg/L半胱氨酸与8.0 g/L甘露醇,可降低过氧化物酶活性,从而有效减少蝴蝶兰PLB褐化现象[7]。王宝宁等认为,在1/2 MS培养基中添加1 g/L活性炭(AC)及5 g/L聚乙烯吡咯烷酮(PVP),经过暗培养10 d能有效减少春兰根茎褐化现象[8]。这表明兰科植物防褐化现象的方法主要是通过调整培养条件、抗氧化剂、激素、吸附剂、培养方式等5个方面,不同兰科植物和品种所采取的防褐化方法不尽相同。因此,找到最适合蝴蝶兰类原球茎防褐化的方法,同时保证类原球茎良好的增殖分化状态,是本研究的主要内容。有关蝴蝶兰组培过程中防褐化的研究不在少数,但普遍内容零散,不够全面,缺乏系统性。本试验在参考国内外相关报道的基础上,以蝴蝶兰‘Taisuco HatarotPLB为试材,从培养条件和培养基成分两大方面,系统探讨了蝴蝶兰类原球茎防褐化的主要方法,为蝴蝶兰再生体系的优化、优良种苗工厂化生产以及以PLB为受体的蝴蝶兰转基因研究提供科学依据,同时也为解决其他兰科植物和单子叶植物快繁过程中的褐化问题提供参考。
1 材料与方法
1.1 材料
本试验以浙江农林大学组培室内长势良好、色泽翠绿、未分化的蝴蝶兰Taisuco Hatarot类原球茎为试材,从2016年11月开始,进行为期4个月的试验。
1.2 方法
试验具体处理如下:
(1)激素浓度:在含有15%椰汁、15 g/L蔗糖、3 g/L聚乙烯吡咯烷酮的1/2 MS培养基中分别添加0、5、10 mg/L 的玉米素(ZT)和5、10 mg/L的6-苄氨基腺嘌呤(6-BA),将pH值调至5.5后,加入8 g/L琼脂粉。
(2)凝胶剂种类:将含有15%椰汁、15 g/L蔗糖、3 g/L PVP、5 mg/L 6-BA的1/2 MS培养基pH值调至5.5后,分别加入8 g/L琼脂、3 g/L植物凝胶(Phytagel)、60 g/L玉米粉。
(3)蔗糖浓度:在含有15%椰汁、3 g/L PVP、5 mg/L 6-BA的1/2 MS培养基中分别加入0、15、25、35 g/L蔗糖,将pH值调至5.5后,加入8 g/L琼脂。
(4)吸附剂种类:将含有15%椰汁、15 g/L蔗糖、5 mg/L 6-BA的1/2 MS培养基的pH值调至5.5后,加入8 g/L琼脂粉,再分别加入1 g/L活性炭、3 g/L PVP、1 g/L活性炭+3 g/L PVP。
(5)暗培养时间:将含有15%椰汁、15 g/L蔗糖、3 g/L PVP、5 mg/L 6-BA的1/2 MS培养基的pH值调至5.5后加入8 g/L琼脂粉。分别进行0、5、10、15 d的暗培养处理,之后放入光照条件下培养。
(6)抗氧化剂的不同种类和浓度:在含有15%椰汁、15 g/L 蔗糖、3 g/L PVP、5 mg/L 6-BA的1/2 MS培养基中分别加入0.4、0.8、1.2 mg/L硝酸银,1 500、3 000、5 000 mg/L柠檬酸,0.5、2、4 mg/L维生素C,0.5、1、1.5 mg/L多效唑,100、500、1 000 mg/L硫代硫酸钠,将pH值调至5.5后加入 8 g/L 琼脂粉。
(7)PLB团块大小:将含有15%椰汁、15 g/L蔗糖、3 g/L PVP、5 mg/L 6-BA的1/2MS培养基的pH值调至5.5后加入8 g/L琼脂粉。在接种时,将PLB团块切成长×宽为(0.1~0.5) cm×(0.1~0.5) cm、(0.5~1) cm×(0.5~1) cm、1 cm×1 cm以上3个组。每组处理45个PLB团块。
以上采用的培养基经高压灭菌锅于120 ℃、20 min灭菌后,倒入200 mL带塑料盖的密封广口瓶中,每瓶约30 mL,每组处理10瓶,每瓶接入5个PLB团块,每个PLB团块大小为 (0.5~1) cm×(0.5~1) cm。将接种好的培养材料放置在温度为(25±1) ℃、光照度为2 300~2 500 lx、光—暗周期为14 h—10 h的组培条件下进行培养,45 d后观察并统计数据。
数据分析方法:用SPSS(Statistical Product and Service Solutions)分析数据,多重比较检验采用最小显著性差异(LSD)法。所有试验数据均表示为“x±s”,P<0.05表示处理间差异显著。
2 结果与分析
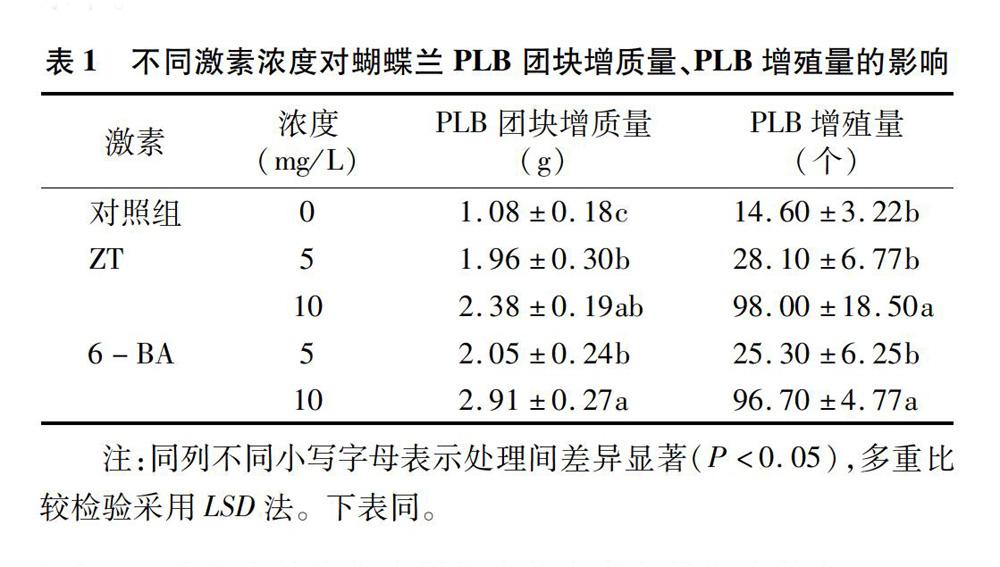
2.1 不同激素浓度对PLB生长发育及褐化的影响
由表1和图1可观察到,ZT和6-BA对PLB团块增质量、PLB增殖量、分化率及褐化率均有影响。10 mg/L 6-BA和10 mg/L ZT对PLB团块增质量和PLB增殖量的影响均较大,但两者之间差异不显著。10 mg/L ZT、5 mg/L 6-BA和 10 mg/L 6-BA处理下的原球茎分化效果均较好,3组处理组之间差异不明显。激素种类和浓度对PLB褐化影响较小,与对照组相比,无显著差异。综上所述,添加10 mg/L 6-BA对PLB褐化的影响较小,同时能保持PLB较高的分化和增殖水平。
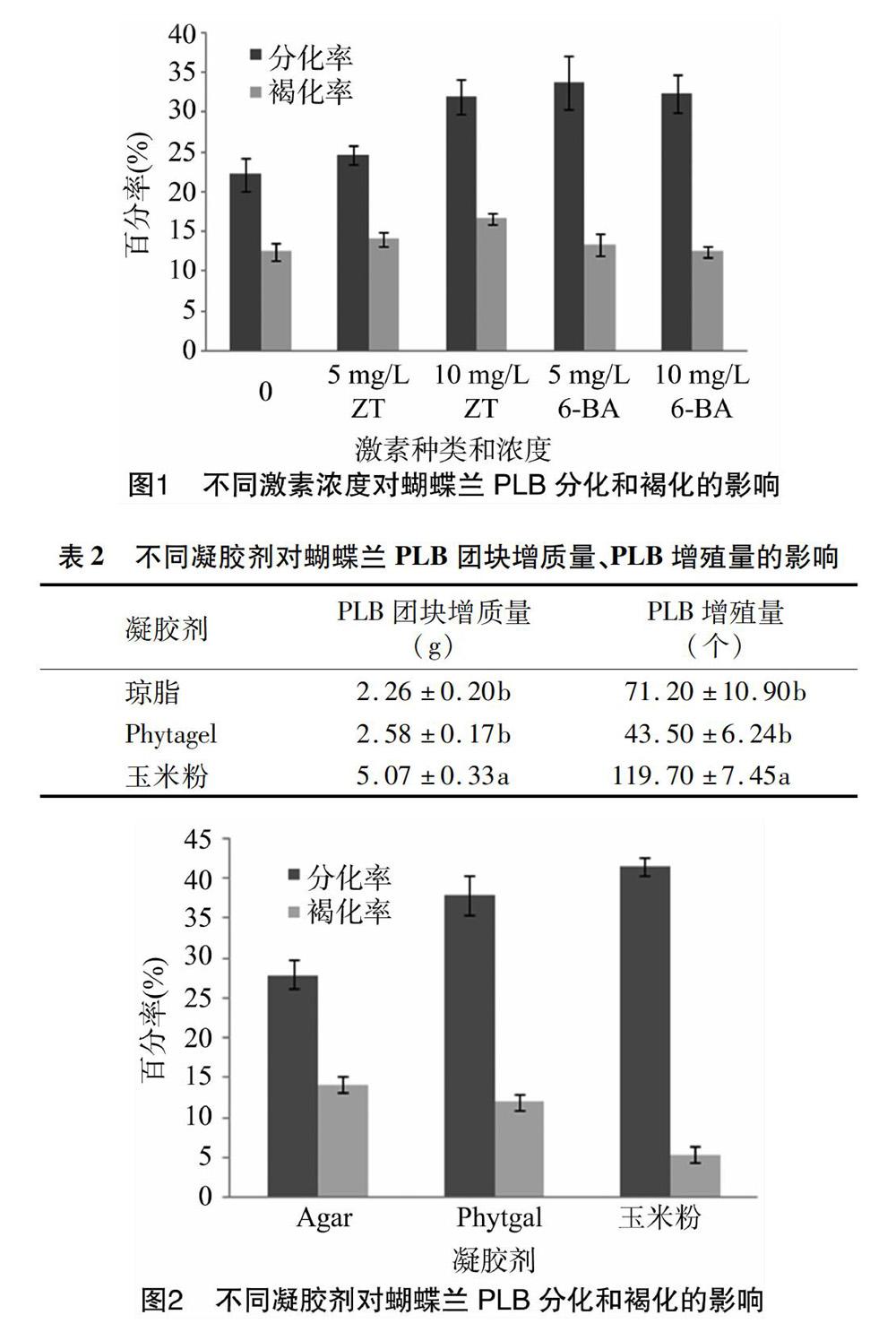
2.2 不同凝胶剂种类对PLB生长发育和褐化的影响
由表2和图2可观察到,玉米粉处理组PLB团块增质量、PLB增殖量、分化率均最高,且防褐变的效果最佳。玉米粉处理组的PLB团块增质量和PLB增殖量及褐变率与其他处理组相比存在显著差异,可较大程度地减少PLB褐化现象。玉米粉处理组和Phytagel处理组均有利于PLB的分化,与琼脂粉处理组相比有明显差异。
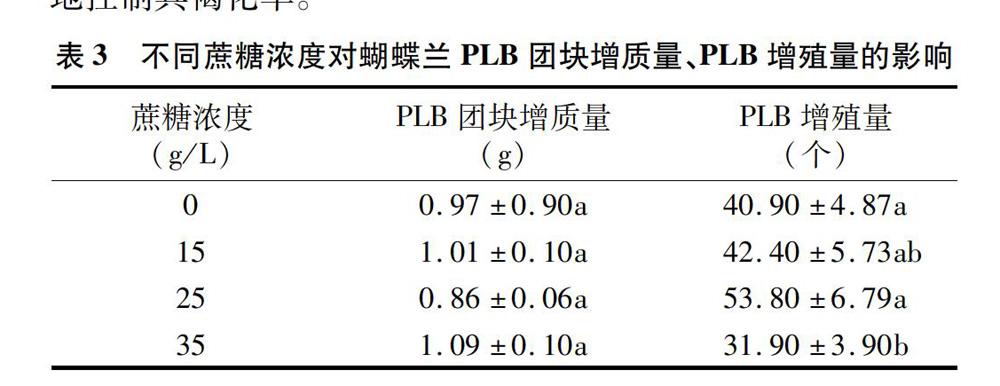
2.3 不同蔗糖浓度对PLB生长发育及褐化的影响
由表3和图3可观察到,蔗糖浓度对PLB增殖量、分化及褐化率均有明显影响,但对PLB团块增质量的影响较小。随着蔗糖浓度的增加,PLB增殖量有增加的趋势,而当蔗糖浓度达到35 g/L时,PLB增殖量减少。当蔗糖浓度达到35 g/L时,PLB的分化率最高,并随着蔗糖浓度的下降逐渐降低。当蔗糖浓度为25 g/L和35 g/L时,PLB褐化率较高,说明较低浓度的蔗糖有利于PLB防褐化。15 g/L的蔗糖浓度不仅能将PLB增殖量与分化率保持在较高的水平,同时又能较有效地控制其褐化率。
2.4 不同吸附剂对PLB生长发育及褐化的影响
由表4和图4可观察到,培养基中单独使用活性炭时PLB团块增质量、PLB增殖量和防褐变效果最佳,与另外2个处理组有明显差异。培养基中添加PVP的处理组的褐化率最高。综上所述,1 g/L活性炭作为吸附剂可有效防止褐化现象,同时能保持较高的PLB增殖和分化水平。
2.5 不同暗培养时间对PLB生长发育及褐化的影响
由表5和图5可观察到,暗培养时间对PLB团块增质量、PLB增殖量、分化率及褐化率均有影响。接种后暗培养 5 d 处理组PLB团块增质量最大,暗培养0、15 d的PLB团块增质量最小。暗培养10 d的处理组PLB增殖量最大,与其他处理组相比有显著差异。对照组PLB分化最高,说明PLB全光照培养有利于PLB的分化。暗培养5 d对防褐变的效果最佳,但暗培养处理组之间不存在明显差异,与暗培养0 d处理组相比存在明显差异,说明暗培养有利于PLB的防褐化。综上所述,接种后暗培养1个星期左右可有效防止褐化现象,同时有利于PLB的增殖。
2.6 不同抗氧化剂对PLB生长发育及褐化的影响
由表6和图6、图7可观察到,抗氧化剂的不同种类和浓度对PLB团块增质量、PLB增殖量、PLB分化及褐化均有影响。培养45 d后,培养基中添加多效唑和硫代硫酸钠的处理组PLB团块褐化死亡率达100%。0.4、0.8 mg/L硝酸银或 2 mg/L 维生素C处理组PLB团块增质量较高,与其他处理相比有显著差异。1.2 mg/L硝酸银和2 mg/L維生素C处理组PLB增殖量较大,3 000 mg/L柠檬酸处理组PLB增殖量最小。硝酸银处理组PLB分化效果最佳,硝酸银不同浓度处理组之间PLB分化无明显差异。柠檬酸和维生素C处理组PLB分化效果均较差。硝酸银处理组防褐变效果较佳,与其他抗氧化剂处理组相比有明显差异,但硝酸银不同浓度处理组之间没有明显差异。综上所述,硝酸银是抑制PLB褐化的最适抗氧化剂,其中以0.8 mg/L为最佳浓度。
2.7 不同PLB团块大小对PLB生长发育及褐化的影响
由表7和图8可观察到,PLB团块大小对PLB团块增质量、PLB增殖量和褐化程度均有影响。当PLB团块大小在 1 cm×1 cm以上时,PLB团块增质量和PLB增殖量较高,且防褐变效果最佳,与其他处理组相比有显著差异。不同PLB团块大小处理组之间PLB分化率无明显差异,说明PLB团块大小对其分化的影响较小。综上所述,当PLB大小为1 cm×1 cm以上时能有效防止褐化现象,同时有利于PLB生长发育。
3 讨论
本试验结果显示,当培养基为1/2 MS+10 mg/L 6-BA+玉米素10 mg/L+15%椰汁+15 g/L蔗糖+1 g/L AC+0.8 mg/L 硝酸银+60 g/L玉米粉,pH值为5.5,切割PLB团块大小为1 cm×1 cm以上,接种后暗培养1个星期左右时,既能使蝴蝶兰PLB增殖与分化保持在较高水平,同时又能有效控制褐化现象。
试验中观察到,ZT和6-BA不同浓度处理组之间PLB褐化率无明显差异。而张和等认为,当6-BA浓度大于 1 mg/L 时,虽能促进蝴蝶兰PLB的增殖,但也容易引起褐化[9],与本研究结果不一致。李冬杰等认为,不同浓度NAA和IAA对冬凌草叶片褐化程度的影响较小[10]。何松林等发现,在牡丹叶柄离体培养过程中,生长调节物质BA和NAA的浓度变化对褐变现象没有明显影响[11]。以上2个研究结果与本试验结果一致。陈正华等认为,不同外植体材料和同一种材料的不同品种对不同激素种类和浓度引起的褐化程度不同,部分品种的蝴蝶兰PLB因激素浓度引起的褐化现象与其组织状态和病变激活酚氧化酶有关[12-13]。
在凝胶剂处理中,本试验创新地使用玉米粉作为凝胶试剂,获得了颗粒饱满、颜色翠绿、分化率高的类原球茎。玉米粉含有亚油酸、谷固醇、维生素、卵磷脂和蛋白质等营养物质,为PLB提供了必要的营养成分,有利于PLB的生长发育。此外,玉米粉中含有有丰富的抗氧化剂谷胱甘肽,可减少类原球茎褐化现象。以上2点与本试验中观察发现的一致。玉米粉作为凝胶剂时,PLB的褐化率明显低,且PLB分化数量上升。
在蔗糖浓度处理中,蔗糖浓度对蝴蝶兰类原球茎褐化有影响。陈勇等认为,蔗糖浓度为1%和2%时,类原球茎分化率为100%;当蔗糖浓度上升至3%~5%时,类原球茎增殖分化均受到抑制,且褐化程度显著上升[14]。张和等认为,含有30 g/L蔗糖的MS培养基比含有15 g/L蔗糖的MS培养基更容易引起蝴蝶兰类原球茎褐化现象[9]。周俊辉等认为,植物离体培养中,高浓度蔗糖更容易引起褐化现象[15]。本试验结论与上述研究结果一致,且发现培养基中添加15 g/L蔗糖为最佳选择。有研究认为,蔗糖浓度越高,越容易激起酚氧化酶的活性,增加外植体酚类物质含量,从而加重了褐化现象[7]。
在吸附剂处理中,活性炭的效果最佳。有研究认为,活性炭表面大量的多孔结构提供了极大空间,非常容易吸附周边物质,故在培养基中能吸收大量分泌出来的酚类物质,减少褐化现象。但是研究表明,活性炭不仅能吸收引起褐化的酚类物质,同时也会吸收培养基中的营养物质,因此浓度不宜过大。本试验中采用1 g/L的活性炭,观察发现类原球茎长势良好且褐化现象较轻。
本试验表明,光照对蝴蝶兰PLB的褐化现象有一定的影响,接种后暗培养1个星期左右,可有效防止褐化现象,同时有利于PLB增殖与分化。赵伶俐等发现,以黑暗预处理 5 d 的PLB团块褐变最轻[16]。盖琼辉将楸子当年生新枝上 1~3 cm 带芽茎段放在4 ℃环境下暗培养5 d,能有效降低褐变现象[4]。陈菲等发现,对母株进行遮光处理,能降低部分品种的褐化现象[17]。可见,光照是影响外植体褐化程度的重要因素之一,普遍存在于大多数外植体材料组培过程中。Hong等认为,光照会促进多酚氧化酶的活性,从而增加被氧化的酚类物质,引起大面积褐化现象[18]。
在抗氧化剂处理中,硝酸银抑制褐化的效果最明显,且有促进PLB分化的作用。有研究表明,外植体受到创伤后,创伤部位的细胞会产生大量用来保护自身的乙烯,而乙烯对细胞分化和器官形成具有抑制作用。AgNO3是乙烯合成抑制剂,可有效降低快繁中乙烯的形成和堆积,促进材料生长和不定芽分化[19-20]。因此,在培养基中添加AgNO3可促进器官发生,增加外植体产生不定芽的数量,实现完整植株的再生[21-22]。这一结论在许多单子叶和双子叶植物上都得到了证明和应用[6,20,23-25]。贺苗苗认为20 mg/L硝酸银能有效诱导出马铃薯花药愈伤组织,同时,褐化现象明显减少[26]。王文星等认为,5 mg/L硝酸银对烟草愈伤组织芽再生的促进作用最佳,同时有效抑制褐化现象[22]。本研究中也观察到,硝酸银处理对蝴蝶兰PLB防褐变有明显的效果,同时还能保持较高的PLB增殖和分化水平。
本试验发现,当PLB大小为1 cm×1 cm以上时能有效防止褐化现象。Chyuam-Yih等认为,当PLB团块体积越小时,伤口面积越大,伤口表面释放出的酚类物质和酚氧化酶就越多,接触空气后发生氧化反应,形成醌类物质,最终造成褐变现象[27]。这一结论与本试验中观察到的现象一致。因此,在蝴蝶兰PLB继代培养过程中应尽量减少切割面积。培养材料转接时应将伤口充分接触到培养基,使培养基中的吸附剂和抗氧化剂发挥作用,减少醌类物质或氧化反应。
参考文献:
[1]吴雅婷,肖 斌. 城市公共开放空间景观设计及整合研究[J]. 西北林学院学报,2010,25(2):188-191.
[2]茹华莎,谢 云,李东生,等. 浙江省农业观光园植物种类及应用调查[J]. 西北林学院学报,2014,29(4):272-277.
[3]陈少珍,卜朝阳,闭志强,等. 兰花组织培养中常见问题及解决方法[J]. 广西农业科学,2006,37(1):72-74.
[4]盖琼辉. 楸子初代组织培养中防止外植体褐化的研究[J]. 林业科技通讯,2017(4):30-33.
[5]朱志国. 春石斛类原球茎克隆增殖技术研究[J]. 宿州学院学报,2016,31(8):124-127.
[6]DeglInnocenti E,Pardossi A,Tognoni F A. Physiological basis of sensitivity to enzymatic browning in ‘lettuce,‘escarole and ‘rocket salad when stored as fresh-cut products[J]. Food Chemistry,2007,104(1):209-215.
[7]劉福平,张小杭,崔寿福. 抗氧化剂减缓长期继代蝴蝶兰类原球茎衰老及生理指标变化[J]. 上海农业学报,2015,31(5):42-46.
[8]王宝宁,张 显,宋军阳. 秦岭野生春兰组织培养过程中的褐化控制研究[J]. 北方园艺,2011(5):169-172.
[9]张 和,徐 虹,王 波. 蝴蝶兰组培苗生产中褐变现象的发生及其调控[J]. 安徽农业科学,2013(35):13457-13458,13463.
[10]李冬杰,魏景芳,鲁绍伟,等. 不同植物激素对冬凌草愈伤组织增值及褐化的影响[J]. 水土保持研究,2006,6(3):149-150.
[11]何松林,陈笑蕾,陈 莉,等. 牡丹叶柄离体培养中褐化防止的初步研究[J]. 河南科学,2005,23(1):47-50.
[12]陈正华. 木本植物组织培养及其现状[M]. 北京:高等教育出版社,2000:408-419.
[13]李浚明. 植物组织培养教程[M]. 北京:北京农业大学出版社,1992:35.
[14]陈 勇,林开县,王君晖. 蝴蝶兰的快速繁殖和规模化栽培技术研究[J]. 浙江大学学报(理学版),2004,31(1):84-87,97.
[15]周俊辉,周家容,曾浩森,等. 园艺植物组织培养中的褐化现象及抗褐化研究进展[J]. 园艺学报,2000(S1):481-486.
[16]赵伶俐,范崇辉,葛 红. 黑暗预处理对蝴蝶兰组培中外植体褐化的影响[J]. 西北农业学报,2006,15(5):248-250.
[17]陈 菲,李 黎,宫 伟. 植物组织培养的防褐化探讨[J]. 北方园艺,2005(2):69.
[18]Hong P I,Chen J T,Chang W C. Promotion of direct somatic embryogenesis of Oncidium by adjusting carbon sources[J]. Biologia Plantarum,2008,52(3):597-600.
[19]张 鹏,傅爱根,王爱国. 硝酸银在植物离体培养中的作用及可能的机制[J]. 植物生理学通讯,1997,33(5):376-379.
[20]周 敏,庄东红. 谷氨酰胺和硝酸银对花生幼叶芽再生的促进作用(简报)[J]. 植物生理学通讯,2002,38(3):240-241.
[21]刘 娟,汤浩茹,王小蓉,等. 硝酸银在植物离体培养中的应用之研究进展[J]. 中国农学通报,2007,23(10):400-406.
[22]王文星,屈 山,曹成有,等. 坤硝酸銀对离体培养烟草叶片愈伤组织形成和芽再生及其其脯氨酸和丙二醛含量的影响[J]. 植物生理学通性,2006,42(4):668-670.
[23]Eapen S,George L. Plant regeneration from peduncle segments of oil seed Brassica species:influence of silver nitrate and silver thiosulfate[J]. Plant Cell Tissue and Organ Culture,1997,51(3):229-232.
[24]Nail S K,Chand P K. Silver nitrate and aminoethoxyvinylglycine promote in vitro adventitious shoot regeneration of pomegranate(Punica granatum L.)[J]. Journal of Plant Physiology,2003,160(4):423-430.
[25]Ozden-Tokatli Y,Ozudogru E A,Akcin A. In vitro response of pistachio nodal explants to silver nitrate[J]. Sci Hortic,2005,106(3):415-426.
[26]贺苗苗. 培养基中添加硝酸银对马铃薯花药培养的影响[J]. 陕西农业科学,2014,60(1):21-23.
[27]Chyuam-Yih N,Saleh N M. In vitro propagation of Paphiopedilum orchid through formation of protocorm-like bodies[J]. Plant Cell,Tissue and Organ Culture,2011,105(2):193-202.
