前体物质对红豆杉内生真菌产紫杉醇的影响
2019-10-25赵赟鑫张欢周俞辛
赵赟鑫 张欢 周俞辛
摘要:根据紫杉醇的结构特点和红豆杉中紫杉醇的合成机制,选取了几种前体物质,研究其对红豆杉内生真菌合成紫杉醇的影响。结果表明,在发酵培养的第10天,补加下列任一前体物质,使发酵液中初始浓度分别达到苯甲酸钠30.0 mg/L,酪氨酸20.0 mg/L,L-苯丙氨酸3.0 mg/L,乙酸钠3.0 g/L,均能提高紫杉醇产量。进一步采用L16(45)正交试验分析得到,4种前体物质在培养基中的最佳组合为A3B3C3D1,即L-苯丙氨酸3.0 mg/L,酪氨酸40.0 mg/L,乙酸钠3.0 g/L,苯甲酸钠10.0 mg/L,对应发酵液中紫杉醇含量达到987.3 μg/L。
关键词:红豆杉;紫杉醇;内生真菌;前体物质;代谢调控;紫杉醇合成;生物量提高
中图分类号: S182 文献标志码: A 文章编号:1002-1302(2019)13-0234-05
近几年来,关于红豆杉产紫杉醇的研究进展得很快,国内外利用红豆杉内生真菌产紫杉醇的研究报道逐渐增多,目前红豆杉内生真菌产紫杉醇的含量普遍偏低,国内外学者正在不断探索能够提高红豆杉内生真菌紫杉醇产量的途径[1]。
前体是指加入到发酵培养基中的某些化学物质,它能被微生物利用并直接结合到产物分子中去,而产物自身结构变化不大,有些还具有促进产物合成的作用。前体一般分为内源性前体和外源性前体,如短链脂肪酸等内源性前体由于是生物体自身代谢所合成的中间体,微生物对其都有较好的耐受性;而外源性前体由于微生物自身难以合成,其浓度较高时对产物合成和微生物的生长都有毒害作用[2]。
目前,對植物内生真菌生产紫杉醇的代谢调控研究较少,不过关于植物细胞生物合成紫杉醇的研究成果相对较多,对微生物发酵生产紫杉醇的研究具有很重要的借鉴价值。
紫杉醇的三环二萜骨架来自于甲瓦龙酸途径,C13侧链来自于苯丙氨酸,向培养基中添加苯丙氨酸可增加紫杉醇的生物合成量。Strobel等通过向培养基中添加苯丙氨酸、亮氨酸及乙酸钠来研究前体物质对紫杉醇生物合成的影响,结果表明,苯丙氨酸、亮氨酸及乙酸钠均能促进紫杉醇的生物合成,其中乙酸钠不但能够掺入到乙酰基中,而且能够掺入到紫杉烷骨架及苯环中,是紫杉醇合成的有效前体[3]。李家儒等在红豆杉悬浮培养基中分别加入不同浓度的L-苯丙氨酸、苯甲酸钠、乙酸钠、甘氨酸、α-旅烯、松节油,结果表明,各前体物对红豆杉细胞生长均无明显影响,却都不同程度地促进了紫杉醇的合成[4]。但是,郭志刚等的研究却得出了相反的结果,其研究发现,添加L-苯丙氨酸对紫杉醇的生物合成没有显著促进作用,苯甲酸钠和乙酸钠抑制紫杉醇的合成,他认为,C13侧链合成的前体含量并不是紫杉醇生物合成的限制性因素[5]。
本研究采用笔者所在课题组自行分离的紫杉醇高产菌株Metarhizium anisopliae LB-10[6]为试验对象,在对其培养基组成和配比[7]、发酵条件[8]研究的基础上,根据紫杉醇的结构特点和红豆杉中紫杉醇的合成机制,选取几种前体物质,研究它们对红豆杉内生真菌合成紫杉醇的影响。
1 材料与方法
1.1 材料
1.1.1 菌株 红豆杉内生真菌Metarhizium anisopliae LB-10是分离自陕西省留坝县野生红豆杉的高产紫杉醇内生真菌。
1.1.2 培养基 斜面培养基:马铃薯葡萄糖琼脂(PDA)培养基,马铃薯200 g,葡萄糖20.0 g,琼脂15.0~20.0 g,水 1.0 L,pH值6.0~8.0;种子培养基:马铃薯葡萄糖肉汤(PDB)培养基,马铃薯200 g,葡萄糖20.0 g,水1.0 L,pH值6.0~8.0;发酵培养基:葡萄糖50.0 g/L,NH4NO3 6.0 g/L,无水MgSO4 0.3 g/L,KH2PO4 0.5 g/L,维生素B1 50.0 mg/L,pH值7.0。
1.1.3 药品与试剂 紫杉醇标准品(≥98%)、乙酸乙酯、甲醇、葡萄糖、NH4NO3、KH2PO4、MgSO4·7H2O、苯甲酸钠、L-苯丙氨酸、乙酸钠、酪氨酸。
1.1.4 主要仪器 高效液相色谱仪(LC 2000)、旋转蒸发仪(RV-10,IKA)、电子天平(TB-214)、双层恒温干燥培养振荡器(ZHWY-2102C)、人工气候箱(LRH-250-G-S)、数控超声波清洗仪(KQ-5200-DE)。
1.2 方法
1.2.1 培养方法 种子液培养方法:在新鲜斜面上取 5 mm×5 mm大小的已纯化菌块,接种到装有50 mL发酵培养基的250 mL三角瓶中,于25 ℃、180 r/min摇床上培养 3 d。
发酵培养:将培养好的种子液混匀,按5%的接种量接种到装有330 mL发酵培养基的500 mL三角瓶中,于27 ℃、180 r/min 摇床上培养10 d。每次提取所用发酵液的量为 1 000 mL。
1.2.2 紫杉醇样品的提取 通过对培养10 d的发酵液进行抽滤,使其分离为菌液和菌丝体2部分,菌丝体用乙酸乙酯在超声条件下萃取,菌液用乙酸乙酯通过分液漏斗萃取,分别重复3次,合并收集乙酸乙酯相,并用双层滤纸过滤,滤液在 40 ℃ 条件下旋转蒸发至干,样品用甲醇溶解并且定容至 10.0 mL,检测。
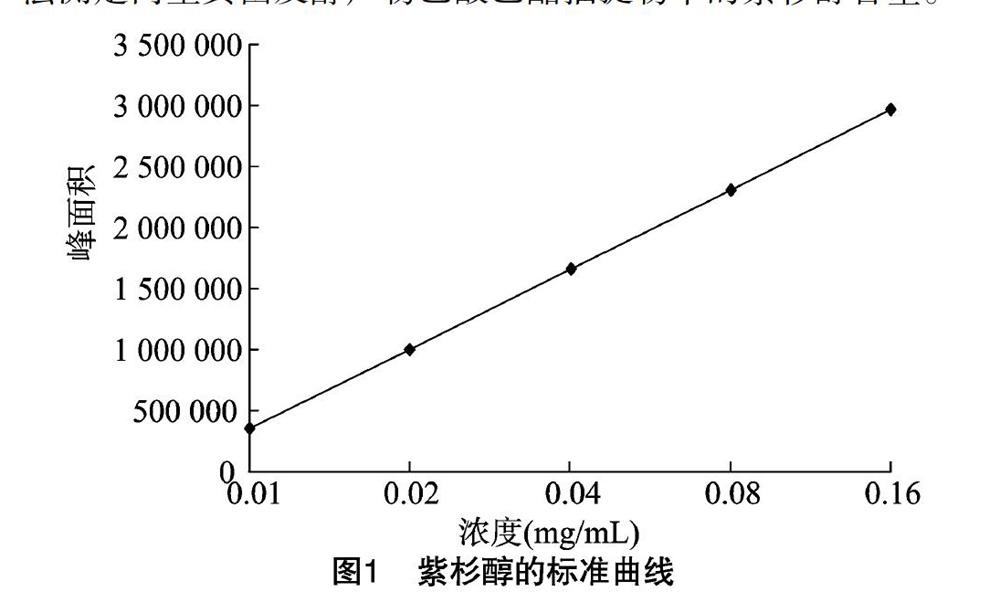
1.2.3 紫杉醇的高效液相色谱检测 将紫杉醇标准品用甲醇定容至10.0 mL,配置成浓度为0.01~0.16 mg/mL的溶液,绘制标准曲线。精密称取紫杉醇标准品4.0 mg,用甲醇定容至10.0 mL,从而得到浓度为0.40 mg/mL的母液,将母液依次稀释成浓度梯度为0.01、0.02、0.04、0.08、0.16 mg/mL,取 20.0 μL 进样(N=5,N表示参与标准曲线绘制的浓度点和响应值个数),得到的回归方程为y=6.087 8+3 589.391 3x,r=0.999 222。建立标准曲线(图1),采用外标法测定内生真菌发酵产物乙酸乙酯抽提物中的紫杉醇含量。
色谱条件:以水-甲醇-乙腈(体积比为33 ∶ 35 ∶ 32)为流动相,检测波长为228 nm,流速为1.0 mL/min,进样量为 20.0 μL,柱温为室温,色谱柱为C18(4.6 mm×150.0 mm)。
紫杉醇含量的计算公式:发酵液中紫杉醇的含量=[甲醇中紫杉醇的含量×溶解提取物所用甲醇的体积]÷提取时所取发酵液的体积。
每次提取的紫杉醇均作3个平行样,分别经高效液相色谱(HPLC)测定并通过公式计算发酵液中紫杉醇的含量,求其平均值。
1.2.4 生物量的测定 取一定体积的发酵液在4 800 r/min转速下离心20 min,菌丝体用蒸馏水洗涤2次,收集菌丝体,置于80 ℃烘箱中烘干至恒质量,称质量,计算菌丝体生物量。
1.2.5 添加前体物质的研究方法
1.2.5.1 单因素试验 以L-苯丙氨酸作为前体物质:采用蒸馏水作为助溶剂,采用“1.1.2”节中的发酵培养基和“1.2.1”节中的培养方法,在LB-10对数生长末期即发酵第10天,添加L-苯丙氨酸水溶液,使发酵液中其初始浓度分别达到1.0、2.0、3.0、4.0、5.0 mg/L,以不添加L-苯丙氨酸水溶液作为空白对照,研究L-苯丙氨酸对LB-10菌丝体生物量和紫杉醇生物合成的单因素影响。
以苯甲酸钠作为前体物质:采用蒸馏水作为助溶剂,在LB-10对数生长末期即发酵第10天,添加苯甲酸钠水溶液,使发酵液中其初始浓度分别达到10.0、20.0、30.0、40.0、50.0 mg/L,以不添加苯甲酸钠水溶液作为空白对照,研究苯甲酸钠对LB-10菌丝体生物量和紫杉醇生物合成的单因素影响。
以乙酸钠作为前体物质:采用蒸馏水作为助溶剂,在 LB-10 对数生长末期即发酵第10天,添加乙酸钠水溶液,使发酵液中其初始浓度分别达到1.0、2.0、3.0、4.0、5.0 g/L,以不添加乙酸钠水溶液作为空白对照,研究乙酸钠对LB-10菌丝体生物量和紫杉醇生物合成的单因素影响。
以酪氨酸作为前体物质:采用甲酸作为助溶剂,在LB-10对数生长末期即发酵第10天,添加酪氨酸甲酸溶液,使发酵液中其初始浓度分别达到5.0、10.0、20.0、40.0、80.0 mg/L,以不添加酪氨酸甲酸溶液作为空白对照,研究酪氨酸对LB-10菌丝体生物量和紫杉醇生物合成的单因素影响。
1.2.5.2 正交试验及验证性试验 选取对紫杉醇积累和菌体生长有较大影响的苯甲酸钠、酪氨酸、L-苯丙氨酸和乙酸钠的初始浓度,各取4个水平,均在发酵第10天加入发酵液中,以紫杉醇产量为指标,进行L16(45)正交试验及验证性试验。
2 结果与分析
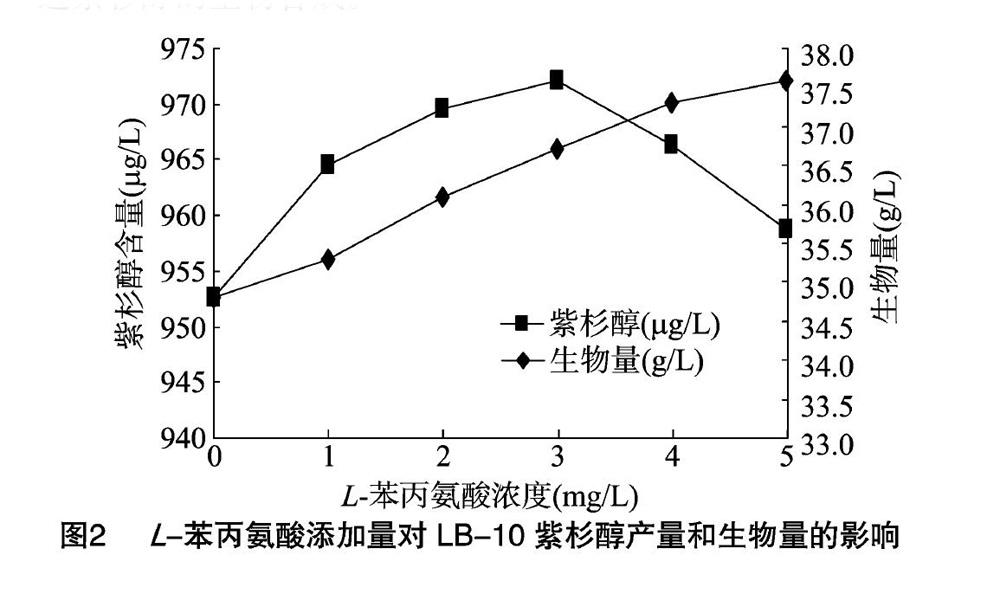
2.1 L-苯丙氨酸对LB-10紫杉醇产量和生物量的影响
苯丙氨酸是α-氨基酸的一种,具有生物活性的光学异构体为L-苯丙氨酸,为白色晶体或结晶性固体,溶于水,难溶于甲醇、乙醇和乙醚[9]。
由图2可知,在0~3.0 mg/L浓度范围内,LB-10的紫杉醇产量随L-苯丙氨酸浓度的增加而增大,当L-苯丙氨酸的浓度为3.0 mg/L时,发酵液紫杉醇含量达到最大值,其平均含量为972.1 μg/L,当L-苯丙氨酸浓度为4.0 mg/L及以上时,紫杉醇的产量急剧下降,但是菌丝体生物量一直呈上升趋势。表明L-苯丙氨酸对LB-10菌丝体生物量和紫杉醇生物合成具有明显影响。高浓度的L-苯丙氨酸对菌丝体生长有利,由于紫杉醇的三环二萜骨架来自甲瓦龙酸途径,C13侧链来自于苯丙氨酸[10],向培养基中添加苯丙氨酸可增加紫杉醇的合成量,因此,添加适量的L-苯丙氨酸可以较好地促进紫杉醇的生物合成。
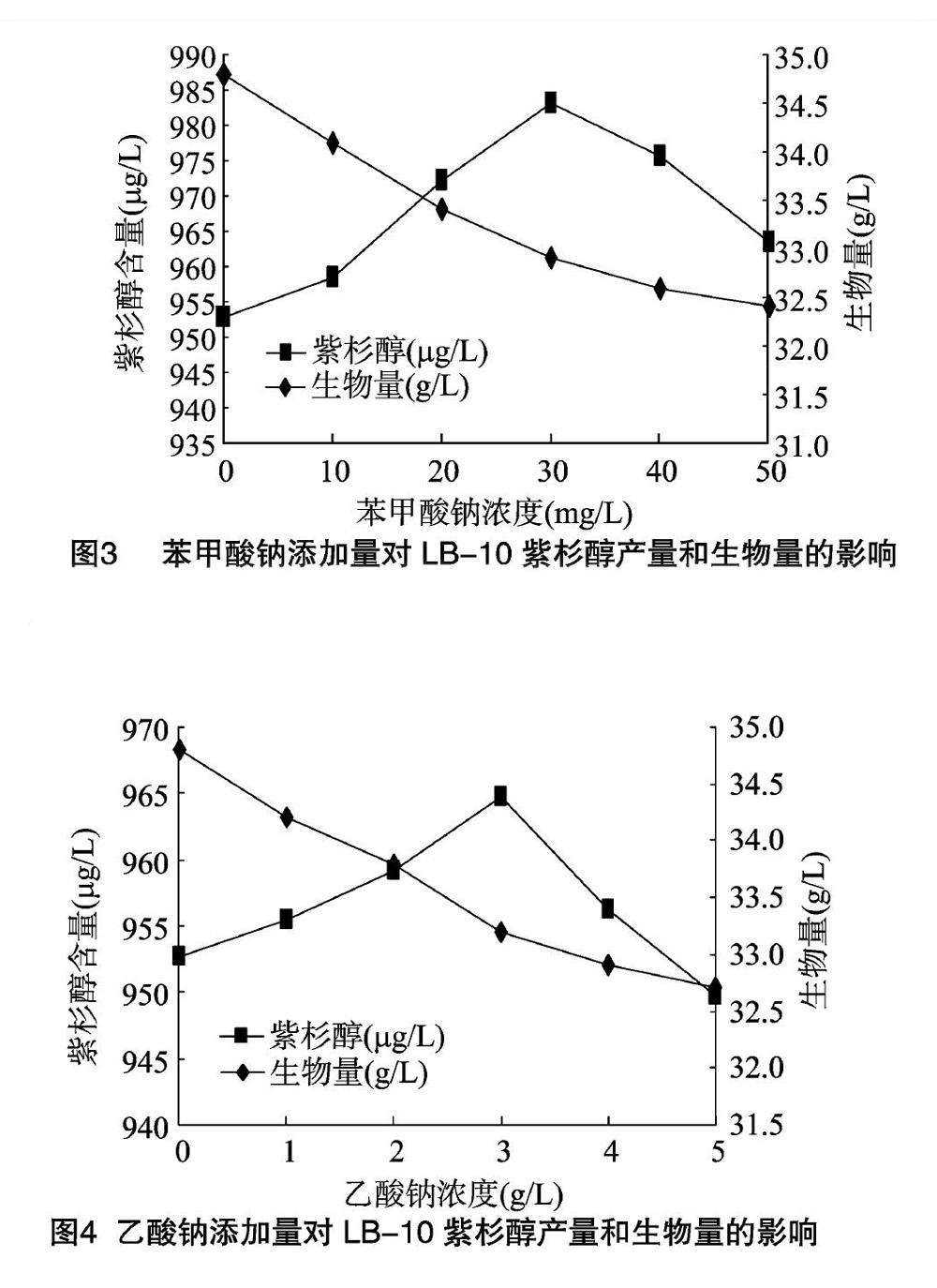
2.2 苯甲酸钠对LB-10紫杉醇产量和生物量的影响
苯甲酰化是红豆杉紫杉醇合成过程中的酰化步骤之一,由于在C2位置上有苯甲酰基这一基团[11],因此苯甲酸可能是微生物合成紫杉醇的前体。由于苯甲酸在常温下很难溶于水,直接使用苯甲酸进行研究比较困难,通常使用的是其钠盐,例如苯甲酸钠,但苯甲酸仍然起主要作用。苯甲酸钠,别称安息香酸钠,为白色颗粒或结晶性粉末,在空气中稳定,易溶于水,且亲油性较大[9]。
由图3可知,在0~30.0 mg/L浓度范围内,苯甲酸钠对紫杉醇合成有明显的促进作用,在添加量为30.0 mg/L时,发酵液中紫杉醇含量达到了983.2 μg/L,继续增加浓度至 40.0 mg/L 时,紫杉醇产量开始下降,且苯甲酸钠对菌丝体生长有明显抑制作用。表明苯甲酸钠对LB-10菌丝体生物量和紫杉醇生物合成具有明显影响。高浓度的苯甲酸钠对菌丝体生长不利,且添加适量的苯甲酸钠可以较好地促进紫杉醇的生物合成。由于苯甲酸钠的亲油性较大,易穿透细胞膜进入细胞体内,干扰细胞膜的通透性,导致菌丝体加速老化。
2.3 乙酸钠对LB-10紫杉醇产量和生物量的影响
乙酸钠,俗名醋酸钠,为无色无味的结晶体,在空气中可被风化,可燃,溶于水和乙醚,微溶于乙醇[9]。由图4可知,在0~3.0 g/L浓度范围内,乙酸钠对紫杉醇合成有明显的促进作用,在添加量为3.0 g/L时,发酵液中紫杉醇平均含量达到了964.8 μg/L。继续将浓度增加至4.0 g/L时,紫杉醇产量开始下降,且乙酸钠在试验范围内对菌体生长有抑制作用。表明乙酸钠对LB-10菌丝体生物量和紫杉醇生物合成具有明显影响。高浓度的乙酸钠对菌丝体生长不利,而添加适量的乙酸钠可以较好地促进紫杉醇的生物合成。由于乙酸钠不仅能掺入到苯环及紫杉烷骨架中,而且能掺入到乙酰基中,因此是紫杉醇合成的有效前体。
2.4 酪氨酸对LB-10紫杉醇产量和生物量的影响
酪氨酸是一种白色结晶体或结晶粉末,易溶于甲酸,难溶于水,不溶于乙醇和乙醚[9]。由图5可以看出,在0~20.0 mg/L 濃度范围内,酪氨酸对紫杉醇合成和菌丝体生长均有明显的促进作用,在添加量为20.0 mg/L时,发酵液中紫杉醇含量达到了980.9 μg/L,随后继续增大添加浓度,会抑制菌体生长和紫杉醇生物合成。表明酪氨酸对LB-10菌丝体生物量和紫杉醇生物合成具有明显影响。由于L-苯丙氨酸在生物体内可被辅酶四氢生物蝶呤可逆地转化为L-酪氨酸,而紫杉醇的三环二萜骨架来自甲瓦龙酸途径,C13侧链来自于苯丙氨酸[10],因此酪氨酸是能够间接提高紫杉醇产量的前体物质。
2.5 前体交互作用
“2.1~2.4”节中分析了4种前体物质及其浓度对发酵的单因素影响,由于各个试验批次之间往往存在较大差别,因此需要对各因素进行综合考察,才能确定较优的前体组合。
本研究选取对紫杉醇积累和菌丝体生长有一定影响的 L-苯丙氨酸、酪氨酸、苯甲酸钠和乙酸钠为前体物质,各取4个水平,均在发酵第10天加入发酵液中,以紫杉醇产量为指标,进行L16(45)正交试验,试验设计见表1。
从表2可以看出,根据极差R值的大小得到,各因素对试验结果影响次序为A>B>D>C,即L-苯丙氨酸对LB-10紫杉醇产量影响最大,其次是酪氨酸,再次是苯甲酸钠,最后是乙酸钠。
2.6 验证性试验
采用优化后发酵液培养,在LB-10发酵培养的第10天,同时添加L-苯丙氨酸3.0 mg/L,酪氨酸40.0 mg/L,乙酸钠3.0 g/L,苯甲酸钠10.0 mg/L,继续再培养4 d。以紫杉醇产量为指标,对LB-10菌株进行摇瓶发酵验证试验,分别提取5次紫杉醇样品进行HPLC检测。结果(表4)表明,LB-10紫杉醇产量的RSD为0.17%,说明测定方法重现性良好,发酵液中紫杉醇含量平均值达到 987.3 μg/L。
3 讨论与结论
所谓代谢调控,就是通过定向改良细胞的代谢特性,对特定的生化反应进行修饰,从而实现合成新产物或提高目的产物产率以及减少副产物产率的目的。在正常的生理条件下,微生物总是通过协调系统最经济地吸收和利用营养物质,用于合成细胞结构,进行生长和繁殖,一般不积累中间代谢产物。代谢人工调控是指打破微生物的代谢控制体系,使代谢朝着人们希望的方向进行。因此,在了解紫杉醇生物合成途径和催化各步反应酶的特性后,有目的地控制培养条件,通过添加重要前体物质、诱导子及抑制剂,对关键酶活性进行调节,抑制其他无用的旁路途径,是完全可以提高紫杉醇产量的。
本研究根据红豆杉紫杉醇的合成机制和紫杉醇的结构特点,选取L-苯丙氨酸、苯甲酸钠、乙酸钠、酪氨酸分别作为前体物质,研究其对Metarhizium anisopliae LB-10合成紫杉醇的影响。结果表明,在发酵培养的第10天,补加任一生长调节剂,使发酵液中初始浓度分别为苯甲酸钠30.0 mg/L,酪氨酸20.0 mg/L,L-苯丙氨酸3.0 mg/L,乙酸钠3.0 g/L,均能提高紫杉醇产量。
进一步采用L16(45)正交试验分析得到,4种前体物质在培养基中的最佳组合为A3B3C3D1,即L-苯丙氨酸 3.0 mg/L,酪氨酸40.0 mg/L,乙酸钠3.0 g/L,苯甲酸钠 10.0 mg/L,对应发酵液中紫杉醇含量达到987.3 μg/L。
本研究的几种前体物质基本上都在浓度增加到一定程度后,产生了对紫杉醇合成的不利影响,原因在于对大部分前体而言,都能促进终产物的生成,但许多外源前体的加入又会抑制植物细胞或菌丝体的生长,从而最终影响了次生代谢终产物的产量,而添加外源前体的目的是要促进代谢终产物的生成,因此,要筛选前体的最佳添加浓度,不同的前体其最佳添加浓度是不同的,且前体浓度不同,对次生代谢物合成的影响也不同。
紫杉醇具有细胞毒害作用[12],通常不会大量地合成,只有在特殊环境胁迫条件下,初生代谢受到抑制,次生代谢产物才会大量合成。在本试验过程中发现,添加某些前体物质,在紫杉醇产量较高时,生物量却较低。这就造成紫杉醇生物合成和菌丝体生长之间的矛盾,因此找到二者最佳平衡点是目前需要解决的问题,也是实现工业化生产的必要条件。
参考文献:
[1]张 欢,赵赟鑫,高 文,等. 紫杉醇生产现状的分析与对策[J]. 中国现代中药,2016,18(1):126-130.
[2]赵赟鑫,高 文,张 欢,等. 提高红豆杉内生真菌及紫杉醇含量的途径分析[J]. 陕西农业科学,2015,61(10):13-17.
[3]Strobel G,Yang X S,Sears J,et al. Taxol from Pestalotiopsis microspora,an endophytic fungus of Taxuus wallachiana[J]. Microbiology,1996,142(2):435-440.
[4]李家儒,曹孟德,刘曼西,等. 前体物对红豆杉培养细胞中紫杉醇生物合成的影响[J]. 植物研究,1999,19(3):356-360.
[5]郭志刚,冯 莹,刘瑞芝. 前体化合物与诱导子对紫杉醇和紫杉烷类化合物合成的调控作用[J]. 天然产物研究与开发,2000,12(5):34-37.
[6]耿 直,刘开辉,赵赟鑫,等. 一株产紫杉醇中国红豆杉内生真菌的分离和鉴定[J]. 微生物学通报,2010,37(2):199-203.
[7]赵赟鑫,张 欢,邓百万,等. 红豆杉内生真菌产紫杉醇的培养基优化[J]. 江苏农业科学,2014,42(11):389-392.
[8]张 欢,赵赟鑫,李昭莹,等. 红豆杉内生真菌产紫杉醇的发酵条件优化研究[J]. 江苏农业科学,2018,46(21):306-309.
[9]曾昭琼. 有机化学[M]. 4版.北京:高等教育出版社,2004:268-275.
[10]宣红玉,刘家新,王健刚,等. 紫杉醇生物合成途径及调控研究进展[J]. 天然产物研究与开发,1998,10(3):96-102.
[11]Fleming P E,Floss H G,Haertel M,et al. Biosynthetic studies on taxol[J]. Pure and Applied Chemistry,1994,66(10):2045-2048.
[12]李宗霆,周 燮. 植物激素及其免疫檢测技术[M]. 南京:江苏科学技术出版社,1996:186-192.
