2株油菜菌核病拮抗内生细菌的筛选鉴定及其拮抗活性初步分析
2019-10-25李梦霖阮羽萱杜可心
李梦霖 阮羽萱 杜可心

摘要:油菜菌核病是一种严重危害油菜生长的病害。于2017年3月从湖南农业大学生物科学技术学院试验田采集油菜湘油15盛花期植株的根茎叶,采用纯培养法对内生细菌进行分离纯化,共分离得到68株内生细菌;采用基于16S rRNA基因序列的系统发育分析法对内生菌株的多样性进行分析研究;利用琼脂扩散法对内生菌株进行抗菌活性筛选,共筛选出7株抗菌活性较强菌株,分别为Y171004、Y172014、Y173005、Y174007、Y174017、Y177001和Y177002;利用平板对峙法对油菜菌核病病原菌核盘菌的拮抗菌进行筛选,筛选出2株(Y171004和Y177002)油菜核盘菌的拮抗细菌,经初步鉴定为芽孢杆菌(Bacillus),继而对其拮抗活性进行初步分析,其中菌株Y171004的抗菌物质经鉴定为热不稳定性蛋白。研究结果能为该地区油菜内生细菌资源的进一步研究及其在油菜菌核病生物防治等方面的应用提供试验依据和理论指导。
关键词:油菜菌核病;内生细菌;拮抗;热不稳定性蛋白;抗菌活性;新型药剂开发
中图分类号: S435.654 文献标志码: A 文章编号:1002-1302(2019)13-0121-05
油菜(Brassica napus L.)是芸薹属的一年生或越年生草本植物,是我国最重要的油料作物,也是世界四大油料作物之一[1],我国油菜的种植面积以及产量均占全世界油菜的30%左右[2]。油菜的生长周期较长,需要对抗的病害种类较多,以油菜菌核病、病毒病[3]、白锈病、黑斑病等为重要病害[4],导致油菜减产最严重的是油菜菌核病。油菜菌核病是由油菜菌核病菌(Sclerotinia sclerotiorum in oilseed rape)感染引发的一类子囊菌寄生型病害[5],其危害导致的减产量占总危害减产量的80%。
目前,油菜菌核病的防治方法主要是化学防治,会对环境产生严重污染,在这种形势下生物防治成为当前对油菜菌核病防治的主要途径。生物防治主要是利用微生物本身或其次级代谢产物抑制核盘菌的生长,内生细菌作为一种非常重要的微生物资源,近些年来逐渐成为微生物资源研究的重点之一。
目前对油菜菌核病的研究较多,但未见从油菜中分离出内生细菌以筛选菌核病拮抗菌的报道。本研究从甘蓝型油菜湘油15的根茎叶中分离内生细菌并进行抗菌活性筛选鉴定,对菌核病拮抗菌的抗菌物质进行初步研究,以期为开发新型防治菌核病的防治药物奠定基础。
1 材料与方法
1.1 供试材料
1.1.1 供试内生细菌 样品采集于湖南农业大学试验基地,油菜品种为甘蓝型油菜湘油15,种植150 d时进行采样,随机选取3株作为样品,采集根茎叶,于4 h内进行消毒灭菌处理。
1.1.2 供试敏感指示菌和病原菌 6种供试敏感指示菌分别为大肠杆菌(Escherichia coli)ATCC 128、变形杆菌(Proteus vulgaris)ATCC 8427、枯草芽孢杆菌(Bacillus subtilis)ATCC 6051、藤黄八叠球菌(Sarcinalutea)GC-MCC 1.880、金黄色葡萄球菌(Staphylococcus aureus)ATCC 25922、黑曲霉(Asperillus niger)NCPC 1003,病原菌为核盘菌(Sclerotinia sclerotiorum)。
1.2 试验方法
1.2.1 油菜内生细菌的分离 用自来水将样品洗净,吸干水分后称取根茎叶各5 g进行消毒灭菌处理。无菌研钵研磨[6],制成0.100 0%、0.010 0%、0.001 0%、0.000 1%稀释液,各取200 μL涂布肉汤琼脂培养基(LBA)、营养琼脂培养基(NA)、牛肉膏-蛋白胨培养基(牛)、10%茎杆汁特殊因子培养基(T),3个重复,取最后1次冲洗的无菌水涂布平板作为对照。培养2~3 d,挑取单菌落并编号,在对应的分离培养基培养皿上采取三区划线法进行纯化3~4次。
1.2.2 内生细菌的系统发育分析 根据菌落形态、大小、颜色等特征,对分离的内生细菌进行比较分析归类,利用基于16S rRNA基因序列的系统发育分析法和蛋白酶K法,对差异较大的内生细菌进行系统发育分析。扩增反应引物为正向引物16S8F(5′-CGGGATCCAGAGTTTGATCCTGGCTCAGAACGAACGCT-3′)和反向引物16S1506R(5′-CGGGATCCTACGGCTACCTTGTTACGACTTCACCCC-3′)。PCR反应体系(50 μL):2×Taq Master Mix(Mg2+)25 μL,模板DNA 1 μL,引物各1 μL,加ddH2O至50 μL。PCR扩增条件为94 ℃预变性2 min;94 ℃ 变性30 s,58 ℃复性30 s,72 ℃延伸2 min,30个循环;72 ℃延伸2 min。扩增产物经琼脂糖凝胶电泳检测,测序,将序列结果提交GenBank注册得到序列号,在NCBI数据库中进行在线相似序列比对,保存相似性较高的已知序列到本地txt文本,运用Clustal X[7]和MEGA 6.0[8]构建进化树。
1.2.3 活性菌株的筛选及其生物学特征 以大肠杆菌ATCC128、变形杆菌ATCC8427、枯草芽孢杆菌ATCC6051、藤黄八叠球菌GC-MCC1.880、金黄色葡萄球菌ATCC25922、黑曲霉NCPC1003作為供试敏感菌株,采用琼脂扩散法[9],挑取单菌落接种于装有50 mL液体LB培养基的150 mL锥形瓶中,于28 ℃、180 r/min振荡培养2 d,发酵液 9 500 r/min 离心10 min,直径为6 mm的2层滤纸片沾取上清进行抗菌活性筛选,待滤纸片周围出现明显透明圈时记录抗菌圈直径,确定活性菌株。利用革兰氏染色和芽孢染色对活性菌株进行形态观察,以6个温度梯度、6个pH值梯度、5个盐浓度梯度等指标对活性菌株进行生长情况测定,培养基中加入可溶性淀粉和吐温-20测定菌株产胞外酶特性。
1.2.4 拮抗菌株的筛选 采用平板对峙法,取边长为 0.5 cm 正方形病原菌块接于PDA平板中央,将“1.2.3”中筛选得到的活性菌株等距接于病原菌块四周,每个菌株3组重复,不接待测菌株只接病原菌株的平板作为空白对照,28 ℃培养。待空白对照组的病原菌长满整个平板后观察试验组病原菌生长情况,确定拮抗菌株。
1.2.5 拮抗菌株對病原菌丝的影响 盖玻片洗净,75%乙醇浸泡5 min后晾干,倾斜插于拮抗菌与病原菌中间,待受到抑制作用的病原菌丝长到盖玻片上时取出镜鉴。
1.2.6 拮抗物质的初步鉴定及耐热性分析 选取生长1 d的幼龄拮抗菌株,接种于装有50 mL液体发酵培养基的 150 mL 锥形瓶中,28 ℃下180 r/min振荡培养2 d,发酵液 9 500 r/min 离心10 min,转移40 mL上清入新的离心管,每管加入20 g硫酸铵,全部溶解后在4 ℃冰箱中过夜,9 500 r/min离心30 min,去上清留沉淀,2 mL无菌水溶解,0.22 μm 过滤器过滤除菌体,得到蛋白粗提物[10],测定其抗菌活性。将蛋白粗提物置于95 ℃中水浴30 min,测定其抗菌活性。
2 结果与分析
2.1 油菜内生细菌的分离
将甘蓝型油菜湘油15根茎叶的研磨液接种到4种培养基上,观察分析统计结果。由表1可知,从LBA培养基上分离得到26株内生细菌,从NA培养基上分离得到6株内生细菌,从牛肉膏蛋白胨培养基上分离得到13株内生细菌,从T培养基上分离得到23株内生细菌,共分离出68株细菌。其中LBA、T这2种培养基的分离效果最好,分别为26、23株,分别占总分离菌株的38.24%、33.82%。
2.2 内生细菌的系统发育分析
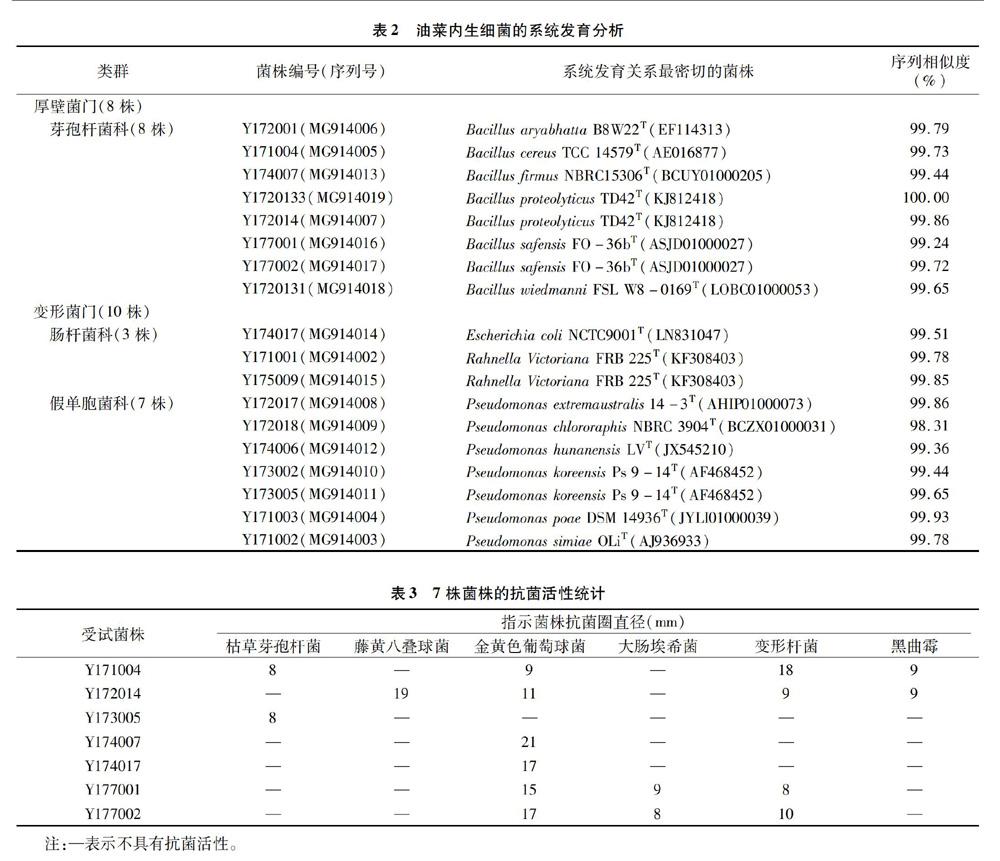
根据菌落形态、大小、颜色等特征,对68株内生细菌进行比较去冗余,最后选取差异较大的18株代表性内生细菌,对其进行基于16S rRNA基因序列的系统发育分析,结果见表2:18株内生细菌属于细菌域(Bacteria)的2个门[厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)]的3个科[芽孢杆菌科(Bacillaceae)、假单胞菌科(Pseudomonadaceae)、肠杆菌科(Enterobacteriaceae)],4个属:芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、拉恩氏菌属(Rahnella)和埃希氏菌属(Escherichia)。其中芽孢杆菌属和假单胞菌属占绝对优势,菌株数分别占测序菌株的44.44%(8株)和38.89%(7株),说明芽孢杆菌和假单胞菌是油菜内生细菌中的常见细菌。其次是拉恩氏菌属2株和埃希氏菌属1株,显示了油菜内生细菌较高的类群多样性。
2.3 活性菌株的筛选及其生物学特征
由表3可知,用琼脂扩散法对分离的68株内生菌进行抗菌活性筛选,发现有7株菌株(Y171004、Y172014、Y173005、Y174007、Y174017、Y177001、Y177002)的发酵液至少对1种指示菌具有较强的抗菌活性。其中Y171004对4种指示菌有
抗菌活性;除了Y173005外,其他6株菌株均能抑制革兰氏阳性菌株金黄色葡萄球菌的生长,表明植物组织中含有非常丰富且有待开发的产活性物质菌株,是微生物资源的一大宝库。
以6个温度梯度对7株活性菌株进行生长情况测定。由表4可知,大部分菌株均能在25~40 ℃之间生长,菌株Y177001和菌株Y177002在25~50 ℃之间生长良好,具有较广的生长温度范围且具有耐高温的特性。菌株Y174007不能在弱酸性环境、无盐、高盐环境下生长,其他6株菌均能在pH值为5~10之间、盐浓度为0~2%之间生长;菌株Y177001和菌株Y177002在盐浓度为0~7%环境下均能生长,具有较广的生长盐度范围和一定的嗜盐性。
以Stackebrandt等提出的16S rRNA基因序列相似性小于97%的菌株属于不同物种的论点为基本原则[11],并与各类群(科、属)已知物种进行对比分析,在系统发育分析结果的基础上,初步确定试验菌株的物种归属。结果表明,18株分离菌株可以归为14个不同的物种,且大多数分离菌株与其系统发育关系最为密切的已知物种的典型菌株间存在着一定的遗传差异(序列相似性1株100%,其他98.31%~99.93%)。这些结果表明分离的油菜内生细菌的物种多样性和遗传多样性较高。
选取7株活性菌株中形态差异较大的5株进行培养特征观察,结果如图1所示。菌株Y171004、Y172014、Y173005、Y174017和Y177002均能在LBA培养基上生长良好,均用平板对峙法测定内生细菌对核盘菌的拮抗作用。由图2可知,菌株Y171004和菌株Y177002对核盘菌菌丝的生长有抑制作用,能形成较为明显的抗菌圈。分析测量结果,菌株Y171004对核盘菌的抗菌圈平均直径为11.5 mm,菌株Y177002对核盘菌的抗菌圈平均直径为19.0 mm,且抗菌圈周围的菌丝颜色变深。继续培养2 d后观察发现,菌株Y171004对核盘菌的抗菌圈依旧存在,但是对匍匐菌丝的抑制能力逐渐减弱,匍匐菌丝缓慢生长盖过Y171004菌体,菌株Y177002对核盘菌的抗菌圈大小没有明显变化。
2.5 拮抗菌株对病原菌丝的影响
用埋片法检测菌株Y171004、Y177002对病原菌丝的影响。由图3可知,被Y171004菌株分泌物处理过的病原菌菌丝表现出菌丝皱缩,从培养基上肉眼观察发现抗菌圈周围的菌丝较疏松。被菌株Y177002分泌物处理过的病原菌菌丝表现出菌丝膨大变粗且变黑,从培养基上肉眼观察发现抗菌圈周围的菌丝变黑或变褐。
2.6 拮抗物质的初步鉴定及耐热性分析
菌株Y171004和Y177002发酵液的蛋白粗提物对病原菌生长的影响如图4所示。菌株Y171004的蛋白粗提物对病原菌具有抑制作用,并且抑制效果比平板对峙法的抑制效果明显。而菌株Y177002的蛋白粗提物对病原菌没有抑制作用,说明其抗菌成分为非蛋白类物质。
菌株Y171004的发酵液蛋白粗提物经95 ℃水浴30 min后对病原菌生长的影响如图5所示。菌株Y171004的蛋白粗提物经水浴处理后对病原菌没有抗菌作用。确定菌株Y171004的拮抗物质为不具耐热性的蛋白类物质。3 结论与讨论
本研究從湖南农业大学试验基地采集的油菜根茎叶中分离出68株内生细菌,比较菌落的形态、大小、颜色等特征,最后选取差异较大的18株内生细菌进行系统发育分析。18株内生细菌属于细菌域的2个门的3个科的4个属:芽孢杆菌属、假单胞菌属、拉恩氏菌属和埃希氏菌属。其中芽孢杆菌属和假单胞菌属占绝对优势,菌株数分别占测序菌株的
44.44%(8株)和38.89%(7株),说明芽孢杆菌和假单胞菌是油菜内生细菌中的常见细菌。其次是拉恩氏菌属2株和埃希氏菌属1株,显示了油菜内生细菌较高的类群多样性。
筛选出7株具有抗菌活性的菌株,经16S rRNA系统发育分析和菌株生理生化研究,初步鉴定菌株Y171004、Y172014、Y174007、Y177001、Y177002为芽孢杆菌属;菌株Y173005为假单胞菌属,菌株Y174017为肠杆菌属。菌株Y177001和菌株Y177002能在25~50 ℃之间生长良好,并且在盐浓度为 0~7%的环境下均能生长,具有较广的生长盐度范围和较广的生长温度范围,具有耐高温的特性和一定的嗜盐性。
其中菌株Y171004和Y177002能不同程度地抑制核盘菌的生长。菌株Y171004的分泌物会引起病原菌丝的皱缩,与申光辉等的研究结果[12]相似。肉眼观察抗菌圈周围的菌丝较疏松;菌株Y177002的分泌物会引起病原菌丝膨大、变粗且变黑,与顾彪等研究的结果[13]相似。经硫酸铵沉淀耐热性分析后确定菌株Y171004的抗菌物质为热不稳定性蛋白。最终确定抗菌活性部分有待进一步研究。
参考文献:
[1]张建忠,邵兴华,肖红艳. 油菜菌核病的发生与防治研究进展[J]. 南方农业学报,2012,43(4):467-471.
[2]张斯媚. 我国油菜生产现状及发展前景分析[J]. 农村经济与科技,2016,27(20):35-35.
[3]苗昌泽. 油菜春季常见病害的防治[J]. 植物医生,2002,15(1):14.
[4]李丽丽. 世界油菜病害研究概述[J]. 中国油料作物学报,1994(1):79-81.
[5]陈桂华. 油菜病害的发生与防治[J]. 农药,1996(9):6-7.
[6]刘云霞. 植物内生细菌的研究与应用[J]. 植物保护,1994,20(5):30-32.
[7]Thompson J D,Gibson T J,Plewniak F,et al. The CLUSTAL X windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools[J]. Nucleic Acids Research,1997,25(24):4876-4882.
[8]Tamura K,Stecher G,Peterson D,et al. MEGA6:molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution,2013,30(12):2725-2729.
[9]胡昌勤,刘 炜. 抗生素微生物检定法及其标准操作[M]. 北京:气象出版社,2004.
[10]张晓云. 枯草芽孢杆菌菌株CAB-1抑菌物质的分离鉴定及活性分析[D]. 保定:河北农业大学,2011.
[11]Stackebrandt E,Goebel B M. Taxonomic note:a place for DNA-DNA reassociation and 16S rRNA sequence analysis in the present species definition in bacteriology[J]. Int J Syst Evol Microbiol,1994,44(4):846-849.
[12]申光辉,薛泉宏,张 晶,等. 草莓根腐病拮抗真菌筛选鉴定及其防病促生作用[J]. 中国农业科学,2012,45(22):4612-4626.
[13]顾 彪,宗兆锋,赵 华. 几种生防放线菌离体颉颃作用测定[J]. 西北农林科技大学学报(自然科学版),2005,33(增刊1):140-142.
