NaCl胁迫对小麦苗期和灌浆期生理生化特性及产量性状的影响
2019-10-25陈刘平陈巧艳李新华
陈刘平 陈巧艳 李新华


摘要:研究NaCl胁迫对小麦生理生化及产量的影响,为小麦耐盐品种的选育及筛选耐盐基因提供理论依据。以相对耐盐品种百农207和相对盐敏感品种华育198为材料,在小麦幼苗期[NaCl浓度为0(CK)、50、100、150、200、250 mmol/L,时间梯度为1、2、3 d]和灌浆期[NaCl浓度为0(CK)、300、600、900、1 200 mmol/L,梯度为5、10 d]进行NaCl处理,研究NaCl胁迫下小麦生理生化特性的变化,并在成熟期调查结实率及千粒质量。结果表明:随NaCl浓度增加,结实率和千粒质量逐渐降低,百农207结实率和千粒质量分别较对照降低17.94%、56.49%,而华育198分别较对照降低87.4%、84.34%。苗期(50 mmol/L)和灌浆期(300 mmol/L)低浓度NaCl胁迫可以增加叶绿素含量,但是高浓度NaCl胁迫明显降低叶绿素含量;苗期和灌浆期NaCl胁迫使光合速率、气孔导度、蒸腾速率、可溶性蛋白含量下降,胞间二氧化碳浓度和脯氨酸含量上升。苗期,NaCl胁迫使SOD和POD活性、MDA含量升高,CAT活性在NaCl胁迫后3 d逐渐下降;但灌浆期,NaCl胁迫使SOD、POD和CAT活性、MDA含量均升高。百农207受NaCl胁迫的影响程度小于华育198,表现出较好的耐盐性。在NaCl胁迫下,耐盐品种表现出较强的抗氧化能力与调节细胞渗透势的能力,维持体内水分平衡,增强对NaCl胁迫的适应性。
关键词:小麦;NaCl胁迫;生理生化特性;产量性状
中图分类号: S512.101;Q945.78 文献标志码: A 文章编号:1002-1302(2019)13-0085-06
生物和非生物逆境是影响植物生长发育的重要限制性因素。高温、低温、干旱和盐碱等非生物逆境胁迫严重影响作物的生长,其中土壤盐渍化是影响其生产并造成产量大幅减产的主要因素之一。目前,世界上受盐渍化影响的土地有9.55亿hm2,我国有2 600万hm2,其中盐碱地约660万hm2[1]。土地盐渍化限制了作物的生长发育,造成了农作物减产,是影响农业生产的一个主要环境因素。预计至2050年,世界人口将达到96亿左右,这代表全球的粮食总产量至少要增加70%才能维持人们的正常生活所需。小麦是世界上第一大粮食作物,是人类主要的食物来源[2]。盐胁迫会导致小麦生长发育受抑制,繁殖能力降低,产量降低,甚至造成绝产。在我国黄淮海冬麦区和新疆麦区存在大量盐碱地,对小麦生产造成巨大危害,制约着小麦产量的提高[3]。因此,为满足日益增长的人口对粮食的需求、研究小麦的抗盐性以及筛选抗盐品种,已成为当今国内外专家的研究热点。小麦耐盐性是多基因控制的数量遗传性状,涉及诸多基因和多种耐盐机制的协调作用,并且不同品种间存在耐盐性差异[4]。耐盐性鉴定是小麦种质资源鉴定评价、耐盐品种选育以及耐盐机理研究的基础性研究。众多学者利用不同的生理生态指标对小麦幼苗耐盐性进行评价,而对其生育时期的研究较少。在试验前期以小麦品种周麦18、百农207、华育198、百农69和百农AK58为材料,在初步研究了NaCl胁迫对小麦种子发芽率和根、苗生长的影响的基础上,筛选出相对耐盐品种百农207和相对盐敏感华育198[5],进而研究苗期和灌浆期NaCl胁迫对百农207、华育198生理生化及产量的影响,为小麦耐盐机制及相关基因的研究提供理论参考。
1 材料与方法
1.1 试验材料
本试验供试材料是2个半冬性小麦品种,分别为华育198、百农207,均为河南科技学院小麦遗传改良中心提供。
1.2 试验设计
1.2.1 幼苗期NaCl胁迫 试验于2016—2017年在河南科技学院作物育种实验室和辉县市中小营试验基地进行。先将小麦种子用0.1% HgCl2消毒3 min,用蒸馏水冲洗干净,然后在蒸馏水中浸泡至种子萌动,在已打好孔的泡沫塑料板中种植20粒/孔种子,进行水培试验。定时通气,每天更换1次水,待苗长至2叶1心时,配制50、100、150、200、250 mmol/L NaCl溶液,用配制好的NaCl溶液对2个品种进行处理,每个处理用相同体积的NaCl溶液,对照为相同体积的蒸馏水;分别胁迫1、2、3 d,测定光合性状指标,每个处理取1 g叶片,放入离心管中,每个离心管放0.2 g,然后于-80 ℃低温冰箱保存。
1.2.2 灌漿期NaCl胁迫 选用直径为21 cm、深为25 cm的塑料盆,每盆装同样的土,以确保相同的试验条件。挑选具有发芽能力的种子(无病虫害、有胚),于2016年10月8日播种,均匀地撒播15粒种子在盆中,置于自然条件下使其生长。灌浆期用不同浓度的NaCl进行处理,浓度分别为300、600、900、1 200 mmol/L,每盆浇1 200 mL,对照为浇同样量的蒸馏水继续培养,胁迫时间为5、10 d,分别测定光合作用,然后取样保存至-80 ℃低温冰箱,以测生理指标。成熟期收获,调查其结实率和千粒质量。
1.3 测定指标与方法
1.3.1 生理指标及产量因素的测定 叶绿素含量的测定采用丙酮乙醇混合浸提法(鲜质量)[6];脯氨酸含量的测定采用茚三酮法[7];可溶性蛋白含量的测定采用考马斯亮蓝G-250染色法[8];过氧化物酶(POD)活性的测定采用愈创木酚法[9];超氧化物歧化酶(SOD)活性的测定采用氮蓝四唑法[9];CAT活性的测定参照Jiang等的方法[10];丙二醛(MDA)含量的测定采用硫代巴比妥酸法[11];成熟期调查小麦的结实率及千粒质量。
1.3.2 光合作用气体交换参数的测定 选取各处理叶片,使用LI-6400(美国LI-COR公司)光合测定仪测定NaCl胁迫前后2个小麦品种的光合性状指标,其中包含净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、细胞间CO2浓度(Ci),测量时间在08:30—11:30。
1.4 数据处理
采用Excel 2010和DPS软件对试验数据进行统计分析,采用Duncan氏新复极差法进行多重比较。
2 结果与分析
2.1 NaCl胁迫对产量性状的影响
由图1可以看出,2个品种在NaCl胁迫下,结实率、千粒质量均较CK下降。随NaCl浓度的增加,结实率逐渐下降,NaCl浓度达1 200 mmol/L时,百农207和华育198结实率分别较CK降低17.94%和87.1%;千粒质量分别较对照降低56.9%和84.34%。
2.2 NaCl胁迫对小麦幼苗生理指标的影响
2.2.1 NaCl胁迫对小麦幼苗叶绿素含量的影响 由图2可以看出,NaCl处理后,2个品种叶绿素含量均在NaCl浓度 50 mmol/L 处理后1 d时较CK略有增加,分别较对照增加14.72%和14.22%,其余NaCl处理浓度处理的叶绿素含量均较CK减幅减小,随胁迫时间延长,叶绿素含量逐渐下降,且下降幅度逐渐增大,浓度越大,降幅也越大,总体上华育198降幅大于百农207。在相同NaCl浓度下,百农207叶绿素含量高于华育198,说明百农207受NaCl胁迫伤害程度较轻。
2.2.2 NaCl胁迫对光合作用气体交换参数的影响 从图3可以看出,NaCl胁迫后,华育198和百农207净光合速率、气孔导度及蒸腾速率均降低;2个品种处理前,各指标差异较小,处理后,随NaCl浓度增加,胁迫时间延长,降幅逐渐变大。但是,随NaCl浓度增大和胁迫时间延长,胞间CO2浓度(Ci)逐渐上升,且增幅逐渐变大。在胁迫后1 d,NaCl浓度50、100 mmol/L 蒸腾速率与CK差异较小;在胁迫后3 d,NaCl浓度 250 mmol/L 的蒸腾速率最低,华育198和百农207分别较CK降低78.25%、60.5%。
2.2.3 NaCl胁迫对小麦幼苗叶片渗透调节物质含量的影响 从图4可以看出,NaCl处理后,2个品种的可溶性蛋白含量均下降,百农207的降幅小于华育198;随NaCl浓度的增加和胁迫时间延长,降幅逐渐增大。NaCl胁迫后3 d,百农207、华育198可溶性蛋白含量在250 mmol/L NaCl下分别较对照降低60.15%、66.87%。2个品种的脯氨酸含量变化趋势与可溶性蛋白含量变化相反。在胁迫后1 d,NaCl浓度为 50 mmol/L 时,2個品种的脯氨酸含量分别较对照增加 17.7%、15.86%;随着NaCl浓度的增加,2个品种的脯氨酸含量均较对照明显增加,百农207脯氨酸积累速度大于华育198;2个品种在3 d的胁迫中,脯氨酸含量增幅逐渐增大,百农207和华育198脯氨酸含量均在250 mmol/L NaCl胁迫3 d积累最多,分别为12.065 4、11.265 2 μg/g。
2.2.4 NaCl胁迫对小麦幼苗活性氧清除酶活性的影响 NaCl处理对小麦幼苗活性氧清除酶活性的影响见图5。随NaCl浓度增加,胁迫时间延长,SOD、POD、CAT活性和MDA含量均较对照增加,增幅逐渐变大。但是,在250 mmol/L NaCl胁迫后3 d时, 华育198 SOD活性下降,与此同时,百农
207和华育198 CAT活性逐渐下降,浓度越大,降幅就越大,且华育198降幅大于百农207。在NaCl胁迫下,华育198 MDA含量的积累量较百农207多。综合以上SOD、POD、CAT活性和MDA积累量可以看出,经NaCl胁迫后,百农207表现出较好的抗氧化能力,减少活性氧的伤害。
2.3 NaCl胁迫对小麦灌浆期生理指标的影响
2.3.1 NaCl胁迫对小麦灌浆期叶绿素含量的影响 NaCl胁迫对小麦灌浆期叶绿素含量的影响见图6,各处理均达显著差异。300 mmol/L NaCl胁迫使百农207、华育198叶绿素含量较对照分别增加12.23%、9.15%。随着NaCl浓度的增加,2个品种的叶绿素含量均逐渐下降,百农207在各浓度 NaCl处理下分别较对照降低5.06%、7.53%、10.06%,而华育198分别较对照降低6.96%、11.78%、18.08%。
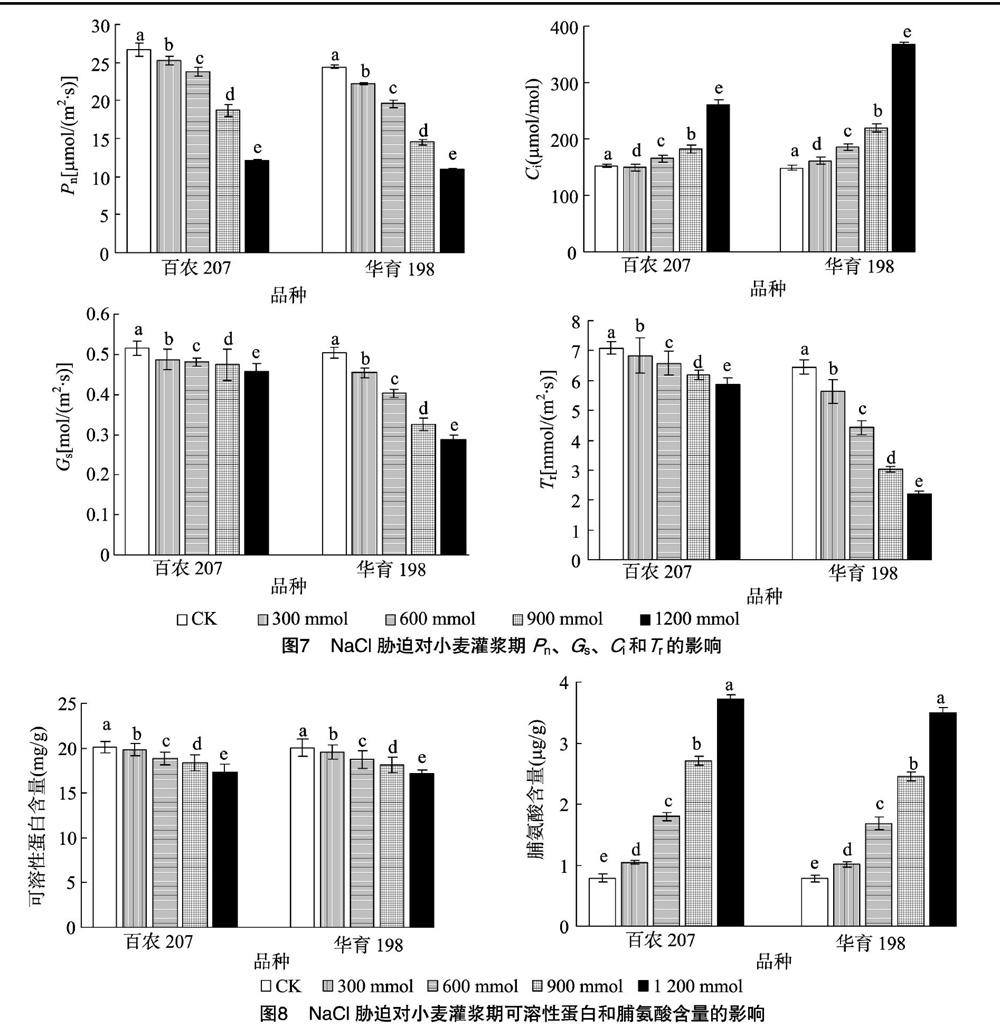
2.3.2 NaCl胁迫对小麦灌浆期光合作用气体交换参数的影响 NaCl胁迫使光合速率、胞间CO2浓度、气孔导度和蒸腾速率达显著差异(图7)。随着NaCl浓度的增加,叶片衰老较快,光合速率、气孔导度及蒸腾速率逐渐降低,胞间二氧化碳浓度逐渐上升。NaCl浓度在1 200 mmol/L时,百农207光合速率、气孔导度及蒸腾速率分别较对照降低54.67%、11.2%、17.35%,华育198分别较对照降低55.34%、43.02%、65.91%;百农207、华育198胞间二氧化碳浓度分别较对照增加70.61%、146.68%。
2.3.3 NaCl胁迫对小麦灌浆期叶片渗透调节物质含量的影响 由图8可知,不同处理间蛋白质含量和脯氨酸含量达显著差异。随着NaCl浓度的增加,2个小麦品种可溶性蛋白含量呈下降趋势,脯氨酸含量反之。百农207可溶性蛋白含量下降幅度较小,华育198降幅大于百农207。在NaCl浓度为300 mmol/L时,百农207、华育198脯氨酸含量分别较对照增加32.36%、29.09%,当浓度增加到 1 200 mmol/L 时,2个品种的脯氨酸含量分别较对照增加370.34%、346.61%。相同浓度下,百农207可溶性蛋白和脯氨酸含量大于华育198。
2.3.4 NaCl胁迫对小麦灌浆期活性氧清除酶活性的影响 由图9可以看出,百农207整体SOD、POD、CAT活性大于华育198。 在NaCl处理后, 2个品种活性氧清除酶活性均较对
照增加。随NaCl浓度的增加,百农207各处理SOD活性分别较对照增加2.56%、5.81%、8.13%、11.09%,而华育198各处理SOD活性分别较对照增加1.67%、4.08%、6.67%、9.28%。POD、CAT活性变化趋势与SOD活性类似,均是百农207增幅大于华育198。百农207各处理间MDA含量变化较小,华育198随NaCl浓度的上升,MDA含量大幅度提高,最高NaCl浓度1 200 mmol/L时,百农207、华育198分别较对照增加32.15%、125.3%。在相同NaCl浓度下,百农207 MDA含量明显小于华育198。
3 讨论与结论
NaCl胁迫极大地降低了作物的产量和质量。本试验结果显示,随NaCl浓度的增加,结实率和千粒质量逐渐下降,百农207降幅小于华育198,这与姜东等的研究结果[12-13]一致。盐胁迫不仅影响穗发育,加速叶片衰亡,使顶端发育时间缩短,而且减少成穗的小穗数、穗粒数,导致结实率和千粒质量下降。
本试验结果表明,小麦品种百农207和华育198在苗期(50 mmol/L)和灌浆期(300 mmol/L)在低浓度NaCl胁迫下均表现为叶绿素含量升高,叶绿素含量随着NaCl浓度的增加和胁迫时间的延长逐渐下降,百农207降幅小于华育198。这与翁锦周等的研究结果[14]一致。叶绿素含量是植物进行干物质积累的源,叶绿素含量的降低主要是因为对盐胁迫的应激破坏反应,通过降低叶绿素含量进而降低叶片对光能的吸收、传递、转换能力,叶绿素降解速度大于其合成速度;也有可能是因为在高浓度盐胁迫条件下,破坏了植物细胞的色素系统,进而导致叶绿素含量的下降[15]。本试验在小麦灌浆期低盐浓度下,叶绿素含量有小幅度增加,可能是因为叶绿素与叶绿体蛋白之间的结合变得松驰,叶绿素很容易被提取出来,从而植物叶绿素含量在低浓度盐胁迫下略微增加,叶面积变小,叶绿体逐渐收缩,在短期低浓度盐胁迫下植物叶片含水量较低、生长比较缓慢可能是引起叶绿素含量增加的主要原因[16]。
不同的学者对NaCl胁迫后得出光合作用气体交换参数变化的结论不同,金剑等研究发现,经NaCl胁迫后,引起光合速率降低的原因是叶绿素含量降低[17-18],但本研究发现,NaCl胁迫后光合速率降低受蒸腾速率、气孔导度、净光合速率和叶绿素含量多因素影响。盐胁迫下,胞间二氧化碳浓度较对照增加。盐胁迫下,光合速率的降低主要有2种情况,分别是气孔限制和非气孔限制[19]。本研究表明,蒸腾速率下降、胞间二氧化碳浓度增加、气孔导度下降,主要限制因素为气孔的关闭,即光合速率降低的主要因素是非气孔限制。气孔导度是叶片气体交换能力强弱的重要参数,能够直接对净光合作用产生影响[4,20-21]。华育198耐盐性较弱,原因可能是盐处理前,蒸腾速率较高,气孔导度较高,而盐胁迫下,胞间二氧化碳浓度大幅升高,气孔导度快速下降;百农207胞间二氧化碳浓度增加幅度较小,气孔导度降幅也比较小,能够维持一个相对较高的蒸腾速率,高效地利用土壤中的水分,因而华
育198光合速率小于百农207。华育198的光合参数受NaCl胁迫影响明显大于百农207,表现出对NaCl胁迫比较敏感,而百农207表现出较好的耐盐性。
当植物受到盐渍、高温等非生物胁迫时,活性氧代谢平衡被打破,具有高度氧化活性的活性氧簇(ROS)对细胞膜产生破坏作用,进而引发不饱和脂肪酸过氧化形成MDA,MDA能使膜中的酶蛋白发生交联并失活,进一步损伤细胞膜结构和功能,MDA的积累能间接地反映植物体内受氧化胁迫伤害的状况[22-23]。在本试验中,虽然百农207和华育198 SOD、POD、CAT活性在苗期和灌浆期都有增加,但百农207增加幅度大于华育198,可见小麦的抗氧化酶活性与品种对盐敏感性密切相关。盐胁迫下,小麦苗期和灌浆期MDA含量皆有所增加,華育198含量增加显著,百农207增加缓慢,即百农207增幅小于华育198。这与姚春娜等的研究结果[24-28]基本一致。抗氧化酶系统能清除活性氧,提高植物细胞抗氧化保护能力。SOD、CAT以及POD属于保护酶系统[29],其中SOD对 O-2 · 的歧化作用被认为是抵御盐害的主要因素,POD和CAT能清除在氧代谢过程中产生的H2O2[30-32]。因此,SOD、POD、CAT三者相辅相成,才能使自由基的水平保持在低状态。植物在盐胁迫条件下常常发生膜脂过氧化,造成植物体内自由基代谢平衡失调,导致MDA积累,对细胞膜结构和功能造成破坏[33],进而影响作物的生理代谢、叶片的衰老及光合效能。
参考文献:
[1]邵桂花,常汝镇,陈一舞. 大豆耐盐性研究进展[J]. 大豆科学,1993(3):244-248.
[2]姜 琳,王有婧,周 薇,等. 植物抵抗盐胁迫的生理机制[J]. 北方园艺,2016(23):190-194.
[3]张玉梅. 小麦苗期盐胁迫相关转录组表达谱及蛋白质乙酰化和琥珀酰化修饰研究[D]. 沈阳:沈阳农业大学,2016.
[4]马雅琴,翁跃进. 引进春小麦种质耐盐性的鉴定评价[J]. 作物学报,2005,31(1):58-64.
[5]李新华,陈巧艳,欧行奇,等. NaCl胁迫对不同小麦品种萌发与幼苗生长的影响[J]. 湖北农业科学,2017,56(17):3222-3224.
[6]张宪政. 作物生理研究法[M]. 北京:农业出版社,1992.
[7]董树刚,吴以平. 植物生理学实验技术[M]. 青岛:中国海洋大学出版社,2006.
[8]王晓东. 转基因小麦抗旱性生理生化及农艺性状鉴定[D]. 杨凌:西北农林科技大学,2016.
[9]孙 群,胡景江. 植物生理学研究技术[M]. 杨凌:西北农林科技大学出版社,2006.
[10]Jiang Y,Huang B. Effects of Calcium on antioxidant activities and water relations associated with heat tolerance in two cool-season grasses[J]. Journal of Experimental Botany,2001,52(355):341-349.
[11]赵海泉. 基础生物学实验指导生物化学分册[M]. 北京:中国农业大学出版社,2008.
[12]姜 东,李永庚,于振文,等. 高产冬小麦旗叶光合产物供应能力的研究[J]. 浙江大学学报(农业与生命科学版),2000,26(1):53-57.
[13]宋荷仙,李跃建,冯君成,等. 小麦收获指数和源、库性状的遗传研究[J]. 中国农业科学,1993,26(3):21-26.
[14]翁锦周,林江波,林加耕,等. 盐胁迫对桉树幼苗的生长及叶绿素含量的影响[J]. 热带作物学报,2007,28(4):15-20.
[15]Hoshida H,Tanaka Y,Hibino T,et al. Enhanced tolerance to salt stress in transgenic rice that overexpresses chloroplast glutamine synthetase[J]. Plant Molecular Biology,2000,43(1):103-111.
[16]董曉霞,赵树慧,孔令安,等. 苇状羊茅盐胁迫下生理效应的研究[J]. 草业科学,1998(5):11-14.
[17]金 剑,刘晓冰,李艳华,等. 水肥耦合对春小麦灌浆期光合特性及产量的影响[J]. 麦类作物学报,2001,21(1):65-68.
[18]王美娥,陈 明,郎有忠,等. 盐分胁迫对小麦光合生产及产量的影响[J]. 江苏农业学报,2013,29(4):727-733.
[19]彭建云. 不同抗盐性小麦品种叶绿素荧光特性与其抗盐性关系的研究[D]. 山东师范大学,2008.
[20]李树华,许 兴,惠红霞,等. 不同小麦品种(系)对盐碱胁迫的生理及农艺性状反应[J]. 麦类作物学报,2000,20(4):63-67.
[21]Amjad M,Akhtar J,Rashid M S. Evaluating the effectiveness of biofertilizer on salt tolerance of cotton (Gossypium hirsutum L.)[J]. Archives of Agronmyand Soil Science,2015,61(8):1165-1177.
[22]Maas E V,Grieve C M. Spike and leaf development of sal-stressed wheat[J]. Crop Science,1990,30(6):1309-1313.
[23]Downton W S,Loveys B R,Grant W R. Stomatal closure fully accounts for the inhibition of photosynthesis by abscisic acid[J]. New Phytologist,1988,108(3):263-266.
[24]姚春娜,裴新梧,孔英珍,等. 盐胁迫下小麦新品系89122的抗氧化酶活性和内源ABA含量变化的研究[J]. 兰州大学学报(自然科学版),2001,37(4):76-79.
[25]王晓娟,覃新程,戴若兰,等. 盐胁迫下小麦新品系89122的抗氧化酶类活性变化的研究[J]. 兰州大学学报,1999(1):144-148.
[26]高永生,陈集双. 盐胁迫下镧对小麦幼苗叶片抗氧化系统活性的影响[J]. 中国稀土学报,2005,23(4):490-495.
[27]阮海华,沈文飚,刘开力,等. 外源一氧化氮供体对盐胁迫下小麦幼苗叶片谷胱甘肽抗氧化酶系统的影响[J]. 作物学报,2005,31(9):1144-1149.
[28]张 敏,蔡瑞国,韩金玲,等. 盐胁迫对小麦萌发期幼苗抗氧化酶系统的影响[J]. 河北科技师范学院学报,2010,24(3):15-18,27.
[29]钟 兰. 盐胁迫下小麦幼苗的生理生化特性及表观遗传学研究[D]. 武汉:武汉大学,2009.
[30]许 兴,李树华,惠红霞,等. NaCl胁迫对小麦幼苗生长、叶绿素含量及Na+、K+吸收的影响[J]. 西北植物学报,2002,22(2):278-284.
[31]刘祖祺,张石城. 植物抗性生理学[M]. 北京:中国农业出版社,1994.
[32]Maas E V,Poss J A. Salt sensitivity of wheat at various growth stages[J]. Irrigation Science,1989,10(1):29-40.
[33]刘 宛,胡文玉. NaCl胁迫及外源自由基对离体小麦叶片O2和膜脂质过氧化的影响[J]. 植物生理学报,1995(1):26-29.
