筛选GPAT基因的酵母遗传互补体系的优化
2019-10-25陈丹丹刘宏波
陈丹丹 刘宏波


摘要:3-磷酸甘油酰基转移酶(glycerol-3-phosphate acyltransferase,GPAT)是甘油脂生物合成途径中催化第1步酰化反应的关键酶,参与生物体的不同代谢途径,发挥着不同的生理功能。本研究对已构建的GPAT基因酵母遗传互补筛选体系进行优化,通过替换酵母表达载体pYES2-Kan-yADH1 v1中ADH1启动子,增强目的基因的表达;同时,在酵母遗传转化后对菌株进行复苏培养,提高遗传转化效率,增加阳性菌落数目。该体系的优化将进一步提高GPAT酶的筛选效率。
关键词:3-磷酸甘油酰基转移酶;启动子;酵母;遗传互补
中图分类号: Q344+.13;S188 文献标志码: A 文章编号:1002-1302(2019)13-0064-03
三酰甘油(triacylglyceride,TAG)是植物油脂的主要储存形式,其从头合成途径受3-磷酸甘油酰基转移酶(glycerol-3-phosphate acyltransferase,GPAT)的催化,即将酰基辅酶A或酰基-ACP的酰基部分转移到3-磷酸甘油的sn-1位生成溶血磷脂酸[1],这是甘油脂从头合成途径中的第1步限速反应。因此,GPAT酶在细胞的基础代谢、植物的生长发育及油料作物的产量和品质改良等方面具有重要作用[1-3]。然而,迄今为止,植物中究竟有多少不同的基因编码线粒体和细胞质中的GPAT酶还不清楚,主要原因是缺乏有效分离和鉴定GPAT基因的手段。目前研究者常用的GPAT酶分析手段有2种,一种是利用放射性同位素标记的3-磷酸甘油来体外测定酶活性[4],但这种方法操作不便,且不适用于GPAT基因的大规模研究;另一种是利用甘油营养缺陷型Escherichia coli plsB突变体的遗传互补来研究原核生物的GPAT酶[5-6],然而该方法并不适用于真核生物的GPAT酶的筛选。雷洁等根据高等和低等真核生物中甘油脂合成中第1步酰化反应的高度保守性建立了一套可快速有效地大规模筛选真核生物GPAT基因的酵母遗传互补体系,该体系是基于在组成型ADH1启动子下外源候选GPAT基因的表达可以恢复gat1/gat2双敲除酵母菌株在葡萄糖培养基中的生长缺陷所建立的[7]。
乙醇脱氢酶Ⅰ的酵母ADH1启动子全长约1 500 bp,该片段中的上游启动子元件激活后,酵母的乙醇脱氢酶ADH1基因会转录成一段较长的mRNA,同时由于存在多个起始和终止密码子,导致ADH1酶无法正常翻译,这被认为是一个下调机制[8]。研究发现,不同长度的ADH1启动子的活性有所不同,截断的ADH1启动子具有组成型活性[9],如Ruohonen等发现在解淀粉芽孢杆菌α-淀粉酶代谢中,酵母的乙醇脱氢酶ADH1p将乙醛还原成乙醇[10],当ADH1启动子序列上游的1 100 bp(-414~-1 500 bp)去除之后,短的启动子只在乙醇产生后期有活性[11],将上游的300 bp(-414~-700 bp)保留后,在整个乙醇产生阶段都有ADH1启动子的活性[12]。Santangelo等发现,ADH1启动子的活性与启动子上-664~-652 bp的UAS保守序列有关[13],该顺式作用元件与上游转录因子结合来激活转录。
为了提高GPAT基因的筛选效率,本研究对该酵母遗传互补体系进行优化。本试验在Lei等用的397 bp(-670~-1 066 bp)ADH1啟动子的基础上[7],继续延长上游307 bp(-363~-669 bp)的序列,得到长度为 704 bp 的ADH1启动子序列,以At5g06090基因作为参考基因比较2种启动子对基因表达的影响;同时,在酵母遗传转化时对酵母双突变体转化菌株进行复苏培养,以期提高外源GPAT基因的表达和筛选效率。
1 材料与方法
1.1 704 bp ADH1启动子的PCR扩增
采用玻璃珠法提取野生型酵母菌株BY4742的基因组DNA,根据GenBank报道的ADH1启动子序列,以表1所示引物FP1和RP1进行第1次扩增,以表1所示含酶切位点的引物FP2和RP2进行第2次扩增。
1.2 重组酵母表达载体的构建
以Lei等构建的yADH1-Kan-pYES2 v1质粒为骨架[7],用限制性内切酶SpeⅠ分别对载体和回收纯化后的第2次PCR产物酶切2 h,胶回收酶切产物及载体去磷酸化后,将ADH1启动子片段和yADH1-Kan-pYES2 v1质粒载体在 16 ℃ 下连接过夜。
取2 μL连接产物转化50 μL大肠杆菌DH5α感受态细胞,涂于具有氨苄抗性的LB固体培养基上培养过夜。在含有转化子的平板上随机挑取6个单菌落,在含有氨苄抗性的LB液体培养基扩繁培养后经菌液PCR验证并测序,引物FP1和RP3见表1。将含有704 bp ADH1启动子的重组质粒命名为yADH1-Kan-pYES2 v2。
以At5g06090-YEplac181质粒为模板,扩增At5g06090基因,引物见表1,之后进行BglⅡ和XhoⅠ双酶切,yADH1-Kan-pYES2 v2重组质粒进行BamHⅠ和XhoⅠ双酶切,酶切产物回收后在16 ℃下连接过夜,转化DH5α感受态细胞,涂于具有氨苄抗性的LB固体培养基上培养过夜;提取阳性单克隆的质粒,经BamHⅠ和SpeⅠ进行双酶切验证。
1.3 2种ADH1启动子对目的基因表达的效果比较
通过LiAc法把2种重组质粒导入Lei等构建的酵母菌株ZAFU1中[7],以空载体为阴性对照。在涂板前,对含有2种重组质粒的酵母双突变体均作复苏和不复苏培养,复苏即将涂板前的菌体在含2%葡萄糖和全氨基酸的液体培养基中培养4 h,最后都在含2%葡萄糖和2%半乳糖的酵母氨基酸缺陷型合成固体培养基[SC/-ura(尿嘧啶)-his(组氨酸)-leu(亮氨酸)]固体培养基中培养3 d,观察菌落的生长状况,对菌落进行计数。
随后,利用浓度梯度稀释试验(初始D600 nm为1),即用液体培养基培养半乳糖和葡萄糖培养基上生长的菌落,再依次稀释5倍,分别点在含半乳糖或葡萄糖的SC/-ura-his-leu固体培养基中进行培养,比较不同长度启动子以及转化后培养条件对外源基因表达的影响和互补效果。
1.4 验证ZAFU1中的At5g06090基因
分别提取转化后复苏与未复苏培养的葡萄糖培养基上的酵母双突变体的基因组DNA和酵母表达质粒的混合物,进行PCR验证,引物FP3和RP3见表1。
2 结果与分析
2.1 704 bp ADH1启动子的获得
以提取的野生型酵母基因组DNA为模板,将扩增得到的704 bp的ADH1启动子序列替换yADH1-Kan-pYES2 v1上的397 bp的序列,经菌落PCR扩增出1条大小为848 bp的条带,结果见图1。
2.2 At5g06090-yADH1-Kan-pYES2 v2载体的双酶切鉴定
由图2可见,经限制性内切酶BamHⅠ和SpeⅠ双酶切后,经琼脂糖凝胶电泳显示,重组质粒在6.8 kb(载体片段位置)出现1条相应的条带,在200、1 500 bp左右(目的片段位置)各出现1条条带,说明At5g06090基因已经插入到yADH1-
Kan-pYES2 v2质粒中。
2.3 2种ADH1启动子对目的基因表达的效果比较
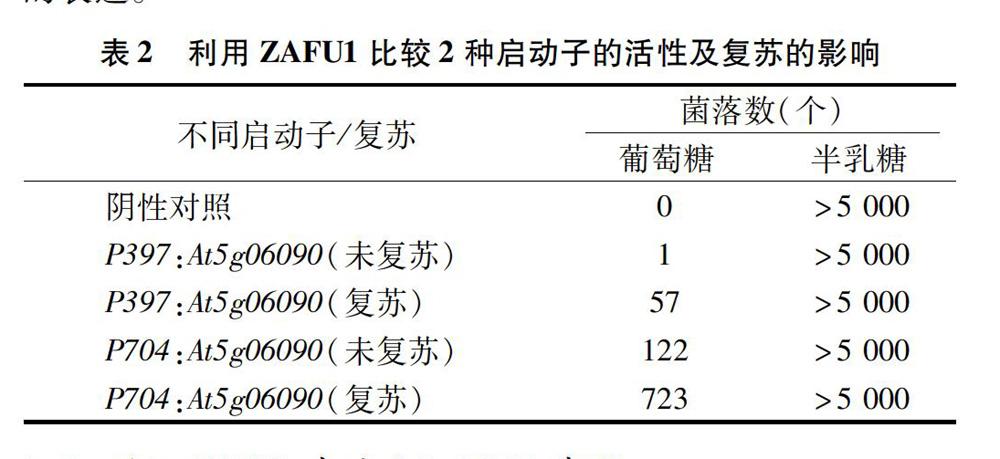
将2种重组质粒及对照质粒转化ZAFU1,统计培养3 d后不同培养基上生长的菌落数,结果见表2。将半乳糖和葡萄糖上的单个菌落按1 ∶ 5稀释,涂布在含半乳糖或葡萄糖的SC/-ura-his-leu固体培养基中,菌落生长情况见图3。替换后的启动子及复苏培养可以增加菌落数,初步说明At5g06090基因在704 bp启动子的作用下能够增强目的基因的表达。
2.4 验证ZAFU1中的At5g06090基因
提取在葡萄糖培养基中生长的酵母表达质粒和基因组DNA的混合物,经PCR可扩增出1条包含At5g06090基因的1 726 bp的条带,说明重組质粒存在于酵母双突变体中,结果见图4。
3 讨论与结论
利用酵母异源互补的方法研究目的基因的功能,已成为研究人员常用的生物学研究手段,如利用酵母异源互补研究铁、锌等离子转运蛋白的功能[14]。本研究的酵母遗传互补体系是利用gat1/gat2缺陷型酵母菌株在葡萄糖上的生长依赖于外源GPAT基因的表达所建立的,而外源基因的表达受ADH1启动子的控制,有文献报道ADH1启动子的5′末端区域有类似于转录起始位点和调节蛋白ADR1结合位点的序列[15],这些序列元件决定启动子的作用。本研究将启动子的长度延长至704 bp,利用At5g06090基因验证发现替换后的启动子确实能够增强目的基因的表达,复苏后也可以增加葡萄糖培养基上的菌落数,可能在复苏时,全营养培养基能够为活性不太高的菌株提供营养,使其恢复到正常生长状态。但基因的表达水平不仅取决于启动子[16-19],还与基因的拷贝数相关[20],在转化中,虽然总质粒数是相同的,但每个酵母单细胞所含有的质粒数是不可控制的,从表型上看,替换后的启动子可以增强目的基因的表达,这与文献报道一致,但仍需要进行基因的表达量分析来进一步验证候选GPAT基因的遗传互补功能。
参考文献:
[1]刘 聪,肖旦望,施春霖,等. 植物GPATs基因研究进展[J]. 遗传,2013,35(12):1352-1359.
[2]刘继梅,陈善娜,鄢 波,等. 不同抗冷性水稻中编码甘油-3-磷酸转酰酶的部分cDNA的序列比较研究[J]. 云南植物研究,2000(3):317-321.
[3]Zheng Z,Xia Q,Dauk M,et al. Arabidopsis AtGPAT1,a member of the membrane-bound glycerol-3-phosphate acyltransferase gene family,is essential for tapetum differentiation and male fertility[J]. The Plant Cell,2003,15(8):1872-1887.
[4]Zheng Z F,Zou J T. The initial step of the glycerolipid pathway-identification of glycerol 3-phosphate/dihydroxyacetone phosphate dual substrate acyltransferases in Saccharomyces cerevisiae[J]. Journal of Biological Chemistry,2001,276(45):41710-41716.
[5]Lewin T M,Wang P,Coleman R A. Analysis of amino acid motifs diagnostic for the sn-Glycerol-3-phosphate acyltransferase reaction[J]. Biochemistry,1999,38(18):5764.
[6]Lindner S E,Sartain M J,Hayes K,et al. Enzymes involved in plastid-targeted phosphatidic acid synthesis are essential for Plasmodium yoelii liver-stage development[J]. Molecular Microbiology,2014,91(4):679-693.
[7]Lei J,Miao Y C,Lan Y,et al. A novel complementation assay for quick and specific screen of genes encoding glycerol-3-phosphate acyltransferases[J]. Frontiers in Plant Science,2018,9:353.
[8]Ammerer G. Expression of genes in yeast using the ADCI promoter[J]. Methods in Enzymology,1983,101:192-201.
[9]Demarini D J,Carlin E M,Livi G P. Constitutive promoter modules for PCR-based gene modification in Saccharomyces cerevisiae[J]. Yeast,2001,18(8):723-728.
[10]秦丽娜,江贤章,田宝玉,等. 酿酒酵母乙醇脱氢酶Ⅰ基因的超表达[J]. 微生物学通报,2008(2):261-266.
[11]Ruohonen L,Penttil M,Kernen S. Optimization of Bacillus a-mylase production by Saccharomyces cerevisiae[J]. Yeast,2010,7(4):337-346.
[12]Ruohonen L,Aalto M K,Keranen S. Modifications to the ADH1 promoter of Saccharomyces cerevisiae for efficient production of heterologous proteins[J]. Journal of Biotechnology,1995,39(3):193-203.
[13]Santangelo G M,Tornow J. Efficient transcription of the glycolytic gene ADH1 and three translational component genes requires the GCR1 product,which can act through TUF/GRF/RAP binding sites.[J]. Molecular and Cellular Biology,1990,10(2):859-862.
[14]張 怡,李成伟. 酵母异源功能互补在植物基因克隆中的应用[J]. 生物技术通报,2010(7):14-21.
[15]Vainio A I. Effect of upstream sequences of the ADH1 promoter on the expression of Hormoconis resinaeglucoamylase P by Saccharomyces cerevisiae[J]. FEMS Microbiology Letters,1994,121(2):229-235.
[16]李 蔚,李育阳. 酵母ADH2-SUC2融合启动子的构建及其对基因表达的调控[J]. 遗传学报,1997(6):561-568.
[17]金晓媚,马雁冰. 用于异源基因表达的毕赤酵母启动子研究进展[J]. 微生物学杂志,2015(3):71-74.
[18]彭 雷,赵 艳,马银花. 褐飞虱组蛋白H3与H2A基因启动子克隆与序列分析[J]. 江苏农业科学,2017,45(23):30-32.
[19]熊冬琴,黄子栋,彭 琦,等. 甘蓝型油菜ALS基因启动子克隆及其瞬时表达分析[J]. 江苏农业科学,2018,46(23):60-65.
[20]李 兵,庄国强,林建强,等. 纤维素酶基因在毕赤酵母中的拷贝数对其表达的影响[J]. 生物加工过程,2006,4(4):12-16.
