水稻穗型相关性状的QTLs定位
2019-10-25翟雪张栩连光倩
翟雪 张栩 连光倩


摘要:稻穗大小是决定水稻产量的重要性状,为了挖掘与穗型相关的基因,为水稻产量遗传育种研究提供理论基础和应用价值,以大穗籼稻地方品种宝大粒(BDL)和小穗粳稻品种矮格拉(AGL)为亲本,构建F2代群体,对穗型性状进行数量性状座位(QTL)初步分析;根据F2群体定位结果,标记选择区间杂合体,自交构建F4分离群体,验证QTL位点。结果表明,在F2群体中共检测到与5个穗型相关性状的6个QTLs,分别位于第2、6、7染色体上。二次枝梗数QTL qNSB7和一次枝梗数QTL qNPB7定位于第7染色体的RM542~A83区间,LOD值(表示连锁可能性的大小)分别为10.84和5.03,分别解释30.74%和12.34%的表型变异,并且在其相邻的A85~A28和A83~A85区间分别检测到每穗颖花数QTL qSNP7和穗长QTL qPL7,LOD值分别为5.31和4.12,表型贡献率分别为14.80%和11.82%。另外,在第2染色体上检测到1个穗长QTL qPL2,LOD值为3.76,表型贡献率为9.12%;在第6染色体上检测到1个结实率QTL qSSR6,LOD值为4.34,表型贡献率为11.26%。以qNSB7为目标QTL,在F4分离群体中进行验证,结果表明,qNSB7仍位于RM542和A83标记之间,LOD值为9.84,解释了30.74%的表型变异,且其他3个QTLs qSNP7、qPL7和qNPB7都聚集在这317 kb的区间,解释了17.2%~24.6%的表型变异。由结果可知,qNSB7是1个通过增加二次枝梗数,影响每穗颖花数、一次枝梗数和穗长的一因多效新位点。
关键词:水稻;穗型相关性状;QTL定位
中图分类号: S511.03 文献标志码: A 文章编号:1002-1302(2019)13-0059-05
水稻是最重要的粮食作物,提高水稻产量成为解决未来粮食危机的重要手段,也是水稻育种和生产的主要目标。影响水稻产量的因素很多,而单位面积产量可以被解析为穗数和单穗谷粒质量,后者更具有生产意义。单穗谷粒质量由每穗颖花数、结实率和千粒质量3个因素构成,增加每穗颖花数是最重要的高产育种方向和栽培策略。作为重要的穗部性状,每穗颖花数与一次枝梗数、二次枝梗数、穗长等性状密切相关。这些性状在不同群体和环境中定位的数量性状座位(QTL)结果有较大的差异,被认为是受多基因控制的数量性状,且受遗传背景和环境影响[1]。目前已经定位的有关水稻穗部性状的QTLs有很多,不均匀地分布于水稻基因组中[2-6]。例如,Luo等利用1套以籼稻高产栽培品种桂朝2号为背景的普通野生稻的渐渗系,检测到39个穗部性状的QTLs,包括穗长、一次枝梗数、二次枝梗数、每穗颖花数和小穗密度[7]。大多数控制穗相关性状的QTLs都集中在同一染色体上,这就解释了这些性状之间的显著相关性。
近年来,一些穗部性状的QTLs被解析为单一遗传因子从而得到图位克隆。Gnla是首个被克隆的水稻穗粒数QTL,Gnla是1个与细胞分裂素氧化酶/脱氢酶高度同源的OsCKX2基因[8]。OsCKX2表达量的降低会引起花序分裂组织中细胞分裂素的积累,从而增加颖花数量,提高产量。DEP1是控制水稻直立穗的基因[9],突变的DEP1通过促进细胞分裂,使稻穗变密,枝梗数増加,穗粒数增加,而穗颈节长度变短。LAX2[10]/Gnp4[11]编码1个核蛋白,调控水稻腋生分生组织的形成。LAX2能与LAX1蛋白互作,通过调控穗型疏密程度来影响每穗粒数。OsSPL14是调控水稻株型和穗型的基因[12],OsSPL14突变后,使水稻分蘖数减少,穗粒数、千粒质量增加。LP(EP3)是大穗基因,编码1个富含Kelch的F-box蛋白,集中在枝梗原基区域表达,主要调控穗型[13]。PROG1编码1个由167个氨基酸组成的锌指转录因子,主要在腋芽分裂组织中表达[14]。在水稻的进化过程中,PROG1功能丧失,由匍匐生长变成直立生长,株型得到改良,而且穗粒数增加,产量大幅度提高。SP1编码1个可能的多肽转运蛋白(PTR),是控制枝梗延伸、决定穗长的基因[15-16],突变体(short panicle1,简称sp1)稻穗变短。
本研究以大穗大粒籼稻地方品种宝大粒(BDL)和小穗粳稻品种矮格拉(AGL)为亲本,通过构建F2群体和F4次级分离群体,在第7染色体的RM542和A83区间定位并确认了1个通过增加二次枝梗数,提高每穗颖花数,同时影响一次枝梗数、穗长的一因多效QTL,为后续进行精细定位、克隆和机制的研究提供重要基础。
1 材料与方法
1.1 试验材料
本研究材料以大穗籼稻品种宝大粒(BDL)、小穗粳稻品种矮格拉(AGL)为亲本,杂交获得F1代,F1代自交获得F2代分离群体(182个单株),用于QTL的初定位。根据F2代结果,标记选择目标QTL区间杂合型F2代,种植鉴定F2 ∶ 3家系(60株)。在目标性状分离、其他农艺性状相对一致的F2 ∶ 3家系中,再次选择区间杂合体,种植F3 ∶ 4次级分离群体,用于验证定位结果。2015年种植F2群体,2016年种植F3群体,2017年种植F4群体,以上群体都种植于南京农业大学江浦试验站,单株栽插,株距16.7 cm,行距20.0 cm,按照田间常规方法进行种植管理。
1.2 性状调查
在完熟期对应DNA取样编号进行取样,每株收取3个较大的稻穗(边行和边株不取样),装入纸袋,于室内调查穗长、一次枝梗数、二次枝梗数、每穗颖花数和结实率,将3穗平均值作为该植株表型值。取穗颈节至穗顶(不含芒)的距離为穗长(精确至0.1 cm),随后依次调查一次枝梗数、二次枝梗数、每穗颖花数和结实率。穗部性状调查后,将同一单株的种子装回纸袋,晒干,以备后代种植。
1.3 DNA提取和PCR扩增
在移栽定苗后的分蘖盛期,按田间材料、行、株编号,采集各单株的幼嫩叶片,同时采集亲本叶片,用于提取总DNA。DNA的提取采用Dellaporta等提出的十六烷基三甲基溴化铵(CTAB)提取方法[17]。
PCR反应体系:采用10 μL体系,含有1 μL DNA(20 ng/μL),各0.5 μL正反向引物(10 μmol/L),0.2 μL dNTPs(2.5 mmol/L),1 μL 10×Buffer(含Mg2+),0.1 μL Taq聚合酶(2.5 U/μL),6.7 μL ddH2O。PCR扩增程序:95 ℃ 5 min;95 ℃ 40 s,55 ℃ 40 s,72 ℃ 40 s,32个循环;72 ℃ 10 min;10 ℃保存。PCR产物采用聚丙烯酰胺凝胶电泳(PAGE)进行檢测,银染显色,读带,用数码相机拍照并记录试验结果。
1.4 简单重复序列(simple sequence repeats,简称SSR)的引物筛选和InDel标记开发
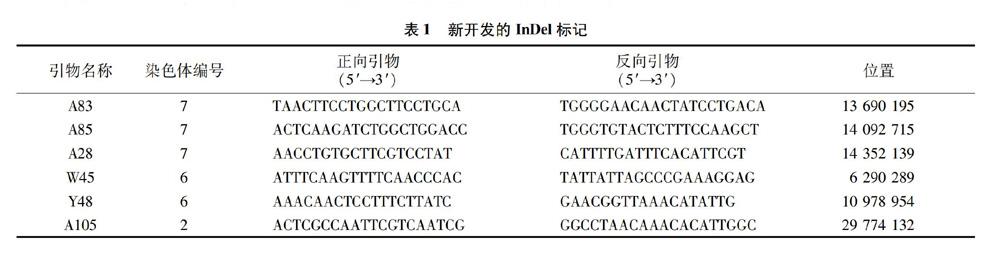
SSR标记和InDel标记是群体遗传作图的标记。SSR标记都是公开的引物(详见Gramene网站)。InDel标记的设计依据日本晴与93-11水稻基因组序列同一座位上插入和缺失碱基的差异,采用Primer 5软件或通过RiceVarMap(http://ricevarmap.ncpgr.cn/)在网上设计引物,经NCBI(美国国立生物技术信息中心)网站(http://blast.ncbi.nlm.nih.gov/)验证引物序列在水稻基因组中的唯一性。标记的物理位置参照日本晴基因组序列。SSR引物和InDel引物均由南京擎科生物科技有限公司合成。涉及QTL位点的InDel标记引物序列见表1。
1.5 QTL分析
用SSR引物和InDel引物对亲本宝大粒与矮格拉的多态性进行筛选,选取具有多态性且条带清晰、易于区分的引物作为候选引物,用于后续使用。用NCBI的Primer-BLAST对候选引物进行物理距离查询。然后对候选引物进行表型和标记基因型关联分析,并根据分子标记所显示的基因型,结合群体表型,采用软件QTL IciMapping 3.30的Mapping和Bipping功能进行遗传连锁图谱的构建和QTL定位。采用完备加性区间的方法,以LOD值(表示连锁可能性的大小)>3.0作为QTL存在的阈值,运算1 000次。
2 结果与分析
2.1 穗型性状表型的鉴定
亲本宝大粒(BDL)和矮格拉(AGL)的穗型差异极大(图1-A、图1-B)。宝大粒是一个大穗型品种,其穗长为(29.3±3.7) cm,一次枝梗数为(15.3±0.9)个,二次枝梗数多达(40.3±3.7)个,每穗颖花数为(230.4±9.6)粒,结实率为(78.0±2.0)%。相反,矮格拉是一个小穗型品种,其穗长仅为(14.2±1.2) cm,一次枝梗数为(5.8±0.8)个,二次枝梗数为(4.7±1.0)个,每穗颖花数为(40.2±3.7)粒,结实率为(91.1±1.0)%。由图1-C、表2可以看出,F2群体的穗部性状中,穗长、一次枝梗数、二次枝梗数、每穗颖花数和结实率在F2群体的变异幅度分别为13.7~39.1 cm,0.7~18.7个,1.7~51.0个,36.2~270.7粒,2.70%~98.46%,说明这5个性状在F2群体中分离明显,但均呈正态连续分布(图2),符合典型的数量性状特征。
2.2 穗型相关性状的QTL分析
利用1 300对SSR引物和InDel引物在亲本宝大粒与矮格拉之间筛选多态性标记,筛选出共显性标记150个,多态率仅为11.5%。从中挑选出均匀覆盖水稻全基因组的90个标记,用于鉴定F2群体(182株)的基因型,构建连锁图,分析穗型相关的5个性状的QTLs。
QTL分析结果显示,共检测到穗长(PL)、一次枝梗数(NPB)、二次枝梗数(NSB)、穗粒数(SNP)和结实率(SSR)5个穗型性状的6个QTLs(表3)。二次枝梗数QTL qNSB7和一次枝梗数QTL qNPB7定位于第7染色体的RM542~A83区间,LOD值分别为10.84和5.03,表型贡献率分别为30.74%和12.34%,并且在其相邻的A85~A28和A83~A85区间分别检测到每穗颍花粒数QTL qSNP7和穗长QTL qPL7,LOD值分别为5.31和4.12,表型贡献率分别为14.80%和11.82%。即在RM542和A28之间约1 Mb的物理区间内检测到这4个与穗型相关的QTLs,均表现出正向加性效应,即增效位点来自同一个亲本宝大粒。这一结果与表型间高度相关的结果(表4)吻合,说明该区间存在紧密连锁或一因多效的穗型性状QTL。
此外,在第2染色体的InDel标记A105和SRR标记RM14001之间检测到1个穗长QTL qPL2,LOD值为3.76,解释了9.12%的表型变异。在第6染色体的W45和Y48之间检测到影响结实率的QTL qSSR6。
2.3 qNSB7位点的验证
鉴于qNSB7有较大的LOD值和表型贡献率,且该区间存在其他3个相邻穗部性状QTLs,因此将其作为目标QTL作进一步研究。为了避免背景不一致而影响表型鉴定的可靠性,笔者从F2代开始连续利用连锁标记选择杂合体自交,建立1个由151个植株组成的F4分离家系(编号为17-6503的家系),对F2定位结果进行验证。QTL分析显示,qNSB7仍位于RM542和A83标记之间,LOD值为9.84,解释了30.74%的表型变异。并且,其他3个穗型QTLs qSNP7、qNPB7和qPL7都聚集在这个区间,解释了17.2%~24.6%的表型变异(表5)。因此认为,qNSB7在不同世代间可以重演,能稳定遗传。
以RM542标记为参照,分析该家系不同基因型的二次枝梗数、每穗颖花数、一次枝梗数和穗长的数量分布。二次枝梗数呈正态分布, 矮格拉纯合基因型的二次枝梗数分布在 1.0~22.0个范围内,其平均值为(11.45±5.44)个;宝大粒纯合基因型分布在7.3~36.0个范围内,平均值为(21.61±7.55)个;而杂合体的平均值为(18.45±8.44)个,分布范围覆盖了双亲基因型范围,说明qNSB7是1个半显性QTL(图3)。每穗颖花数呈相似的分布特征,矮格拉纯合基因型分布在 34.0~136.5粒范围内,平均值为(89.95±28.01)粒;宝大粒纯合型分布在66.0~181.7粒范围内,其平均值为(124.18±30.15)粒;杂合体的平均值为(110.10±39.26)粒,分布范围覆盖了双亲基因型。一次枝梗数、穗长的分布特征类似于上述性状。因此可以确认qNSB7的定位区间。由于2种纯合型的表型值相互重叠,难以从个体表型值定性判断基因型。尽管在这151个植株中有5个重组型个体,但是仍需要后代群体的平均表型值和变异度来确定基因型。
[9]Huang X Z,Qian Q,Liu Z B,et al. Natural variation at the DEP1 locus enhances grain yield in rice[J]. Nature Genetics,2009,41(4):494-497.
[10]Tabuchi H,Zhang Y,Hattori S,et al. LAX PANICLE2 of rice encodes a novel nuclear protein and regulates the formation of axillary meristems[J]. The Plant Cell,2011,23(9):3276-3287.
[11]Zhang Z Y,Li J J,Yao G X,et al. Fine mapping and cloning of the grain number per-panicle gene (Gnp4) on chromosome 4 in rice (Oryza sativa L.)[J]. Agricultural Sciences in China,2011,10(12):1825-1833.
[12]Jiao Y,Wang Y,Xue D,et al. Regulation of OsSPL14 by OsmiR156 defines ideal plant architecture in rice[J]. Nature Genetics,2010,42(6):541-544.
[13]Ye H,Feng J H,Zhang L H,et al. Map-based cloning of seed dormancy1-2 identified a gibberellin synthesis gene regulating the development of endosperm-imposed dormancy in rice[J]. Plant Physiology,2015,169(3):2152-2165.
[14]Jin J,Huang W,Gao J P,et al. Genetic control of rice plant architecture under domestication[J]. Nature Genetics,2008,40(11):1365-1369.
[15]Li S,Qian Q,Fu Z,et al. Short panicle1 encodes a putative PTR family transporter and determines rice panicle size[J]. The Plant Journal:for Cell and Molecular Biology,2009,58(4):592-605.
[16]Léran S,Varala K,Boyer J C,et al. A unified nomenclature of NITRATE TRANSPORTER 1/PEPTIDE TRANSPORTER family members in plants[J]. Trends in Plant Science,2014,19(1):5-9.
[17]Dellaporta S L,Wood J,Hicks J B. A plant DNA minipreparation:Version Ⅱ[J]. Plant Molecular Biology Reporter,1983,1(4):19-21.
[18]Xue W Y,Xing Y Z,Weng X Y,et al. Natural variation in Ghd7 is an important regulator of heading date and yield potential in rice[J]. Nature Genetics,2008,40(6):761-767.
[19]Tian F,Zhu Z F,Zhang B S,et al. Fine mapping of a quantitative trait locus for grain number per panicle from wild rice (Oryza rufipogon Griff.)[J]. TAG,2006,113(4):619-629.
[20]Xing Y Z,Tang W J,Xue W Y,et al. Fine mapping of a major quantitative trait loci,qSSP7,controlling the number of spikelets per panicle as a single Mendelian factor in rice[J]. Theoretical and Applied Genetics,2008,116(6):789-796.
[21]Wang S S,Chen R K,Chen K Y,et al. Genetic mapping of the qSBN7 locus,a QTL controlling secondary branch number per panicle in rice[J]. Breeding Science,2017,67(4):340-347.
