虾脊兰原球茎诱导及植株高效再生体系研究
2019-10-25陈锦杨侃侃官迪
陈锦 杨侃侃 官迪


摘要:以野生虾脊兰(Calanthe discolor)未成熟蒴果為材料,MS为基本培养基,探讨不同光照度、热激和不同培养基配方对虾脊兰种子萌发、原球茎发生及植株再生的影响。结果表明,未完全成熟的种子在1/2MS+1.0 mg/L 6-BA+0.1 mg/L NAA+7 g/L琼脂+30 g/L蔗糖+20 g/L马铃薯+1.0 g/L活性炭培养基中萌芽率最佳;在1 500 lx光照度条件下培养时种子萌发速率较快。通过黑暗条件下35 ℃热激5 d有利于已萌动种子脱分化形成原球茎。使用MS+3.0 mg/L 6-BA+0.5 mg/L NAA+7 g/L琼脂+30 g/L蔗糖培养基诱导原球茎形成胚性愈伤组织效果最好。MS+0.5 mg/L 6-BA+0.5 mg/L NAA+7 g/L琼脂+30 g/L蔗糖+20 g/L马铃薯培养基分化形成植株分化率最高,1/2MS+0.2 mg/L IBA+7 g/L琼脂+30 g/L蔗糖+0.1 g/L活性炭培养基则为最佳生根培养基,生根率100%,植株根系发达,长势健壮。该研究建立了虾脊兰无菌快繁体系,为保护野生虾脊兰资源和种苗人工繁育提供了有效技术途径,也为其遗传转化研究奠定基础。
关键词:虾脊兰;蒴果;原球茎;组织培养;植株再生
中图分类号: Q813.1+2;S682.310.4+3 文献标志码: A 文章编号:1002-1302(2019)13-0045-04
虾脊兰[1](Calanthe discolor L.)为兰科虾脊兰属多年生草本植物,全属约150种,我国有51种,大部分为地生种,少数为附生种植物,其中包括21个特有种,在《中国极濒危植物名录》中已全部被列为濒危或已濒临灭绝等级。野生虾脊兰主要分布在长江以南流域,生于山坡林下[2-3],是一种价值极高的观花观叶植物,也可作为良好的盆栽、地被材料[4]。同时,野生虾脊兰也具有一定的药用价值,现有研究发现[5-6],虾脊兰提取物中含有二氢菲、吲哚苷以及一些具有生理活性的生物碱,使得其在传统中药中具有抗菌、消炎和抗毒素等功效。李丹平等经调查发现,虾脊兰的假茎、假鳞茎及根茎具有活血消结、解毒消肿、止痛等作用[7]。目前,对该物种的报道多限于一些基本生物学特征[8-9]、果实发育[10]、胚珠发育及种子形成[11]、遗传多样性[12~14]和天然产物开发[15-16]等方面,徐刚等通过显微镜测定虾脊兰属9种类型的种子发现,其授粉后1个月形成种胚,5个月后种子才能完全成熟,且与其他难于无菌播种发芽的兰科植物如扇脉杓兰(Cypripedium japonicum)、大花杓兰(C. macranthum)的种子一样,胚占种子比例非常小,种胚可见胚皮[17]。为保护这种花药两用的珍稀植物,人工繁育研究工作已迫在眉睫。虾脊兰种子极小且发育不完全,在自然条件下萌发率极低,通常难以存活[18-19],而它的园艺观赏性和药用价值巨大,多年来一直遭到人们过度采挖,导致野生虾脊兰资源逐年减少,甚至多个野生资源分布区已经难觅踪迹。现在虾脊兰属全属均被列为濒危或已濒临灭绝等级植物,为保护和开发虾脊兰的种质资源并进行合理的运用,如何快速繁育出大量幼苗成为人们必须思考的问题。笔者所在的课题组于2015年10月在湘西壶瓶山区(110°15′E、30°02′N)进行湖南省作物资源普查时偶然发现1株带有1颗蒴果的野生虾脊兰,为了保护野生资源,笔者所在的调查小组决定留下植株只取下未完全成熟的青色蒴果带回实验室。
本研究以野生虾脊兰未完全成熟蒴果为材料,探讨不同培养基组分及环境条件刺激对虾脊兰原球茎形成的影响,并通过不同培养方式可使原球茎脱分化成为胚性愈伤组织或再分化形成再生植株,随后诱导生根成苗。本试验旨在研究促使虾脊兰种子形成原球茎的发生条件及培养基配方,探索一种适合未完全成熟虾脊兰种子进行组培快繁的技术体系,通过该方案可快速大量生产虾脊兰幼苗。既为兰科植物原球茎发生条件探索和胚性愈伤组织诱导提供技术参考,也对该物种野生资源保护和扩繁提供技术支撑与借鉴。
1 材料与方法
1.1 材料
本研究以野生虾脊兰20周龄的未成熟蒴果为材料。
1.2 培养基成分与培养条件
1.2.1 材料处理 取虾脊兰蒴果经自来水冲洗30 min;再用75% C2H5OH+0.1% Tween 20消毒90 s;然后在0.1% HgCl2+0.1% Tween 20溶液中浸泡8~10 min,并轻轻振荡;无菌水冲洗4~6次后在超净工作台上将种荚外表面水分风干,切开种荚,将种子均匀洒在萌发不同配方培养基上。
1.2.2 培养条件 培养室温度控制为(22±2) ℃,弱光照度为1 500 lx,强光照度为4 500 lx,光照培养时长为12 h/d。
1.2.3 种子萌发 种子萌发1号培养基为1/2MS+1.0 mg/L 6-BA+0.1 mg/L NAA+7 g/L琼脂+30 g/L蔗糖+20 g/L马铃薯+1.0 g/L 活性炭;种子萌发2号培养基为MS+1.0 mg/L 6-BA+0.1 mg/L NAA+7 g/L琼脂+30 g/L蔗糖+20 g/L马铃薯+1.0 g/L活性炭。种子接入培养基后先放入暗室培养1周待其适应培养基环境,再分别给予1 500、4 500 lx 2种不同光照度进行培养,观察不同光照度条件对种子萌发的影响。
1.2.4 原球茎发生 种子撒入培养基后开始进入吸胀吸水阶段,慢慢在培养基养分和植物激素作用下有活力的种子进入缓慢吸水阶段,酶促反应与呼吸作用增强,贮藏物质开始分解,胚细胞的吸水力提高,打破种皮束缚,种子由淡黄色渐渐转色成黄绿色并伴随着体积膨大。此时即可说明其已经开始萌芽,将已萌动的种子转入黑暗条件下35 ℃热激培养5 d,方法参照文献[20],而后继续放入1 500 lx弱光下常温培养,观察种子发芽效率和原球茎发生情况。
1.2.5 原球茎脱分化 将虾脊兰原球茎转接至3号培养基(MS+1.0 mg/L 6-BA+0.5 mg/L NAA+7 g/L琼脂+30 g/L蔗糖)、4号培养基(MS+2.0 mg/L 6-BA+0.5 mg/L NAA+7 g/L琼脂+30 g/L蔗糖)、5号培养基(MS+3.0 mg/L 6-BA+0.5 mg/L NAA+7 g/L琼脂+30 g/L蔗糖)中,观察不同6-BA浓度对原球茎诱导形成愈伤组织的效果和不定芽发生情况。
1.2.6 胚性愈伤组织与原球茎分化出芽 将带有不定芽的愈伤组织和原球茎分别转接至6号固体培养基(MS+0.5 mg/L 6-BA+0.5 mg/L NAA+7 g/L琼 脂+30 g/L蔗糖+20 g/L马铃薯)、7号固体培养基(MS+0.5 mg/L 6-BA+0.5 mg/L NAA+7 g/L琼脂+30 g/L蔗 糖+20 g/L椰子汁)、8号固体培养基(MS+0.5 mg/L 6-BA+0.5 mg/L NAA+5 g/L琼脂+30 g/L蔗糖+20 g/L香蕉)上进行分化培养,观察不同添加物对愈伤组织和原球茎分化形成再生苗及其生长发育的影响。
1.2.7 生根培养 将无根的再生植株转接至不同浓度NAA和IBA的生根培养基进行生根培养,观察不同激素浓度对再生植株生根的影响。
2 结果与分析
2.1 不同培养基和光照度对种子萌发的影响
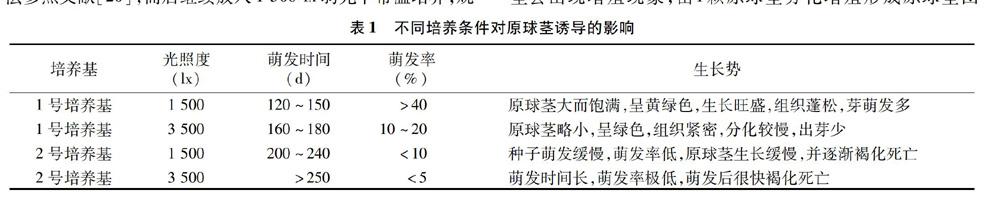
虾脊兰种子的萌发通常需要较长时间,不同培养基组分对种子萌发效率影响很大。从表1可见,低浓度盐分培养基和较弱光照条件下培养时最适合虾脊兰种子萌发,即使用1号培养基和1 500 lx光照度培养条件下种子的萌发效果较好。在培养120 d后该培养条件下的种子慢慢膨大,并渐渐露出黄绿色嫩芽,萌发率在40%以上。而高浓度盐分和强光照度培养条件都不利于虾脊兰种子快速和高效率萌芽,种子萌发率会显著降低,且萌发时间被延长。将已萌动种子放入35 ℃黑暗条件下热激培养5 d后转入常规培养条件,随后种子逐渐膨大发育成圆润饱满的黄绿色小球——原球茎(如图 1-A)。种子萌动后再经过热激处理均能诱导出原球茎,但不同培养基配方和光照培养条件对种子萌动效率和原球茎诱导品质影响较大,若原球茎诱导质量不高,在后期进行再分化出芽培养时,其容易出现生长缓慢甚至褐化死亡的现象。
2.2 不同培养基对原球茎脱分化和增殖的影响
将长势良好的原球茎转接至含有不同浓度6-BA的培养基中培养45 d后发现,当6-BA浓度为3.0 mg/L时,愈伤组织诱导效果最好(图1-B),愈伤组织结构紧密,生长速度较快,且分布多个不定芽,这有利于后期快速分化出芽,大量培育组培幼苗。当6-BA浓度为2.0 mg/L时,少量原球茎会出现增殖现象,由1颗原球茎分化增殖形成原球茎团(图1-C),同时产生大量次生代谢物使培养基褐化。
2.3 不同培养基对愈伤组织和原球茎分化出芽的影响
将愈伤组织和原球茎分别转接至含有不同天然成分的培养基中培养60 d后发现,几种不同培养基配方都能促使愈伤组织和原球茎分化出芽并形成再生植株(图1-D),但分化率和幼芽长势有一定的差异。其中,原球茎含有马铃薯和香蕉成分的培养基分化率均较高,且芽苗健壮,含椰子汁的培养基也有较高分化率,但幼苗生长较为缓慢且植株长势相对细弱。带有不定芽的愈伤组织在3种培养基中均能分化形成再生植株,且生长速率差别不大,平均株高低于2 cm,较原球茎诱导的再生植株更为缓慢(表2)。
2.4 生根培养
将分化出幼芽的虾脊兰植株转接至以1/2 MS+7 g/L琼脂+30 g/L蔗糖+0.1 g/L活性炭为基本成分,同时添加不同浓度NAA和IBA的培养基中进行45 d生根培养。表3显示,NAA和IBA 2种激素都能促使虾脊兰愈伤组织根分化,但根分化效率有较大差异。使用NAA生根培养基容易产生气生根,在NAA浓度为0.5 mg/L时,植株生长旺盛且根系发达,具有较好的生根效果;当使用浓度达到1 mg/L时,会诱导根系畸形发育,形成圆球状根,不利于养分吸收,从而导致植株生长缓慢。使用IBA生根效果更为理想,根系发达且白嫩、健壮,幼苗新叶数量更多,当IBA浓度为0.2 mg/L时,生根效果最佳。生根培养质量直接影响后期炼苗移栽成活率,较发达健壮的根系有利于移栽后植株快速生出新根汲取水分,减少组培瓶苗移栽后的脱水死亡率。
3 讨论与结论
曾有学者发现,使用超声波处理成熟的虾脊兰种子后,可大大提高其萌发率[21]。闵子扬等通过热激培养南瓜未授粉子房可促使其出胚,并得到再生单倍体植株[20]。有研究发现,在蝴蝶兰叶片外植体培养初期进行热激处理可诱导抗氧化酶活性显著提高,从而减轻培养过程中蝴蝶兰褐变的发生[22]。而王怀宇早在研究中指出,兰科植物因种类不同而萌发率差异巨大,还存在未成熟种子萌发率反而更高的现象[23]。故不能简单认为,种子的成熟度与其萌发率呈正相关性,当种子成熟到一定程度后,不会再随着成熟度增加而提高萌发率,甚至有可能会降低萌发率或延长萌发时间[24-25]。可见,通过不同物理刺激未成熟种子可能会改变其发育、分化过程,本研究受客观条件限制所取材料为未成熟蒴果,而此情况在珍贵野生资源调查和保护工作中时常遇见,只能使用未完全成熟的种子进行播种并诱导萌发,通过环境刺激诱导萌动种子分化形成原球茎。研究发现,使用低浓度盐分的培养基和较弱光照培养有利于虾脊兰种子萌发,当光照加强时,种子萌发率大大降低,甚至不萌发,可见是强光照不利于解除种子休眠。在乳白色种子解除休眠漸渐变绿后采用一定外界环境刺激,有利于促进不成熟种子继续分化发育,膨大形成胚性组织。若无热激刺激,而继续暗光培养时间过长易引起种子褐化死亡。光照程度对虾脊兰的分化、发育过程有明显影响,当萌芽和需要进行脱分化使之成为胚性组织时需要弱光甚至黑暗处理,弱光下有利于分化出蓬松的淡黄色愈伤组织,而当须要再分化出芽和植株生长时使用较强光照更加合适,强光照有利于诱导出更多丛生芽,植株长势也更加粗壮,根系发达。种子萌动过程中会出现部分褐化死亡的现象,可能是培养基和培养条件不适合虾脊兰萌发,亦或是种子成熟度不够造成萌动后的种子停止了进一步发育。虾脊兰种子萌动后肉眼可见其呈淡黄绿色,热激5 d后萌芽种子可发育成原球茎而不继续发生胚芽、胚轴和胚根。待原球茎长至肉眼清晰可辨约1 mm大小之后转入含有不同浓度6-BA的培养基中分化培养,在高浓度6-BA且暗室培养条件下原球茎会不断膨大形成淡黄色的瘤状胚性愈伤组织,这些愈伤组织膨大后进入强光培养可以分化出大量不定芽,将这些不定芽分割开来并进行分化培养,可形成大量幼苗,比直接通过原球茎分化出苗的增殖效率更高,可做到真正意义上的通过组织培养进行无限制培育组培幼苗。但当6-BA使用浓度较低时,原球茎不会被诱导形成愈伤组织而是直接发育形成单棵无根植株。
兰科植物在我国药用植物资源中占有重要地位,种类繁多且资源丰富[26-27],但近年来的环境破坏和无节制私挖乱采已造成多数药用兰科植物频临灭绝,由于野生资源逐渐枯竭,人们开始研究如何人工栽培和繁育。本研究为未成熟虾脊兰种子组培快繁和兰科植物原球茎诱导发生条件进行了一系列探索,为虾脊兰属植物保护工作提供借鉴和理论支持,也为日后虾脊兰种苗繁育工作排除技术障碍。
参考文献:
[1]黄卫昌,周翔宇,倪子轶,等. 基于标本和分布信息评估中国虾脊兰属植物的濒危状况[J]. 生物多样性,2015(4):493-498.
[2]林 兵,黄敏玲. 虾脊兰的栽培与利用(综述)[J]. 亚热带植物科学,2012,41(1):79-82.
[3]苏文君,龙波,刘飞虎. 虾脊兰属植物研究现状[J]. 北方园艺,2012(16):190-193.
[4]侯 鸣. 虾脊兰的观赏与栽培[J]. 中国花卉园艺,2008(10):27-29.
[5]关 璟,王春兰,肖培根,等. 地生型兰科药用植物化学成分及其药理作用研究[J]. 中国中药杂志,2005(14):1053-1061.
[6]伍小燕,田 辉,叶 晶,等. 壮药万筋藤的显微特征研究[J]. 广西医学,2010,32(9):1134-1135.
[7]李丹平,陈雨洁,万定荣,等. 鄂西土家族常用兰科植物药[J]. 中南民族大学学报(自然科学版),2009(1):48-50.
[8]王卜琼,李枝林,刘国民,等. 几种兰花种子无菌萌发及胚胎发育过程的几种途径[J]. 云南植物研究,2006,28(4):399-402.
[9]连静静,钱 鑫,王彩霞,等. 中国特有植物无距虾脊兰生物学特性及花部形态观察[J]. 植物资源与环境学报,2013(3):100-106.
[10]连静静,李全健,王彩霞,等. 无距虾脊兰果实发育及其解剖学特征[J]. 植物研究,2012(6):707-711.
[11]连静静,钱 鑫,王彩霞,等. 无距虾脊兰胚珠发育及种子形成研究[J]. 西北植物学报,2013,33(3):494-500.
[12]Sang H K,Lee J S,Lee G J. Analyses of genetic diversity and relationships in four Calanthe,taxa native to Korea using AFLP markers[J]. Horticulture,Environment,and Biotechnology,2013,54(2):148-155.
[13]黄宝华,钟凤林,刘添锋,等. 15份虾脊兰属植物的遗传多样性研究[J]. 西南大学学报(自然科学版),2011(12):72-76.
[14]朱根发,郭振飞. 重要观赏兰科植物的分子生物学研究进展[J]. 植物学通报,2004,21(4):471-477.
[15]Murakami T,Kishi A,Sakurama T,et al. Chemical constituents of two oriental orchids,calanthe discolor and C. liukiuensis:precursor indole glycoside of tryptanthrin and indirubin[J]. Heterocycles,2001,54(2):957-966.
[16]姜 祎,徐 虹,秦天福,等. GC-MS分析流苏虾脊兰叶中挥发性化学成分[J]. 现代中医药,2015(4):56-58.
[17]徐 刚,汪一婷,牟豪杰,等. 虾脊兰无菌播种技术[J]. 中国花卉园艺,2003(8):26-27.
[18]曾碧玉,朱根发,刘海涛,等. 4种野生兰花种子特征及离体培养初报[J]. 亚热带植物科学,2008,37(3):31-34.
[19]明兴加,张笑逸,伍淳操,等. 兰科植物种子的营养萌发[J]. 世界科学技术(中医药现代化),2012(5):2077-2081.
[20]闵子扬,李 涵,邹 甜,等. 南瓜未授粉子房离体培养及植株再生[J]. 植物学报,2016,51(1):74-80.
[21]Miyoshi K,Mii M. Ultrasonic treatment for enhancing seed germination of terrestrial orchid,Calanthe discolor,in asymbiotic culture[J]. Scientia Horticulturae,1988,35(1/2):127-130.
[22]赵 滢. 不同品种及热激处理对蝴蝶兰组培褐变的影响与生理机制[D]. 北京:中国农业科学院,2009.
[23]王怀宇. 兰的种子形成过程与发芽的关系[J]. 广东园林,1984(3):48-51.
[24]Kitsaki C K,Zygouraki S,Ziobora M,et al. In vitro germination,protocorm formation and plantlet development of mature versus immature seeds from several Ophrys species (Orchidaceae)[J]. Plant Cell Reports,2004,23(5):284-290.
[25]Udomdee W,Wen P J,Lee C Y,et al. Effect of sucrose concentration and seed maturity on in vitro germination of Dendrobium nobile hybrids[J]. Plant Growth Regulation,2014,72(3):249-255.
[26]张桂玲,冉 靓,罗绪强,等. 3种不同产地铁皮石斛与铁皮枫斗多糖、氨基酸及必需元素含量分析[J]. 江苏农业科学,2017,45(14):146-149.
[27]陈 芳,谷晓平,梁 平,等. 不同栽培方式下鐵皮石斛有效成分和光合特性的变化[J]. 江苏农业科学,2017,45(11):90-93.
