自载体的pH响应核-壳型紫杉醇-阿霉素纳米棒协同靶向治疗非小细胞肺癌
2019-10-17李亚楠董庆榕
李亚楠,董庆榕,张 辉*
(1山西医科大学第一医院放射科,太原 030001;2山西医科大学医学影像学院;*通讯作者,E-mail:zhanghui-mr@163.com)
癌症是严重危害人类健康的重大疾病之一,化疗是主要的治疗手段[1]。紫杉醇(PTX)和阿霉素(DOX)是两种重要且广泛使用的化疗药物,在多种肿瘤中表现出良好的抗癌活性,且具有不同的溶解性和作用机制。PTX疏水性强,在细胞有丝分裂周期的G2期与微管蛋白二聚体相互作用,促进微管聚合并抑制解聚,形成高度稳定的微管,从而阻止细胞分裂[2]。DOX亲水性强,通过插入作用与DNA结合,诱导一系列生物化学反应,最终导致肿瘤细胞凋亡[3]。由于肿瘤细胞耐药性的产生,单一PTX或DOX以分子态使用时往往不能完全缓解肿瘤,因此,近年来报道了多种纳米级药物释放系统用于增强这两种药物的活性并减少耐药,如脂质体[4]、胶束[5]、无机纳米颗粒[6]等。这些纳米体系在一定程度上改善了药物活性和耐药性,但仍存在着载药量低、载体导致的全身毒性、载体的合成和调节困难、性质差异较大的两种药物很难共负载在同一个纳米体系等问题,这些障碍严重限制了其在生物医学领域中的应用。
纳米材料的形貌、尺寸和表面化学性质对它的细胞内吞和细胞内迁移有重要影响。近年来,一维纳米结构在生物医学领域引起了广泛的研究兴趣,由于其具有独特优势,如更好的内吞效率[7]、更长的循环时间[8]、更高的载药量和更强的生物基底黏附性[9],以便提高治疗和成像效果。考虑以上因素,若能开发一种使用最少惰性材料来负载并功能化物化性质差异较大的两种药物,且达到最大疗效,是纳米载药体系发展的重要趋势,关于高载药量的刺激响应型自载体核-壳双药纳米棒给药系统,具有重大的应用潜力,但目前报道较少。
本研究中,我们采用溶剂交换法制备PTX纳米棒,化学偶联法制备具有pH响应基团的DOX前药,两种药物体系以体积比5 ∶1混合,依次经超声和搅拌处理后,制备出pH响应的核-壳型双药纳米棒复合体系。精确表征了该双药纳米棒的形貌、尺寸、两种药物的结合情况、在不同pH值缓冲液中的释放特性,实时追踪纳米双药的细胞内吞过程,测试其对非小细胞肺癌的协同靶向抑制效果,并评价功能化分子的生物相容性。研究表明,该协同体系制备简单、载药量高、稳定性好,具有较强的协同增强抗肿瘤活性,且方法普适。这一策略将为新型多药协同制剂的设计和制备提供有益的启示,并在肿瘤的精准诊疗中发挥潜在应用,现报道如下。
1 材料与方法
1.1 仪器
扫描电子显微镜(SEM,S-4300冷场发射,加速电压为5 kV,日本Hitachi公司),透射电子显微镜(TEM,HF5000,加速电压为200 kV,日本Hitachi公司),激光共聚焦显微镜(Leica SP8,德国徕卡公司),UV-vis分光光度计(Perkin-Elmer Lambda 750 UV/Vis/NIR,珀金埃尔默股份有限公司),酶标仪(SUNRISE,奥地利Tecan公司),Millipore Biocel Milli-Q system(美国密理博公司)。
1.2 主要试剂
PTX(纯度>99%)、DOX(纯度>98%)、PMHC18(马来酸酐-十八碳烯交替共聚物)、mPEG-NH2(5K)、EDC[1-(3-二甲氨基丙基)-3-乙基碳二亚胺]、MTT(噻唑蓝)购自Sigma-Aldrich试剂公司;DCJTB购自J&K科学有限公司;NHS(羟基琥珀酰亚胺)、DMSO(二甲基亚砜)、RPMI-1640细胞培养基、trypsin-EDTA胰酶细胞消化液(含0.25%胰酶和0.02%EDTA)购自Invitrogen试剂公司。
1.3 DOX-PEG-PMHC18的合成
将DOX的氨基与PMHC18-PEG的羧基偶联,合成了具有pH响应特性的酰胺键,并得到两亲性的DOX前药DOX-PEG-PMHC18。其中,PMHC18-PEG参照之前的文献报道来合成[10],简要步骤如下:10 mg PMHC18和143 mg mPEG-NH2(5K)溶解在5 ml含6 μl三乙胺和11 mg EDC的二氯甲烷中,搅拌条件下反应24 h,用氮气吹干二氯甲烷溶剂,所得固体溶解在水中形成透明溶液,用蒸馏水在截留分子量为14 kDa的透析袋中透析2 d,以去除未反应的mPEG-NH2、EDC和TEA,冻干后的白色固体-20 ℃保存待用。DOX与PMHC18-PEG之间的酰胺化过程与PMHC18-PEG的合成类似,冻干的粉红色固体产物-20 ℃保存备用。
1.4 PTX纳米棒的制备和表面功能化
采用溶剂交换法制备PTX纳米棒:首先将PTX在水浴超声条件下溶解于无水乙醇中,终浓度为3 mg/ml,用微量注射器从中取出100 μl溶液,室温下(25 ℃)注入5 ml快速搅拌的去离子水中(1 000 r/min),继续搅拌5 min后停止,将该反应体系收集在10 ml无色玻璃冻存瓶中,水浴超声后(选择高频档位)得到乳白色的PTX纳米棒悬浊液。将200 μl DOX-PEG-PMHC18水溶液(1 mg/ml)迅速加入1 ml PTX纳米棒悬浊液中,磁力搅拌0.5 h,获得稳定的核-壳型双药纳米棒。
1.5 PTX-DOX纳米棒的储存稳定性
将10 ml的PTX纳米棒、DOX-PEG-PMHC18和PTX-DOX双药纳米棒悬浊液分别密封在20 ml无色玻璃冻存瓶中,每种样品体系设置3个重复,室温下避光保存,同时开始计时,以保存当时为计时零点,随后分别在第0,1,2,4和6个月时用佳能数码相机对三组样品的外观形态进行拍照,并在拍照的同时,根据PTX在227 nm处的吸收强度与溶液浓度的定量拟合方程式,用UV-vis分光光度计对三组样品上清液中的PTX含量进行定量检测。
1.6 PTX-DOX纳米棒的pH响应体外释放特性
将90 μmol/L的PTX-DOX纳米棒分散在不同pH值的缓冲液中(0.01 mol/L的PBS缓冲液pH=7.4,0.01 mol/L的醋酸缓冲液pH=5.0),转移到截留分子量为3 500的透析管中,透析管浸入到150 ml的各自缓冲液中,37 ℃下摇动,在预设时间点,取出5 ml透析液并补充等量的缓冲液。根据DOX最大吸收峰(505 nm)处吸收强度与浓度的对应关系绘制标准曲线,并根据标准曲线计算各个时间点的DOX释放量和累积释放率,根据3次重复实验的平均值绘制累积释放率随时间变化的函数曲线。
1.7 细胞培养
人非小细胞肺癌细胞株(A549细胞)购自美国模式培养物集存库(ATCC),贴壁培养在含10% FBS和1%青链霉素的RPMI-1640培养基中,在37 ℃含5% CO2的培养箱中孵育,细胞用胰蛋白酶(0.05%)/EDTA消化处理并传代培养。
1.8 PTX-DOX纳米棒被肿瘤细胞内吞的过程观察
将A549细胞(5×104个细胞/孔)接种于24孔板,37 ℃,5% CO2的细胞培养箱环境中培养24 h,加入DCJTB掺杂(制备PTX纳米棒时,在3 mg/ml的PTX乙醇溶液中溶解少量DCJTB,即得到稳定掺杂DCJTB的PTX纳米棒)的PTX-DOX纳米棒(PTX=5 μmol/L),并开始计时,继续培养到设定的观测时间点(10 min、30 min、1 h、2 h、4 h),弃培养基,PBS洗3次,用4%的多聚甲醛固定细胞,激光共聚焦显微镜观察纳米棒被细胞内吞的过程,激发光为514 nm,发射光为550~650 nm,不含纳米棒的加样组作为空白对照。
1.9 PTX-DOX纳米棒的抗肿瘤活性检测
将A549细胞(1×104个细胞/孔)接种于96孔板,37 ℃,5% CO2的细胞培养箱环境中培养24 h,显微镜下观察细胞生长和贴壁状态,弃培养基,并加入含不同浓度的4种药物的新培养基,4组药物分别:PTX,DOX,DOX+PTX混合物,PTX-DOX双药纳米棒,药物浓度为0.001,0.01,0.1,1,10 μmol/L,将加完药物的96孔板再放入培养箱中培养48 h,随后拿出培养板,弃培养基,用150 μl PBS缓冲液洗涤3次,采用MTT法测试各组药物对肿瘤细胞的抑制作用,并用GraphPad Prism 7绘制细胞相对存活百分比随药物浓度的变化曲线,进行曲线拟合并确定最大半数抑制浓度(IC50)值,每组设3个复孔,每个结果重复3次。
2 结果
2.1 PTX-DOX纳米棒的组装及抗肿瘤过程
如图1所示,药物组装和内吞过程主要包括4个关键步骤:①不同于传统的载体基药物体系,本研究将疏水性药物PTX溶解在良溶剂中,加水制备均匀的纯药纳米棒;②亲水性药物DOX偶联表面活性剂制备的两亲性前药加入到PTX纳米棒的水悬浊液体系中对其进行表面功能化,得到共负载双药的纳米棒PTX-DOX;③功能化的PTX-DOX纳米棒通过能量介导的内吞作用进入到肿瘤细胞中;④药物从纳米复合体系中释放并表现出协同增强的抗肿瘤活性,其中PTX与微管结合,通过稳定微管将细胞有丝分裂抑制在G2/M期,从而诱导信号通路导致细胞凋亡;DOX作为一种DNA插入剂来抑制DNA和RNA的生物合成[11]。这一巧妙的设计策略大大提高了载药量,降低了载体的毒性和代谢负担,最终提高肿瘤的治疗效果。

图1 自载体PTX-DOX双药纳米棒的组装、细胞内吞及抗肿瘤过程示意图Figure 1 Schematic assembly, endocytosis and anti-tumor process of self-carrier PTX-DOX nanorods
2.2 PTX-DOX纳米棒的制备和表征
采用溶剂交换法制备PTX纳米棒,图2A中的SEM结果显示,该方法可大量制备具有均匀形貌和尺寸的纳米棒(长度500 nm,直径40 nm),DOX偶联表面活性剂后得到的两亲性前药对PTX纳米棒进行表面功能化修饰,用1H NMR和UV-vis分光光度计表征DOX前药,图2B中DOX-PEG-PMHC18在505 nm处的特征吸收峰表明了DOX与PMHC18-PEG的成功偶联。

A.SEM表征PTX纳米棒的形貌和尺寸 B.UV-vis吸收光谱表征DOX与PMHC18-PEG的成功偶联图2 PTX-DOX纳米棒的制备与表征Figure 2 The preparation and characterization of PTX-DOX nanorods
2.3 PTX-DOX纳米棒的储存稳定性
PTX-DOX纳米棒和PTX纳米棒分散在生理缓冲液中(PBS),室温保存6个月,分别在0,1,2,4,6个月时拍照记录两种悬浊液的外观形态,并用UV-vis分光光度计测量上清液中的PTX含量。图3为保存至第6个月时的结果,从图3A的数码照片结果可知,新制备的PTX和PTX-DOX纳米棒分别呈现均匀的乳白色和粉红色,但在PBS分散介质中,PTX纳米棒悬浊液逐渐析出白色沉淀,但PTX-DOX体系保存6个月时仍能保持均匀的粉红色。图3B为两种体系上清液中PTX的定量检测结果,由图可知,保存6个月时,PTX纳米棒体系的上清液中几乎无PTX存在,但PTX-DOX体系的上清液中仍能检测到较高的PTX含量,与图3A结果一致,说明PTX-DOX纳米棒具有良好的体液储存稳定性。

A.PTX-DOX和PTX纳米棒在PBS缓冲液中储存6个月时的数码照片 B.PTX-DOX和PTX纳米棒在PBS缓冲液中储存6个月时上清液的UV-vis吸收光谱图3 PTX-DOX纳米棒的储存稳定性Figure 3 The storage stability of PTX-DOX nanorods
2.4 PTX-DOX纳米棒的pH响应药物释放特性
在37 ℃的PBS缓冲液(pH=7.4)和醋酸缓冲液(pH=5.0,模拟肿瘤间质和细胞内小体的酸性环境)中,透析PTX-DOX纳米棒悬浊液250 h,并在各个预设时间点检测透析液中DOX的释放量,由图4可知,纳米棒在PBS缓冲液中孵育250 h时,30%的DOX被释放,而在醋酸缓冲液中大于75%的DOX被释放,说明PTX-DOX纳米棒具有明显的pH响应药物释放特性,可以被肿瘤酸性环境调节来释放药物。
2.5 PTX-DOX纳米棒的细胞内吞过程
用DCJTB掺杂的PTX-DOX纳米棒孵育A549细胞,CLSM检测孵育到不同时间点的细胞内红色荧光强度,由图5可知,纳米棒可快速进入细胞,培养初期,细胞内几乎无荧光信号,随着时间延长逐渐出现红色荧光,且纳米棒孵育细胞2 h后,细胞内观察到高信噪比的强荧光且保持稳定。
2.6 PTX-DOX纳米棒的抗肿瘤活性
分别用PTX、DOX、PTX+DOX、PTX-DOX纳米棒4种药物体系作用于A549细胞48 h,如图6所示,与其他系统相比,PTX-DOX纳米棒具有更强的药效(IC50=0.003 μmol/L),PTX+DOX混合体系对肿瘤细胞的抑制效果优于单一药物(IC50=0.016 μmol/L),两种单药体系中,在相同给药浓度下,PTX对肿瘤细胞的杀伤效果优于DOX(IC50值分别为0.043和16 μmol/L),因此,4种给药体系对人非小细胞肺癌A549细胞的抗肿瘤活性顺序依次为:PTX-DOX纳米棒>PTX+DOX混合物>PTX>DOX。
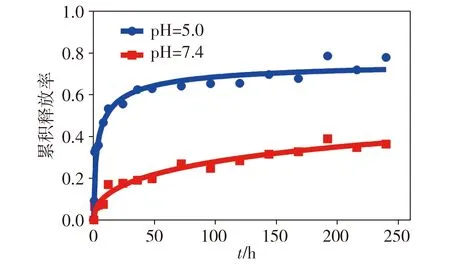
图4 不同pH值下PTX-DOX纳米棒中的DOX在不同时间点的累积释放率Figure 4 Time-dependent cumulative release ratio of DOX from PTX-DOX nanorods at different pH values

图5 PTX-DOX纳米棒孵育A549细胞的细胞内吞过程Figure 5 The endocytosis of PTX-DOX nanorods in A549 cells
3 讨论
针对化疗药物在肿瘤治疗中的重要作用[12],以及基于载体的单一药物纳米释放体系存在的载药量低、载体毒性、代谢负担、易产生耐药等问题[13],本研究将具有不同抗癌机制且可协同增强抗癌效果的两种化疗药物PTX和DOX共负载于同一个自载体的纳米棒复合结构中,形成核-壳型双药系统,该系统具有优良的体液储存稳定性,可响应肿瘤部位的酸性环境并被肿瘤细胞快速内吞,发挥协同增强的抗肿瘤活性,该制备策略可推广适用于多种双药体系。
采用溶剂交换法可大量制备长度500 nm、直径40 nm、形貌尺寸均匀的PTX纳米棒,两亲性的DOX前药DOX-PEG-PMHC18对其进行表面功能化修饰后得到稳定的核-壳型PTX-DOX纳米棒。该复合体系可在体液环境中长期稳定保存6个月以上,且DOX前药对PTX纳米棒的功能化修饰增加载药体系的体内循环时间,抵抗网状内皮系统的清除,未功能化的PTX纳米棒由于Ostwald熟化过程[14]很快析出白色沉淀,因此,纳米药物的表面功能化对增加其稳定性和药物活性非常必要。
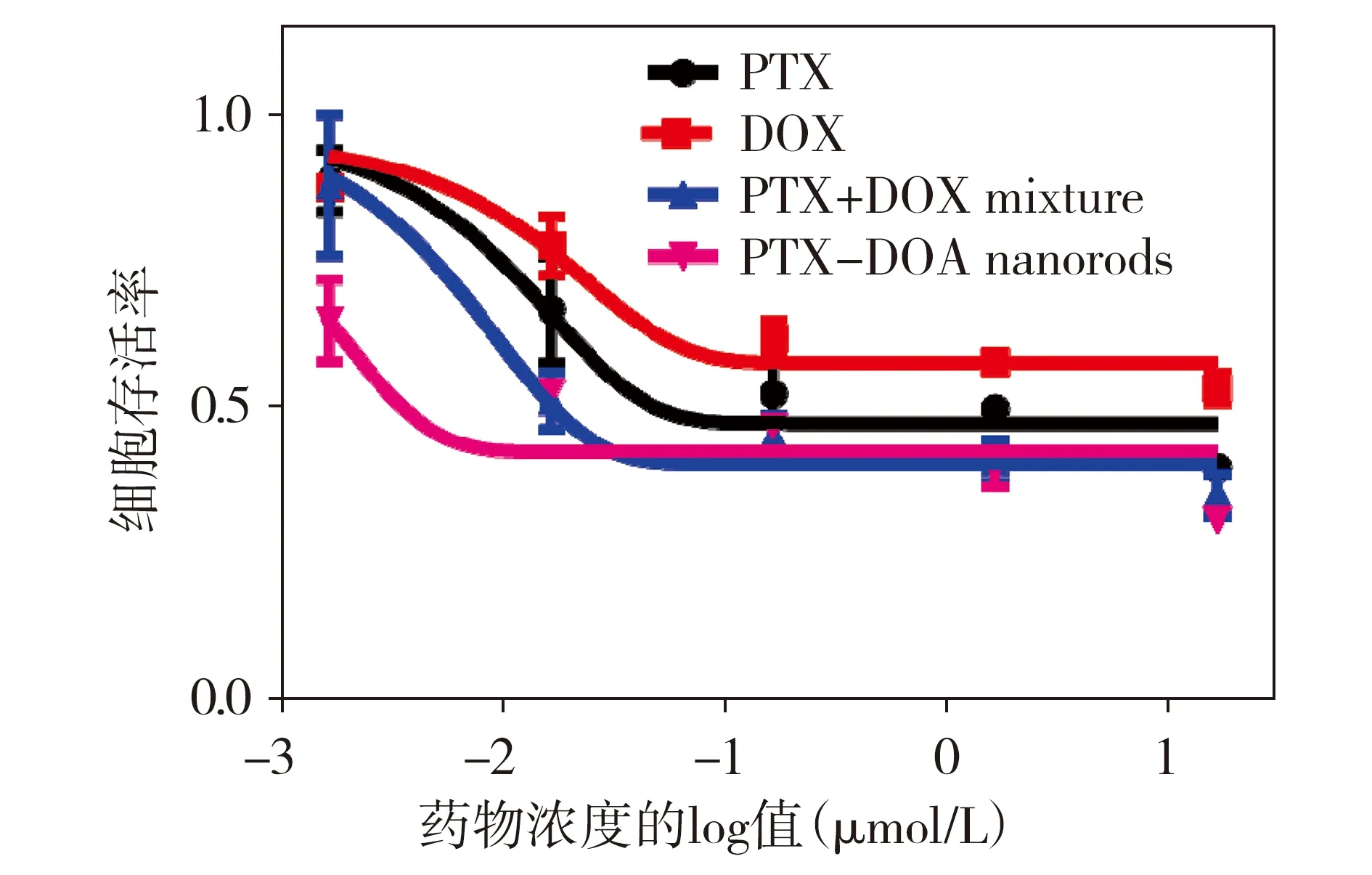
图6 四种药物体系对A549细胞的抑制作用 (37 ℃,48 h)Figure 6 Dose-effect profiles of four drug systems against A549 cell lines at 37 ℃ for 48 h
与正常组织相比,肿瘤微环境呈现酸性,已有报道显示,酰胺键在酸性环境下容易断裂[15],因此,通过形成酰胺键将DOX与两亲性的PEG分子偶联制备DOX前药,并对PTX纳米棒功能化后所得到的PTX-DOX双药纳米棒复合体系可响应肿瘤部位的低pH值而促进药物释放,在体外释放250 h时达到大于75%的释放量,在正常pH值的组织环境中仅释放30%,这将减少药物在循环过程中的过早释放,并增强肿瘤部位的药物富集和响应。
用一种高量子产率的红色荧光染料DCJTB[16]标记PTX-DOX纳米棒后,激光共聚焦荧光显微镜监测到该复合体系可被人非小细胞肺癌细胞快速内吞,2 h达到稳定状态。进入细胞后,该复合体系在更低的用药浓度下表现出协同增强的抗肿瘤活性,用PTX、DOX、PTX+DOX混合物、PTX-DOX纳米棒分别与A549细胞共孵育48 h,药物抑制肿瘤细胞的IC50值分别为0.043,16,0.016,0.003 μmol/L,由此可知,药物的抗肿瘤活性顺序为:PTX-DOX纳米棒>PTX+DOX混合物>PTX>DOX,PTX-DOX纳米棒的细胞毒性增强,主要解释为这种纳米双药可利用单一体系同时提供比例一致的联合药物有效载荷,从而使它们的组合效果最大化;而在简单的双药混合体系中,药物摄取的差异和细胞中药物的随机分布会影响药物的组合疗效;单一用药或分子态药物由于通过浓度依赖的扩散机制进入细胞,容易产生耐药而导致活性降低,这一结果凸显了纳米棒双药复合体系用于恶性肿瘤协同靶向治疗的优势和重要性。
4 小结
本研究以提高非小细胞肺癌的治疗效果并减小传统化疗药物的耐药性为出发点,将紫杉醇和阿霉素组合到一个纳米级药物释放系统中,成功制备出以PTX纳米棒为核,用两亲性的DOX前药对其表面功能化修饰后得到核-壳型的PTX-DOX纳米棒复合药物释放系统,该体系可在体液环境下长期稳定保存6个月以上,灵敏地响应肿瘤部位的酸环境,被肿瘤细胞快速内吞并有效释放,表现出协同增强的抗肿瘤活性,且对正常组织安全低毒。这种新型的组合策略和协同增效方法可广泛应用于其他多种药物体系和疾病类型,为癌症的早期诊断和高效治疗提供设计思路和技术指导。
