肾上腺髓质素在人骨肉瘤组织中的表达
2019-10-17杨康平尹战海杨益民张党锋周晓玲张匡华
戴 星,杨康平,尹战海,马 巍,杨益民,张党锋,周晓玲,张匡华,姚 璐
(1西安交通大学第一附属医院骨科,西安 710061;2西安交通大学医学部基础医学院生理学与病理生理学系;*通讯作者,E-mail:lyao1117@xjtu.edu.cn)
1993年Kitamura等[1]从人嗜铬细胞瘤细胞中分离出来一种含有52个氨基酸的蛋白,这种蛋白具有强大而持久的血管舒张效应,因其在人的肾上腺髓质中分布最广、含量最高而被命名为肾上腺髓质素(adrenomedullin,ADM)。随着进一步深入的研究,人们发现ADM有强烈的促进血管生成[2]和促进肿瘤生长作用[3],多种肿瘤组织中ADM的mRNA过度表达,进一步的研究更证明了ADM可以剂量依赖性地刺激培养的鼠血管平滑肌细胞的增生[4]。但之前关于ADM与肿瘤关系的研究多集中于消化系统肿瘤和部分腺癌(前列腺癌和乳腺癌等),鲜有关于骨肿瘤与ADM作用关系的研究。骨肉瘤作为骨肿瘤领域最常见的肿瘤类型,目前临床上多采用手术治疗、化疗和放疗等综合疗法,但骨肉瘤患者的生存率却没有得到本质的提高[5]。本研究通过免疫组化、RT-PCR和放射免疫等方法,检测ADM在骨肉瘤组织和正常组织之间的差异化表达,为骨肉瘤靶向治疗提供新的作用靶点,阻断或延缓骨肉瘤的生长和远处转移,这对于提高临床治疗效果,延长患者生命具有重要意义。
1 材料与方法
1.1 组织标本来源
骨肉瘤组织标本来自于西安交通大学第一附属医院2015-01~2018-12收治的20例骨肉瘤确诊患者,其中男性13例,女性7例,年龄16-63岁,平均年龄28岁。所入选的骨肉瘤患者均为初发病例,并且病人在采集标本前从未行先期的放化疗治疗。所有骨肉瘤组织都采集于原发病灶,经病理诊断确诊且病历资料完整,并排除转移性或合并其他运动系统肿瘤者。详细记录入选者的个人信息、诊断、疾病的分期及有无转移、肿瘤的特征等相关资料。手术中所取的瘤旁组织为远离瘤细胞的最远侵犯界限5 cm之外,且术后常规经病理验证无肿瘤细胞浸润。对照组人群来自于因外伤导致骨折而入院行内固定术的中青年患者,其中男性7例,女性3例,年龄22-45岁,平均年龄31.4岁,平素体健且经入院检查排除身体其他疾病。
血液标本分为3组采集:肿瘤术前组、肿瘤术后组和健康人组。其中肿瘤患者术前血液标本在入院时采集;肿瘤患者术后血液标本在手术后2周时采集。肿瘤患者排除标准:①对于入院前已经进行抗肿瘤的药物治疗;②因肿瘤复发而再次住院的骨肉瘤患者。健康组血液来自于经健康体检排除明显器质性疾病的人群。骨肉瘤组和健康对照组的年龄、性别均无明显差异,所有患者及参与本实验人员均告知相关事项并签订知情同意书,本研究经我院伦理委员会批准备案。
1.2 主要试剂

1.3 免疫组化法检测ADM在人骨肉瘤组织中的表达
将获得的肿瘤组织块制备石蜡块,以4 μm的厚度连续切片,所有的切片分为3组,分别用于HE染色、ADM和阴性对照免疫组化研究,以PBS液代替一抗作为空白对照组。按照组织来源的不同部位,实验分3个组进行:肿瘤组,瘤旁组织组和正常组织组,相同部位的切片重复2次。
1.3.1 实验步骤 将切片转入二甲苯溶液中浸泡脱蜡,浓度梯度酒精溶液浸泡去除二甲苯。切片行抗原修复后,滴加封闭液灭活内源性过氧化物酶。滴加一抗(1 ∶100稀释的ADM)工作液反应约1 h,然后转移到4 ℃冰箱内过夜。滴加50 μl生物素标记的二抗(1%BSA-PBS稀释),37 ℃孵育30 min,PBS冲洗3次。滴加50 μl辣根酶标记链霉卵白素(PBS稀释),37 ℃孵育30 min,PBS冲洗4次。加入DAB试剂盒中A、B和C液各1滴,室温下显色,纯水洗涤后终止反应。再次酒精梯度脱水,每级5 min,二甲苯透明,树胶封片。
1.3.2 免疫组化结果的判定 ADM阳性染色的主要表现是肿瘤细胞的细胞质中出现黄褐色或棕色的颗粒。采用图像分析系统软件Qwin(V2.3,Leica,Inc),对每张切片在200倍镜下选择5个视野的阳性细胞,分析其相对数量和染色强度。可分为四级:Ⅰ级,阴性,无阳性细胞或仅可见极少量阳性细胞;Ⅱ级,弱阳性,可见少量阳性细胞,数量少于10%;Ⅲ级,阳性,视野下可见较多阳性细胞,但数量不超过50%;Ⅳ级,强阳性,阳性细胞数量超过50%。
1.4 RT-PCR检测骨肉瘤组织中ADM mRNA
1.4.1 组织总RNA的提取 将新鲜组织标本以液氮速冻后磨碎,每100 mg组织加入1 ml Trizol试剂,将组织匀浆。按照1 ∶0.2的比例向Trizol中加氯仿,用力震荡后静置5 min。12 000 r/min离心15 min后将上层水相转入新的1.5 ml EP管中,加入异丙醇0.5 ml,混匀后放于-20 ℃中1 h后4 ℃ 12 000 r/min离心10 min。倾去上清,加1 ml DEPC,振荡洗涤后低温离心机7 500 r/min离心5 min。倾去上清,留取沉淀,将提取的RNA保存于-70 ℃冰箱中。

表1 RT-PCR引物序列
Table 1 Primer sequences for RT-PCR

基因上游引物 下游引物 扩增片段ADM5′-TGCCCAGACCCTTATTCGG-3′5′-AGTTGTTCATGCTCTGGCGG-3′115 bpGAPDH5′-CAAATTCCATGGCACCGTC-3′5′-CCCATCTGATTTTGGAGGGA-3′101 bp
反转录反应条件如下:37 ℃ 15 min(反转录反应),85 ℃ 5 s,合成的cDNA于-20 ℃保存。RT的反应产物为总RNA相对应的cDNA,以合成好的cDNA为模板,PCR反应扩增ADM基因。依次加入下列试剂,建立如下的反应体系:2×Master Mix 12.5 μl,ADM cDNA 2 μl,上游引物(50 mmol/L)0.5 μl,下游引物(50 mmol/L)0.5 μl,最后加入ddH2O 9.5 μl至总体积为25 μl。94 ℃预变性3 min后,94 ℃变性30 s,退火30 s,72 ℃延伸45 s,共35个循环,最后72 ℃延伸5 min。
1.4.3 琼脂糖凝胶电泳 2%琼脂糖凝胶50 ml充分混匀后室温冷却,加入10 mg/ml EB 4 μl,倒入准备好的胶槽内,向槽内加入1×TAE电泳缓冲液,再加入DNA marker 5 μl,依次加入样本5-10 μl至凝胶的加样孔中。接通电源,调节电压为10-12 V,电泳30-35 min,待指示剂迁移至足够距离后,关闭电源取出凝胶,置于凝胶成像系统中观察电泳结果。以DNA marker为对照,判断出现相应大小的目的条带是否为所需条带。采用凝胶图像分析系统,照相并对电泳条带进行密度扫描后分析,以各组产物的光密度值(OD)与GAPDH的OD值相比计算目的基因的相对表达量。
1.5 放射免疫法检测血浆中ADM含量
1.5.1 血浆样本处理 血液标本共采集50例,其中肿瘤术前组20例,肿瘤术后组20例,健康人组10例。血液标本采用如下的方法处理:采集静脉血2 ml,拔下针头后,沿管壁慢慢注入含10% EDTA 30 μl的试管中,上下颠倒两次,混匀。室温放置约1 h后,3 000 r/min离心10 min,分离血浆后待测。如不立即测量,可将样本密封后,置于2-8 ℃(保存不应超过12 h)或-20 ℃(保存不超过2个月)储存备测。冰冻样品测定前,使样本置于室温或常温水中复融,测定前将样品充分摇匀。
1.5.2 测定步骤 按人肾上腺髓质素放射免疫分析试剂盒说明操作,将盒内各冻干品成分加样配制为溶液,摇匀,4-8 ℃温育18-24 h。最后加入驴抗兔免疫分离剂,充分摇匀后室温放置15 min,3 500 r/min离心15 min,弃上清,使用γ射线计数仪测各沉淀管中抗原-抗体标记复合物的放射性计数。
1.5.3 数据处理 联机电脑软件可处理出结果,其计算原理如下。
百分结合率计算:设S0管计数为B0,各标准管或样品管计数为B,非特异管计数为NSB,则百分结合率计算公式为:B/B0=(B-NSB)/(B0-NSB)×100%。
logit计算:各标准点或样品管的logit值计算公式为:logit=ln(B/B0)/(1-B/B0)。
普通坐标图上以标准浓度取log值为横坐标,对应的logit值为纵坐标;或以标准浓度为横坐标,对应的B/B0为纵坐标在logit-log坐标图上制出标准曲线。根据待测样品的B/B0可以从坐标图上查出样品的浓度值。
1.6 统计学处理

2 结果
2.1 病例资料的整理
病人的真实资料隐去,以病例号代替,病人性别、年龄、骨肉瘤的外科学分期、有无远处转移及放射免疫法测定的血浆ADM含量见表2。肿瘤大小根据MRI影像和病理标本大小,以病灶的最长径计算(单位:cm),骨肉瘤的外科学分期基于Enneking提出的肌肉骨骼系统的G-T-M分级系统[6](G:病理分度,T:骨肉瘤与解剖学间室的关系,M:有无远处转移),其中Ⅰ期代表低度恶性,Ⅱ期代表高度恶性,Ⅲ期代表有区域性和转移性肿瘤组织,再根据解剖间室分为间室内A和间室外B。20例骨肉瘤患者,男性13例,女性7例。按外科学分期,ⅡA级7例(其中男性4例,女性3例),ⅡB级6例(其中男性4例,女性2例),ⅢA级4例(其中男性3例,女性1例),ⅢB级3例(其中男性2例,女性1例)。
表2 骨肉瘤患者病例资料及术前、术后ADM值变化
Table 2 Information of patients with osteosarcoma and changes of ADM before and after operation

病例号性别年龄(岁)分期远处转移肿瘤直径(cm)ADM(pg/ml)术前术后1男54ⅢB多发9.948.619.82男20ⅡA无 7.235.812.53男28ⅡA无 5.633.714.34女24ⅡB无 5.942.215.45男31ⅡB无 8.441.516.66男24ⅢA肺 10.544.319.47女32ⅡA无 6.233.414.88男19ⅡB无 7.337.618.99女26ⅡB无 6.636.816.110男34ⅡB无 6.939.518.211男23ⅡA无 5.734.815.912女63ⅢA肺 9.146.318.713男17ⅢB多发9.747.319.814男22ⅢA肺 10.247.918.315男25ⅡB无 8.744.216.516女23ⅡA无 6.334.315.817男16ⅢA肺 9.242.316.418女21ⅢB多发9.549.318.119男31ⅡA无 8.041.716.520女27ⅡA无 5.842.315.4
2.2 血浆ADM含量
20例骨肉瘤患者术前血浆ADM含量(41.19±5.235 9)pg/ml,10例健康人血浆ADM含量为(12.46±1.148 1)pg/ml,具体见表3,两组间差异有统计学意义(t=17.006 3,P<0.05);同时20例骨肉瘤患者术前血浆ADM含量与术后血浆ADM含量[(16.87±1.972 5)pg/ml]相比明显降低,差异有统计学意义(t=19.438 8,P<0.05),提示随着肿瘤的切除ADM的表达量也随之降低。本实验同时发现Ⅱ期骨肉瘤组血浆ADM水平[(38.29±3.782 3)pg/ml]与Ⅲ期骨
肉瘤组[(46.57±2.494 5)pg/ml]相比较,两组间差异有统计学意义(t=5.183 2,P<0.05),说明存在远处转移的骨肉瘤患者血浆ADM表达水平高于那些没有远处转移的患者,提示ADM水平的高低与骨肉瘤的远处转移密切相关。
表3 健康人群血浆ADM含量
Table 3 Plasma ADM levels in healthy controls

编号性别年龄(岁)血浆ADM(pg/ml)1男2612.32女3311.63男2910.94男2712.85女2412.36男2211.87男2814.98男4512.69女4111.710男3913.7
2.3 ADM在骨肉瘤组织和瘤旁组织中的表达
免疫组化结果显示骨肉瘤组织中瘤细胞有明显的ADM标记,呈强阳性表达,主要定位于瘤细胞的外膜和细胞质中,出现粗大的棕黄色颗粒,遍布整个视野(见图1A);从肿瘤组织到瘤体边缘的过渡中,ADM蛋白的表达逐渐减弱;瘤旁组织ADM的阳性表达比骨肉瘤组织明显减弱,仅局部组织呈现轻微的淡染(见图1B)。
不同组织间的ADM表达强度见表4。
表4 不同组织中ADM的表达强度
Table 4 ADM expression intensity in different tissues

分类 强阳性阳性弱阳性阴性阳性率(%)骨肉瘤 1162195癌旁组织0251335正常组织011820

图1 ADM在不同组织中的表达Figure 1 ADM expression in different tissues
2.4 骨肉瘤组织中ADM mRNA的表达
人骨肉瘤组织呈ADM mRNA阳性表达,可见扩增片段长度115 bp(ADM)和101 bp(GAPDH)两条特异性条带。上述实验重复两次,均为阳性表达,结果一致(见图2A)。其中在20例标本中,骨肉瘤组织中均检出ADM mRNA阳性表达;瘤旁组织中ADM mRNA阳性表达12例,8例微量表达;正常组织中ADM mRNA均呈微量表达。各组ADM mRNA半定量结果见图2B,其中标本1号是正常组织,ADM mRNA半定量值为0.21;标本2-3号是瘤旁组织,ADM mRNA半定量值分别为0.55和0.62;标本4-6号是骨肉瘤组织,ADM mRNA半定量值分别为1.71,1.86和1.78。骨肉瘤组织中的ADM mRNA表达量明显高于瘤旁组织,两组间差异有统计学意义(t=43.122 2,P<0.05)。
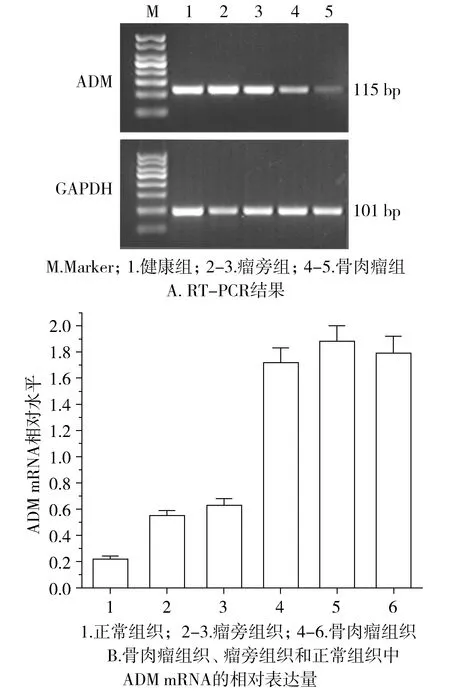
图2 不同组织中ADM mRNA的表达Figure 2 ADM mRNA expression in different tissues
3 讨论
肾上腺髓质素(ADM)是一种人体自身产生的血管活性物质,由52个氨基酸组成,属于降钙素基因相关肽(calcitonin gene-related peptide,CGRP)家族成员[7]。ADM作为一种活性肽,具有强大而持续的降血压作用;它可以促进小鼠成纤维细胞的增殖并表现为剂量依赖性;它还作用于降钙素受体样受体(calcitonin receptor-like receptor,CRLR)与特异性受体活性调节蛋白(receptor activity modifying protein,RAMP),产生环磷酸腺苷(cyclic adenosine monophosphate,cAMP),活化蛋白激酶A(protein kinase A,PKA),提高心肌细胞内钙,增加心肌收缩力。
进一步的深入研究发现ADM还具有强烈的促进血管生成和促进肿瘤生长作用。Haddad等[8]总结既往研究结果,提出ADM可能是多数人类恶性肿瘤的自分泌生长因子,在他们的研究中很多组织(乳腺、前列腺、肠道、脑和肺等)来源的肿瘤细胞系几乎都能分泌ADM。Zhang等[9]检测了卵巢恶性肿瘤患者和正常人群血浆中的ADM值,结果显示患者血浆中ADM明显升高。Li等[10]研究证明,卵巢上皮癌中的ADM表达与肿瘤的分期和预后相关,肿瘤的分期越晚则ADM的表达越强,手术治疗后血浆内ADM含量明显下降,但如果很快又升高常常提示预后不佳。Bozkurt等[11]进一步证明如果在组织中检测出ADM阳性表达越高,与之对应的术后病理检查的组织学分级中分化越低。同时进行微血管密度的检测,采用CD34作为标记物,发现微血管密度数值的变化总是伴随着ADM的表达而变化。Dong等[12]的研究证明ADM具有血管生成素的作用,可刺激小鸡尿囊绒膜新血管的生成,这与碱性成纤维细胞生长因子作用相似。这些提示ADM与肿瘤的生长密切相关,尤其是ADM在肿瘤侧枝循环和微血管建立中的重要作用,可能在某种程度上促进了恶性肿瘤细胞的快速生长,并导致肿瘤最终远处转移的机制之一。
上述关于ADM与肿瘤的相关研究多集中在上皮细胞来源的肿瘤或者腺癌(乳腺癌、前列腺癌、胰腺癌等),但对于像骨肉瘤这样来源间叶组织的实体性肿瘤,目前国内外较少关注ADM在人骨肉瘤组织的表达情况,对于ADM与骨肿瘤发生、发展之间的关系,更是尚不明确。本文通过对临床骨肉瘤标本的免疫组化染色发现,ADM在人骨肉瘤组织呈强阳性表达;从肿瘤组织到瘤体边缘的过渡中,ADM蛋白的表达逐渐减弱;瘤旁组织ADM的阳性表达比骨肉瘤组织明显减弱,仅局部组织呈现轻微的淡染。RT-PCR检测ADM mRNA的表达,得到了与免疫组化相似的结果,即ADM在肿瘤组织和其他组织中存在差异化表达。我们进一步检测了ADM在血浆的中含量,正常人的血浆也有ADM表达,但骨肉瘤患者血浆ADM含量远高于正常人群,且表现为分期晚且存在远处转移的患者血浆ADM表达水平远高于那些没有远处转移的患者。这些实验结果都提示ADM在人骨肉瘤组织呈阳性表达,从ADM的变化趋势上可以推断ADM与骨肉瘤的生长密切相关,ADM表达水平的高低可能与骨肉瘤的恶性程度和临床预后密切相关,这与之前ADM在其他腺癌上的观察结果相近[13]。
骨肉瘤的生长和进展都依赖于血管生成的过程,骨肉瘤从单个的瘤细胞生长到一定体积,仅仅依靠周围组织液的渗透来完成营养物质和代谢废物的交换远远不够,并且骨肉瘤生长迅速常常导致瘤体内部处于缺氧状态,因而必须建立起新的血液供应以满足骨肉瘤生长的需要[14]。ADM作为一个潜在的肿瘤血管生长因子[15],可以刺激骨肉瘤新生微血管的增生,缓解骨肉瘤内部的缺氧状态,ADM在骨肉瘤进一步演进过程中的作用值得我们更多的关注,通过讨论ADM在骨肉瘤发生发展中的作用,以期为骨肉瘤的诊断与治疗等提供一个新的分子生物学指标,而建立以ADM为核心的治疗方案很有可能成为治疗骨肉瘤的新途径。
