产细菌素乳酸菌的筛选及发酵条件优化
2019-10-15满丽莉向殿军
满丽莉,向殿军
(1.内蒙古民族大学生命科学学院,内蒙古通辽 028042;2.内蒙古民族大学农学院,内蒙古通辽 028042)
0 引 言
在《“十三五”国家食品安全规划》中强调食品安全的重要性[1]。添加食品防腐剂是防止食品腐败变质、确保食品安全及延长食品货架期的主要方法,因此,寻求天然、广谱、高效的食品防腐剂是目前食品科学研究中的热点问题。乳酸菌细菌素作为一种新型生物防腐剂备受关注,但目前商品化的乳酸菌细菌素仅限于pediocin PA-1和Nisin等少数几种,原因在于许多乳酸菌细菌素pH范围窄、热不稳定、抑菌谱窄或产量相对较低,在食品中的应用受限[2]。目前筛选到的产细菌素乳酸菌大多对革兰氏阳性菌具有较高的抑菌活性,而对于革兰氏阴性菌基本无抑菌活性或抑菌活性较弱,筛选对革兰氏阴性菌有抑菌活性的乳酸菌细菌素已成为研究热点之一[3-4]。产细菌素乳酸菌菌株的来源较为广泛如奶酪、酸乳、发酵牦牛乳、南非大麦啤酒、面糊、波斯鲟鱼、低盐发酵鱼等[5-7],我国是一个乳酸菌资源丰富的国家,内蒙古地区传统发酵乳制品中乳酸菌资源尤为丰富,进行乳酸菌细菌素的研究具有得天独厚的优势。产细菌素乳酸菌的筛选鉴定是深入研究细菌素特性、合成量、纯化、应用等的基础,有利于保障人民的身体健康,具有重要的经济价值和社会效益。
细菌素产量低是乳酸菌细菌素应用受限的主要原因之一,优化培养条件和培养基是提高细菌素合成量的有效策略之一,例如:采用该策略提高乳酸片球菌ITV26所产乳酸片球菌素和植物乳杆菌KC21所产植物乳杆菌素的合成量[8,9]。细菌素的微生物发酵过程较为复杂,理解和优化发酵过程是一个关键步骤,响应面法(Response surface methodology,RSM)在生物过程优化已得到广泛应用,通过响应面法建模可为细菌素发酵过程的分析、设计和操作提供有用的信息,获得细菌素的优化发酵条件[10]。
本研究以来自于内蒙古自治区后旗、扎旗、科尔沁右翼中旗、赤峰地区的酸马奶为供试样品,筛选对革兰氏阴性菌-鼠伤寒沙门氏菌ATCC14028具有抑菌活性的菌株,通过个体形态、菌落形态、16SrDNA基因同源性比对及系统进化树构建确定菌株属种,采用水解酶敏感性试验进一步确定筛选到的是产细菌素菌株。应用单因素试验和响应面法优化细菌素合成的发酵条件,为更好地实现细菌素的开发及应用提供一定的方法参考和理论依据。
1 材料与方法
1.1 材料
1.1.1 供试样品及模式菌株
供试样品为来自于内蒙古自治区后旗、扎旗、科尔沁右翼中旗、赤峰地区的酸马奶。指示菌菌株:鼠伤寒沙门氏菌ATCC14028购自广东环凯微生物科技有限公司。
1.1.2 试剂、培养基及主要仪器设备
1.1.2.1 试剂
过氧化氢酶购自美国Sigma公司;细菌基因组提取试剂盒购自北京天根生化科技有限公司;M 17培养基和营养肉汤培养基购自青岛高科园海博生物技术有限公司;Marker、Taq聚合酶等购自宝生物工程(上海)有限公司;其它药品均为国产分析纯。
1.1.2.2 培养基
MRS培养基:蛋白胨5.0 g,牛肉膏5.0 g,胰蛋白胨10.0 g,酵母粉5.0 g,Tween-80 1.0 g,葡萄糖20.0 g,硫酸锰0.25 g,乙酸钠5.0 g,柠檬酸氢二氨2.0 g,硫酸镁0.58 g,K2HPO4·3H2O 2.0 g,蒸馏水1 L,固体培养基含琼脂2.0%,pH 5.8,121℃灭菌15 min。
1.1.3 主要仪器设备
MJ-54A/MJ-78A型STIK灭菌锅:北京天赐科仪商贸有限公司;Microfuge16型离心机:美国贝克曼公司;110-801型三量ip67防水原点数显卡尺不锈钢零点电子游标尺:东莞市景有模具五金有限公司;DHP-600恒温培养箱:常州中捷实验仪器制造有限公司;9700 PCR仪:美国Applied Biosystems公司;DYY-10C型电泳仪及DYCZ-28A型电泳槽:北京市六一仪器厂;1708195型凝胶成像系统:伯乐(Bio-Rad)公司。
1.2 方法
1.2.1 培养及优化前发酵方法
指示菌的培养方法:挑取鼠伤寒沙门氏菌ATCC14028接种于装有100 mL营养肉汤培养基的250 mL锥形瓶中,37℃培养至对数生长期(约107cfu/mL)。
乳酸菌的培养方法:挑取菌株接种于装有100 mL MRS培养基(pH 5.8)的250 mL锥形瓶中,37℃培养至对数生长期(约109cfu/mL),菌液备用。
优化前发酵方法:将乳酸菌菌液按1%接种于装有100 mL MRS培养基(p H 5.8)的250 mL锥形瓶中,37℃发酵24 h。
1.2.2 抑菌活性的测定
发酵上清液制备:发酵液经12 000×g,于4℃离心10 min,收集上清液,用1 mol/L NaOH调p H值至7.0,排除有机酸的干扰。加入过氧化氢酶(终浓度为5.0 mg/mL),37℃水浴2 h排除过氧化氢的干扰,上清液经0.22μm滤膜过滤后备用,取50μL上清液测定抑菌活性。抑菌活性采用双层平板打孔法检测[11],打孔直径为6 mm,抑菌圈直径采用电子游标卡尺测定。
1.2.3 产细菌素乳酸菌的筛选及鉴定
1.2.3.1 菌种的分离及筛选
将25 mL供试样品放入225 mL无菌生理盐水中,将菌液进行10倍的梯度稀释,取10-3、10-4、10-5分别吸取100μL菌液涂布于MRS和M 17平板上,37℃培养48 h~72 h,分离出革兰氏染色阳性、过氧化氢酶试验阴性的乳酸菌菌株,经反复纯化后保藏。挑取菌株按1.2.1方法培养发酵测定抑菌活性,抑菌圈直径最大的菌株用于进一步研究。
1.2.3.2 产细菌素乳酸菌菌株的鉴定
通过菌落形态、菌体形态、生理生化鉴定和16SrDNA基因序列测定完成菌株的鉴定。观察分离菌株在固体MRS培养基上的菌落形态、革兰氏染色后的菌体形态及生理生化鉴定结果,根据《常见细菌系统鉴定手册》及《伯杰氏细菌鉴定手册》(第八版)进行菌株的初步鉴定。
应用细菌基因组提取试剂盒进行菌体DNA的提取,通过PCR扩增16SrDNA基因序列进一步鉴定菌株。根据GenBank中已公布的植物乳杆菌的16SrDNA基因序列(序列号分别为KC429782.1、NR_115605.1、NR_113338.1、NR_104573.1、NR_042394.1)设计引物,上游引物为(MXG-68-F):5'-GACGAACGCTGSCGGCGTGCCTAAT-3',下游引物为(MXG-68-R):5'-GGTGATCCAAC CGCAGGTT CTCCTA-3'。PCR扩增产物通过1%琼脂糖凝胶电泳(100 V)检测,送上海生工生物工程技术有限公司进行序列测定。利用NCBI中的Blast(http://www.ncbi.nlm.nih.gov/BLAST),将所测定的序列与数据库中的序列进行比对,应用neighbour-joining method构建系统进化树。
1.2.3.3 菌株MXG-68产抑菌物质的水解酶敏感性试验
发酵上清液中分别加入胃蛋白酶、胰蛋白酶、糜蛋白酶、木瓜蛋白酶、蛋白酶κ、α-淀粉酶、脂肪酶,终浓度为1 mg/mL,37℃处理2 h,对照为37℃处理2 h的发酵上清液。抑菌活性按1.2.2方法测定。
1.2.4 细菌素发酵条件的单因素试验
1.2.4.1 温度的影响
将菌株MXG-68的菌液按1%接种于装有100 mL MRS培养基(pH 5.8)的250 mL锥形瓶中,分别于25、30、35、40、45℃培养24 h,抑菌活性按1.2.2方法测定[12]。
1.2.4.2 初始p H的影响
将菌株MXG-68的菌液按1%接种于装有100 mL初始pH分别为4、5、6、7、8的MRS培养基的250 mL锥形瓶中,37℃培养24 h,抑菌活性按1.2.2方法测定[13]。
1.2.4.3 抗坏血酸的影响
将菌株MXG-68的菌液按1%接种于装有100 mL分别添加1μg/mL、2μg/mL、3μg/mL、4μg/mL、5μg/mL抗坏血酸的MRS培养基(p H 5.8)的250 mL锥形瓶中,37℃培养24 h,抑菌活性按1.2.2方法测定[9]。
1.2.4.4 EDTA的影响
将菌株MXG-68的菌液按1%接种于装有100 mL分别添加3 mg/mL、4 mg/mL、5 mg/mL、6 mg/mL、7 mg/mL抗坏血酸的MRS培养基(p H 5.8)的250 mL锥形瓶中,37℃培养24 h,抑菌活性按1.2.2方法测定[14]。
1.2.5 响应面法优化细菌素发酵条件
应用Design-Expert软件中的Box-Benhnken设计构建模型,响应面法寻找细菌素最佳发酵条件。以温度(A)、初始pH(B)、抗坏血酸(C)、EDTA(D)四个因素为自变量,抑菌圈直径(mm)为响应值,运用四因素三水平的响应面分析试验,共29个试验点,其中24个为析因子,5个为中心试验。试验因素水平见表1。

表1 响应面因素水平
1.2.6 数据分析
抑菌圈直径的测定数据均重复三次,应用SPSS 17.0软件中的One-way analysisof variance(ANOVA)计算标准差。采用Design-Expert 8.0.6软件中Box-Benhnken设计进行响应面数据分析。
2 结果与分析
2.1 菌株的筛选与鉴定
2.1.1 菌株的分离及筛选
应用MRS和M 17平板从供试样品酸马奶中分离出86株革兰氏染色阳性、过氧化氢酶阴性的乳酸菌菌株,应用双层平板打孔法筛选出41株具有鼠伤寒沙门氏菌ATCC14028抑菌活性的菌株,其中菌株MXG-68抑菌活性显著高于其他菌株(P<0.01),抑菌圈直径达到14.63±0.19 mm(见图1),将菌株MXG-68应用于进一步的研究。
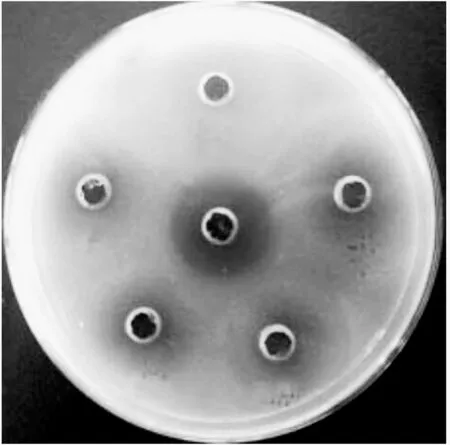
图1 乳酸菌发酵上清液对鼠伤寒沙门氏菌ATCC14028的抑菌圈
2.1.2 菌落形态、菌体形态及生理生化鉴定
由表2和表3中的结果显示,革兰氏染色阳性,短杆状,过氧化氢酶、硝酸盐还原试验、明胶液化试验、吲哚试验、H 2S试验阴性,无运动性,pH 4.5能生长,根据《伯杰氏细菌鉴定手册》(第八版)及《常见细菌系统鉴定手册》可确定菌株MXG-68属于乳杆菌属。依据糖发酵实验结果,可初步确定菌株MXG-68为植物乳杆菌。

表2 菌株MXG-68的菌落形态和菌体形态

表3 菌株MXG-68的生理生化特征
2.1.3 菌株MXG-68的16S rDNA基因序列分析
以菌株MXG-68的总基因组DNA为模板,应用引物MXG-68-F和MXG-68-R扩增16S rDNA基因片段,获得的序列片段长度为1 534 bp(见图2),其序列与GenBank中已公布的植物乳杆菌的16SrDNA基因序列同源性高达99%以上,进一步证明菌株MXG-68为植物乳杆菌,其16SrDNA基因序列已提交到GenBank,序列号为KY750314。
系统进化树结果显示菌株MXG-68与植物乳杆菌JCM 1149(NR_115605.1)、植物乳杆菌NBRC15891(NR_113338.1)、植物乳杆菌CIP103151(NR_104573.1)、植物乳杆菌NRRLB-14768(NR_042394.1)的16SrDNA基因序列同在一个进化分支上(见图3),菌株MXG-68与同一分支上基因序列同源性高达99.47%~99.93%,而与不同分支上基因序列的同源性相对较低,可进一步确定菌株MXG-68为植物乳杆菌。

图2 琼脂糖凝胶电泳鉴定菌株MXG-68的16SrDNA基因

图3 植物乳杆菌MXG-68的16SrDNA基因与同源序列构建的系统进化树
2.1.4 植物乳杆菌MXG-68所产抑菌物质的水解酶敏感试验结果
由表4可知,胃蛋白酶和胰蛋白酶导致抑菌活性完全丧失,糜蛋白酶、木瓜蛋白酶和蛋白酶K处理的发酵上清液抑菌活性显著降低(P<0.01),而α-淀粉酶和脂肪酶对抗菌活性基本无影响(P>0.05),结果表明植物乳杆菌MXG-68所产抑菌物质是一类蛋白类(多肽)物质。细菌素为一类由细菌核糖体合成的抗菌蛋白类物质,植物乳杆菌MXG-68所产抑菌物质在排除酸及过氧化氢的影响后,经多种水解酶处理证实其蛋白性质,由此可确定此抑菌物质是一种细菌素。
2.2 细菌素发酵条件的单因素试验结果
2.2.1 温度对细菌素合成的影响
由图4可知,温度为30℃时,抑菌活性最高,抑菌圈直径可达18.01±0.36 mm。与Ogunbanwo、Lim、陈芸芸等的研究结果一致,30℃有利于植物乳杆菌细菌素的合成。发酵温度过低会导致菌体生长缓慢和各种反应速率低,温度过高导致反应速率加快,菌体易衰老,发酵周期短,影响细菌素的最终产量。温度除了直接影响发酵过程中各种反应速率外,还影响基质和氧在发酵液的溶氧和传递速率及某些基质的分解吸收速度、生物合成方向等[9,15,16]。

表4 水解酶对抑菌活性的影响
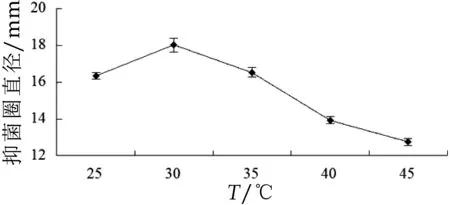
图4 温度对植物乳杆菌MXG-68产细菌素的影响
2.2.2 初始p H对细菌素合成的影响
由图5可知,初始pH为7.0时,抑菌活性最高,抑菌圈直径可达17.18±0.24 mm。p H值影响发酵液及代谢产物的物理化学性质,初始p H过低或过高均不利于菌体的生长及细菌素的合成,特别是细菌素的稳定性,H+或OH-可能会导致细菌素的结构和活力变化,因此,初始pH为近中性有利于细菌素的合成。

图5 初始pH对植物乳杆菌MXG-68产细菌素的影响
2.2.3 抗坏血酸对细菌素合成的影响
由图6可知,抗坏血酸的添加量为2μg/mL时,抑菌活性最高,抑菌圈直径可达18.76±0.19 mm。抗坏血酸浓度过高或过低不利于细菌素的合成量,可能是由于抗坏血酸作为一种还原性物质,会影响发酵液的氧化还原电势。与Lim的研究结果相一致,抗坏血酸可提高植物乳杆菌MXG-68和植物乳杆菌KC21的细菌素合成量[9]。
2.2.4 EDTA对细菌素合成的影响
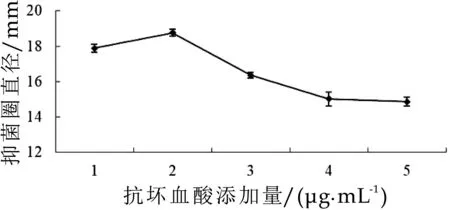
图6 抗坏血酸对植物乳杆菌MXG-68产细菌素的影响
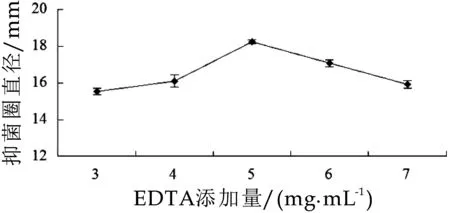
图7 EDTA对植物乳杆菌MXG-68产细菌素的影响
由图7可知,EDTA的添加量为5 mg/mL时,抑菌活性最高,抑菌圈直径可达18.23±0.11 mm。结果显示EDTA有利于增强植物乳杆菌MXG-68所产细菌素对鼠伤寒沙门氏菌ATCC14028的抑菌活性,与Gong、Castellano等的研究结果相一致。EDTA可通过释放脂多糖及螯合二价阳离子而穿透革兰氏阴性菌的外膜,有利于细菌素到达细胞膜,增强细菌素的抑菌活性[14,17]。
2.3 响应面法优化细菌素的发酵条件
2.3.1 模型建立及显著性分析
以抑菌圈直径为响应值,运用Box-Benhnken设计29组实验(见表5)。二次回归模型为:Y=-107.64300+2.49927×A+17.50433×B+4.07267×C+10.60667×D+5.50000×10-3×A×B-1.05471×10-16×A×C+5.00000×10-4×A×D-2.50000×10-3×B×C-2.20657×10-15×B×D-0.012500×C×D-0.042227×A2-1.27317×B2-1.04567×C2-1.04817×D2。Y为抑菌圈直径的预测值,A为温度的编码值,B为初始pH的编码值,C为抗坏血酸的编码值,D为EDTA的编码值。
由表6可知,该模型的P<0.01,表明试验所采取的二次模型极显著。失拟项的P=0.1040>0.05,模型失拟项不显著,决定系数R2=0.9997,表明模型与实际情况拟合度较高,所以可应用该模型对植物乳杆菌MXG-68的细菌素合成进行预测和分析。该模型中A、B、C、D、A2、B2、C2、D2的P<0.01,表明温度、初始p H、抗坏血酸、EDTA、温度的平方、初始p H的平方、抗坏血酸的平方、EDTA的平方对细菌素合成量的影响极显著。AB的P<0.05,表明温度和初始p H的交互作用对细菌素合成量的影响显著。交互项AC、AD、BC、BD、CD的P>0.05,说明这些交互作用对细菌素合成量无显著性影响。

表5 Box-Benhnken试验设计及结果
2.3.2 响应面分析
各因素的变化范围分别为温度(25~35℃),初始pH(6~8),抗坏血酸(1μg/mL~3μg/mL),EDTA(4~6 mg/mL)。在分别分析两个因素之间的交互作用时,其中一个因素固定,随着另一个因素浓度的增加,细菌素的合成量均呈现先增加后减少的趋势。优化发酵条件为温度30.08℃、初始pH 6.94、抗坏血酸1.91μg/mL、EDTA 5.06 mg/mL。预测的抑菌圈直径为21.36 mm(见图8)。

图8 优化发酵条件下的3D响应面图
2.3.3 回归模型的验证试验
为检验预测结果的可靠性,采用发酵条件进行验证试验。实际溶圈直径为21.42±0.16 mm,与预测的溶圈直径21.36 mm相比较差异不显著(P>0.05),表明该模型可靠性好。与优化前的溶圈直径14.63±0.19 mm相比较,溶圈直径提高了46.41%,可见该模型能较好地预测细菌素的合成情况。

表6 二次模型的方差分析
3 结 论
菌株16S rDNA基因具有高保守性,利用软件Primer5.0设计引物,通过PCR技术建立基于16SrDNA序列的生物分类方法,结合菌株的基础鉴定方法能够更准确地完成菌株的鉴定。本研究结合菌落形态、菌体形态、生理生化鉴定、16SrDNA基因同源性比对及系统进化树构建结果准确鉴定了菌株MXG-68为植物乳杆菌。细菌素是某些细菌在代谢过程中通过核糖体合成机制产生的一类具有生物活性的前体多肽、多肽或蛋白质[18-20],因此结合水解酶敏感性试验结果可进一步确定其为产细菌素菌株。
应用响应面法综合分析发酵条件对植物乳杆菌MXG-68合成细菌素的影响,优化发酵条件为温度30.08℃、初始p H 6.94、抗坏血酸1.91μg/mL、EDTA 5.06 mg/mL。优化发酵条件下抑菌圈直径可高达21.42 mm,与响应面预测值(21.36 mm)相比差异不显著,表明构建二次模型的科学性和准确性,有利于乳酸菌细菌素作为新型生物防腐剂的应用,为实现工业化生产奠定基础。
