白背飞虱海藻糖合成酶基因调控几丁质合成的功能
2019-10-12张道伟余亚娅潘碧莹康奎曾伯平陈静唐斌
张道伟,余亚娅,潘碧莹,康奎,曾伯平,陈静,唐斌,
白背飞虱海藻糖合成酶基因调控几丁质合成的功能
张道伟1,余亚娅2,潘碧莹3,康奎1,曾伯平1,陈静2,唐斌1,3
(1遵义师范学院生物与农业科技学院/赤水河流域动物资源保护与应用研究重点实验室,贵州遵义 563006;2遵义医科大学基础医学院,贵州遵义 563006;3杭州师范大学生命与环境科学学院,杭州 310036)
海藻糖合成酶(trehalose-6-phosphate synthase,TPS)在海藻糖合成中起着重要作用,其能够介导海藻糖代谢调控几丁质合成及昆虫发育。【】本研究通过抑制白背飞虱()的表达,检测RNAi沉默效果,观察白背飞虱蜕皮状况,测定几丁质含量及几丁质合成酶(chitin synthase,CHS)基因的定量表达,探究在白背飞虱几丁质合成中的潜在调控作用。利用注射法RNAi技术,以实验室饲养多年的白背飞虱种群为试验材料,体外合成两个(和)与的双链RNA(dsRNA)后,分别注射到白背飞虱体内抑制。首先,在dsRNA注射后48 h采用Trizol法提取白背飞虱的总RNA,反转录并合成第一链DNA后,采用实时荧光定量PCR(qRT-PCR)技术检测表达沉默情况,以确定RNAi的效果;其次,测定dsRNA注射后48 h和72 h白背飞虱整体几丁质含量并对翅发育畸形虫体进行拍照;最后,采用qRT-PCR技术检测白背飞虱在mRNA水平上的相对表达量变化,分析和在几丁质合成调控中的作用。与注射ds相比较,ds和ds的RNA注射后,能够促进表达量上升,几丁质含量增加,白背飞虱成虫翅出现畸形。qRT-PCR结果显示,单个dsRNA注射后本基因的表达能够被极显著抑制,与注射ds相比,不足对照组表达量的30%,且单个的dsRNA注射后,另外一个表达同样显著下降;ds和ds注射后,白背飞虱成虫翅均为长翅,出现一定比例的翅卷曲等畸形情况,其后48 h和72 h产生一定的死亡率;几丁质含量检测发现,和的dsRNA注射后72 h,几丁质含量显著上升。与注射ds对照组相比较,与表达量在ds注射后72 h极显著上升,在ds注射后48 h和72 h时极显著上升,且ds和ds注射后的表达极显著增加。能够通过调控白背飞虱几丁质合成酶基因的表达来控制几丁质的合成,研究结果有助于评价在白背飞虱等昆虫中的调控作用并作为潜在控害靶标,为进一步开展和筛选有效的海藻糖合成酶抑制剂控制白背飞虱等害虫提供理论依据。
白背飞虱;海藻糖合成酶;RNAi;几丁质合成;实时荧光定量PCR
0 引言
【研究意义】水稻()是我国最重要的粮食作物之一,保障水稻的高产、稳产在我国粮食安全生产中占有极其重要的地位。然而,水稻害虫种类较多[1],其中稻飞虱已成为水稻的头号害虫[2],其主要包括褐飞虱()、白背飞虱()和灰飞虱()3种。飞虱为单食性害虫,仅对水稻产生危害,其具有生命周期短、繁殖速度快、迁飞扩散能力和环境适应性强等特点[3-6]。目前,白背飞虱已成为我国以及亚洲部分国家水稻上的首要害虫,也是水稻中前期重要的迁飞性害虫之一,危害范围广,防治难度大[7]。探究白背飞虱海藻糖合成酶基因()对几丁质合成的影响,对筛选适合的害虫控制靶标防治白背飞虱具有重要意义。【前人研究进展】海藻糖作为一种双糖,不仅存在于植物、真菌和细菌中,在无脊椎动物中也分布较广,特别是在昆虫血淋巴中,海藻糖含量非常高,作为昆虫的“血糖”,在昆虫的生长发育、变态和繁殖等过程中均具有非常重要的功能[8-9]。海藻糖的合成途径不止一种,在昆虫中主要利用底物葡萄糖,通过海藻糖合成酶(trehalose-6-phosphate synthase,TPS)途径在脂肪体中合成[10-11],在能量需求时通过海藻糖酶(trehalase,TRE)降解为葡萄糖,从而进入能量代谢和几丁质合成通路中[12-14]。众所周知,几丁质和相应的蛋白质是昆虫外骨骼的主要组成部分,并且昆虫表皮、气管和围食膜等结构的主要成分也是几丁质,当幼虫生长到特定的阶段时都需要重塑几丁质结构,完成蜕皮行为,这个过程主要由几丁质合成通路和几丁质酶及其复合体共同完成[15]。几丁质合成通路中,总共包含8个不同的基因家族,海藻糖酶为昆虫几丁质合成通路的第一个酶,几丁质合成酶(chitin synthase,CHS)为几丁质合成的最后一个酶,也是最为重要的[13,15]。CHEN等研究表明,和的表达被抑制后,昆虫的几丁质合成均会受到严重的阻碍,导致其蜕皮困难,不能完成正常的生长发育而死亡[12,16-17]。【本研究切入点】在褐飞虱和德国小蠊()中克隆和发现了2个不同的家族基因[18-19],尤其在褐飞虱中存在着第3条[14,20-21]。采用RNAi技术抑制的表达,同样能够引起昆虫的蜕皮困难,并导致昆虫一定的死亡率[19,22],这表明在几丁质合成中起着一定的调控作用,但对其具体的调控作用以及不同之间是否存在差异的研究较少。在白背飞虱中同样发现存在2条不同的[23],该基因是否能够调控几丁质合成以及如何调控几丁质合成尚未明确,因此选择白背飞虱为研究对象探究的功能。【拟解决的关键问题】研究白背飞虱在其几丁质合成通路中的调控功能,评估昆虫海藻糖合成途径与几丁质合成途径的关联性,探索是否具备成为害虫防治的靶标基因的潜力,为开发白背飞虱等水稻害虫的生物农药提供理论依据。
1 材料与方法
试验于2018年在遵义师范学院和杭州师范大学完成。
1.1 供试虫源
白背飞虱来自遵义师范学院生物与农业科技学院饲养种群,水稻品种全部采用感虫水稻TN-1。白背飞虱基因功能试验从4龄开始统一收集,待其长至5龄若虫后,用于后期注射试验。
1.2 试验方法
1.2.1 总RNA的抽提及cDNA合成 白背飞虱的虫体总RNA抽提采用Trizol法,严格依据试剂盒说明书进行。提取后用1.2%的琼脂糖检测总RNA的质量,并用NanoDropTM2000分光光度计测定其纯度和浓度。cDNA合成依据PrimeScript®RT reagent Kit With gDNA Eraser试剂盒说明书进行。
1.2.2 dsRNA的合成 根据已知的白背飞虱核苷酸序列,选择2个合适的dsRNA特异性片段进行引物设计与合成。具体引物序列见表1,dsRNA的合成方法参考T7 RiboMAXTMExpress RNAi System试剂盒的说明进行。合成的dsRNA采用NanoDropTM2000测定浓度。同时以为模板,采用同样的方法合成的dsRNA,作为对照组[17]。最后,用于白背飞虱显微注射的dsRNA片段长度分别为ds(523 bp)、ds(509 bp)以及作为对照的ds(738 bp),其中、dsRNA设计区域比较见图1。
1.2.3 白背飞虱的显微注射、观察统计及材料选取 用于显微注射的材料分为ds、ds以及作为对照的ds。取5龄第1天的白背飞虱用于显微注射,显微注射仪参数调节为注射压强200 hPa,注射时间0.5 s,补偿压20 hPa,注射量为50 ng/头。注射后将飞虱放入含水稻的玻璃管中,用棉塞塞住管口,将玻璃管放入人工气候室,环境条件设置为温度(26±0.5)℃;光周期L﹕D=16 h﹕8 h,相对湿度(50±5)%。24 h后白背飞虱的存活数为有效注射数。注射后分成4批饲养,每批≥3个重复。第1批每隔24 h观察白背飞虱的发育情况,在48 h和72 h统计畸形数和死亡数;第2批注射后48 h和72 h分别取材,进行荧光定量(qRT-PCR)分析RNAi抑制效果及表达;第3批在注射后48 h 和72 h,用于测定几丁质含量;最后一批待其蜕皮为成虫后,观察畸形情况并进行拍照。
1.2.4 RNAi后抑制效果及表达量测定 白背飞虱显微注射后48 h和72 h取虫体材料用于qRT-PCR检测,引物见表2,试验方法参照张露等[24]。

表1 dsRNA合成引物序列
T7 sequence: GGATCCTAATACGACTCACTATAGG

图1 白背飞虱TPS1、TPS2核苷酸序列比对图

表2 实时荧光定量PCR检测引物序列
1.2.5 几丁质含量的测定 白背飞虱几丁质所占比例的检测方法参考文献[24-25]并做适当修改。主要步骤包括:(1)消化管:在一根长约30—50 cm的橡胶管两头接上两个玻璃管,再取一根试管配带孔橡胶塞,将橡胶管一端的玻璃管嵌入橡胶塞中,另一端则通入水中,预防碱液溅出;(2)样品量:将白背飞虱分为每组40头,平行3组,50℃烘箱内烘干至恒重;(3)将烘干的白背飞虱进行称重,记为W1;(4)把烘干后虫体倒入消化管中,加入5 mL饱和氢氧化钾溶液,160℃甘油浴,加热至虫体变透明薄膜;(5)用滤纸制成漏斗状过滤残渣,小心用水冲洗干净后置于50℃烘箱中烘干,称重并计为W2;(6)按照公式计算几丁质的相对含量。几丁质的相对含量(%)=(W2/W1)×1.26×100,其中1.26为乙酰氨基葡萄糖与氨基葡萄糖的相对分子质量之比。
1.2.6 数据统计与分析 通过qRT-PCR测定基因的CT值,每个生物学重复均设3个技术重复,3个技术重复的数值进行两两比较,数值相差在0.5以内可用,3个数值中有2个或3个接近,数值可用,否则重做。每次样品有3组生物学重复,即最后得到的数据为平均值±9个重复。再利用2-ΔΔCT法运算,以白背飞虱ds注射组的CT值为对照组。最后将换算出的值再进行具体分析。2-ΔΔCT计算公式[26]:
2-ΔΔCT=2-[(CT对照组-CT对照18s)- (CT待测组-CT待测组18s)]
应用Excel软件整理数据,并使用SPSS软件进行统计分析,One-Way ANOVA法进行差异显著性检验(<0.05为差异显著,用*表示;<0.01为差异极显著,用**表示),数据表示为平均值±标准误。处理后的数据采用SigmaPlot 10.0作图。
2 结果
2.1 RNAi后SfTPS表达及蜕皮情况
采用dsRNA注射到白背飞虱体内后,发现RNAi能够有效抑制表达。在ds和ds注射后48 h与72 h,和的表达分别极显著低于注射ds后的表达,表达量不足对照组的30%;注射ds或ds后,非靶标的表达同样极显著降低(图2-A、2-B)。ds和ds均能够引起白背飞虱蜕皮为成虫后翅畸形(图2-C),但是表皮蜕皮障碍不明显。
2.2 RNAi抑制SfTPS表达后几丁质含量的变化
与对照组相比,ds注射后48 h和72 h几丁质含量极显著上升,而ds注射后72 h几丁质的含量同样极显著上升(图3)。结果表明,表达下降反而促进了白背飞虱虫体中几丁质含量提高。
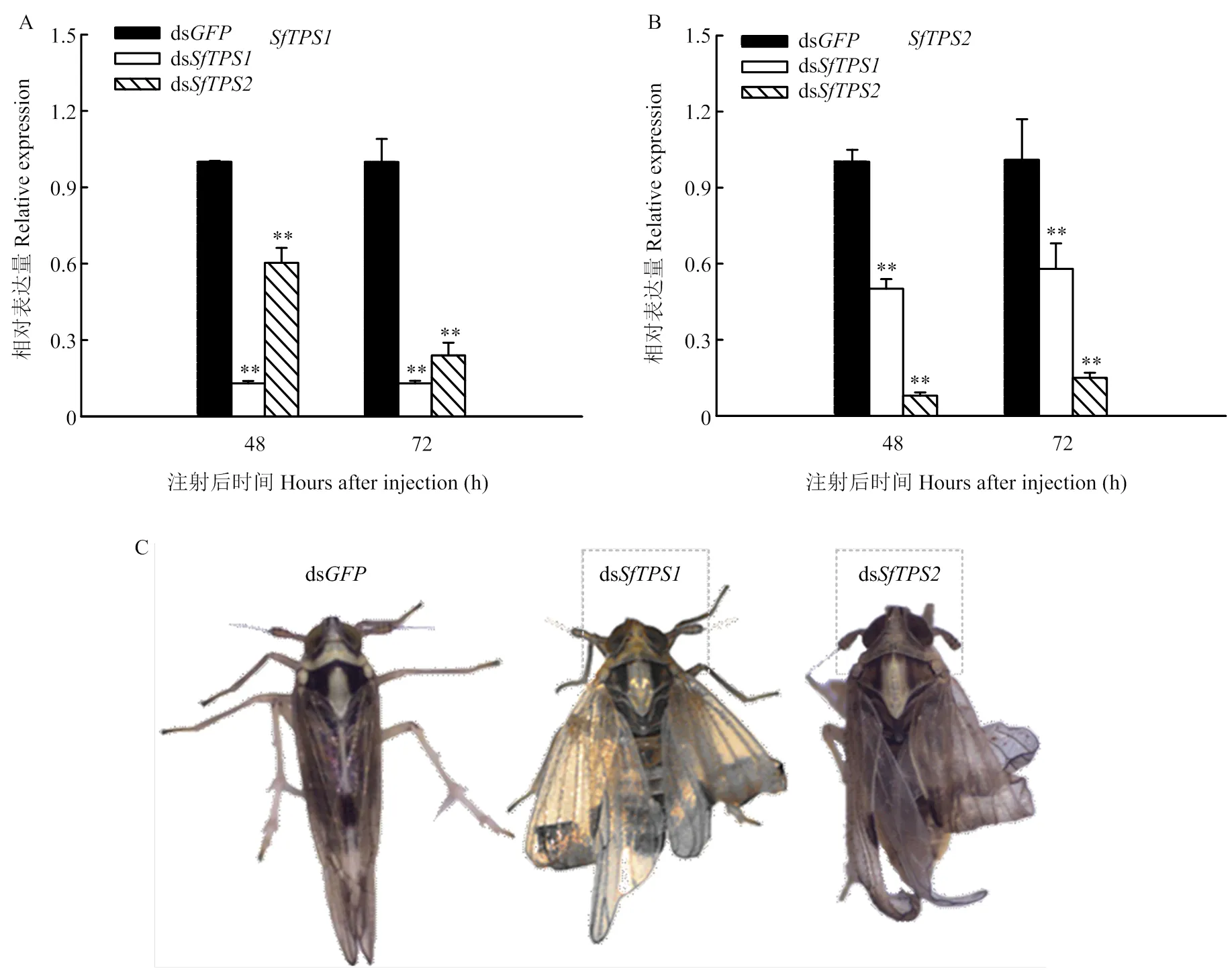
图2 RNAi后白背飞虱TPS的相对表达量及成虫蜕皮情况
2.3 SfTPS RNAi后SfCHS及可变转录子表达变化
飞虱中不存在家族基因,但存在两个不同的间接变异体[27]。采用RNAi抑制和表达后,在mRNA水平上检测几丁质合成酶及其两个不同转录子和的表达。结果显示与表达趋势一致,与对照注射ds组相比,注射ds后72 h表达量极显著上升,而在48 h时无显著差异;注射ds后48 h和72 h时表达量均极显著上升(图4-A、4-B)。此外,注射ds和ds后能够有效提高的表达,在和表达被抑制后的48 h和72 h的表达量均为极显著升高(图4-C)。
2.4 SfTPS RNAi后白背飞虱的畸形率和死亡率
为了解几丁质合成提高对畸形率和死亡率的影响,测定了和表达被抑制后48 h和72 h的畸形率和死亡率。结果表明,尽管ds和ds注射后48 h和72 h白背飞虱死亡率相对较低,72 h内死亡率未超过10%,但与注射ds组相比,均存在显著或极显著差异(图5-A);ds组处理后,白背飞虱无畸形情况出现,但和表达被抑制后48 h畸形率显著或极显著上升,且在72 h均极显著上升(图5-B)。
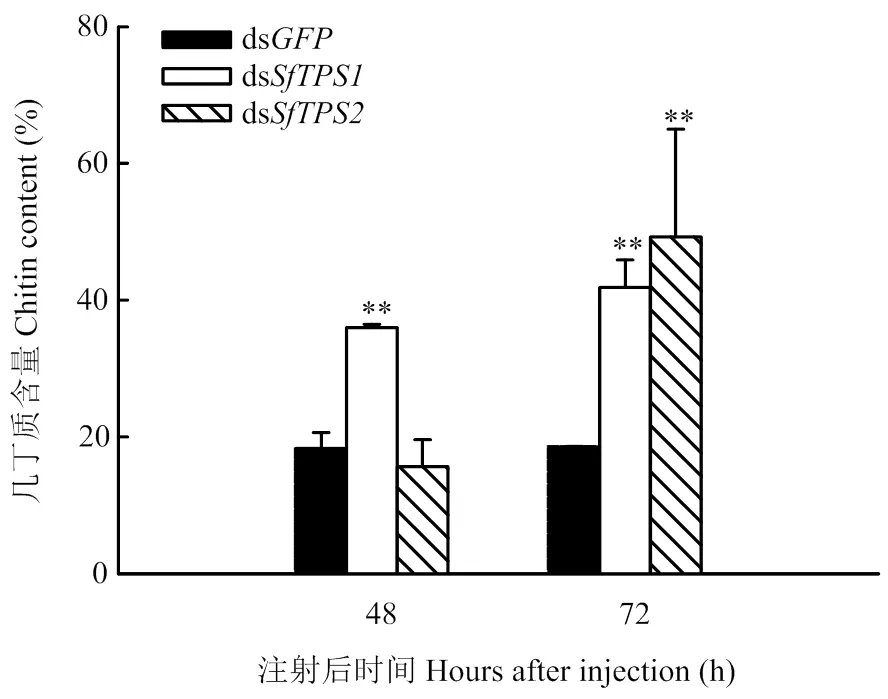
图3 RNAi后白背飞虱体内几丁质的含量变化

图4RNAi后及可变转录子的相对表达量
Fig. 4 The relative expression ofand variants transcripts afterRNAi
3 讨论
海藻糖在脂肪体中合成后,会被释放到血淋巴中,通过淋巴循环输送到各个组织中发挥功能[22,28]。AVONCE等研究表明,海藻糖具有5种不同的潜在合成途径,昆虫主要通过海藻糖合成酶(TPS)/海藻糖-6-磷酸脂酶(TPP)途径[29],也很有可能能够直接通过单一的来完成,TPS包含了TPS和TPP两个保守结构域,且不少物种未发现单独[14]。目前,在德国小蠊、褐飞虱和白背飞虱中发现2个或2个以上的[18-19],而在荒漠甲虫小胸鳖甲()的高通量测序中发现了5个潜在的Unigenes[30],这些结果表明昆虫的海藻糖合成途径一直在进化中,但是如何进化以及具体的进化方向却研究较少。基于海藻糖的重要功能,的研究也受到越来越多的关注,其功能研究的主要方法就是通过RNAi技术,采用注射dsRNA或siRNA抑制其基因的表达[31],探索其调控的潜在通路等。RNAi抑制通常具有沉默特定基因的功能,然而最新的研究发现当基因被敲低或敲除后,同家族基因会存在互补效应,即表达上升[32],这种现象在褐飞虱中同样存在[33]。然而,在褐飞虱体内单独干扰和,结果表明无论干扰还是,与的转录量均减少[19];本试验中,当注射ds或ds后,另外一个的表达同样受到抑制(图2-A、2-B),原因可能与相对保守程度较高有关,需要进一步研究确定。
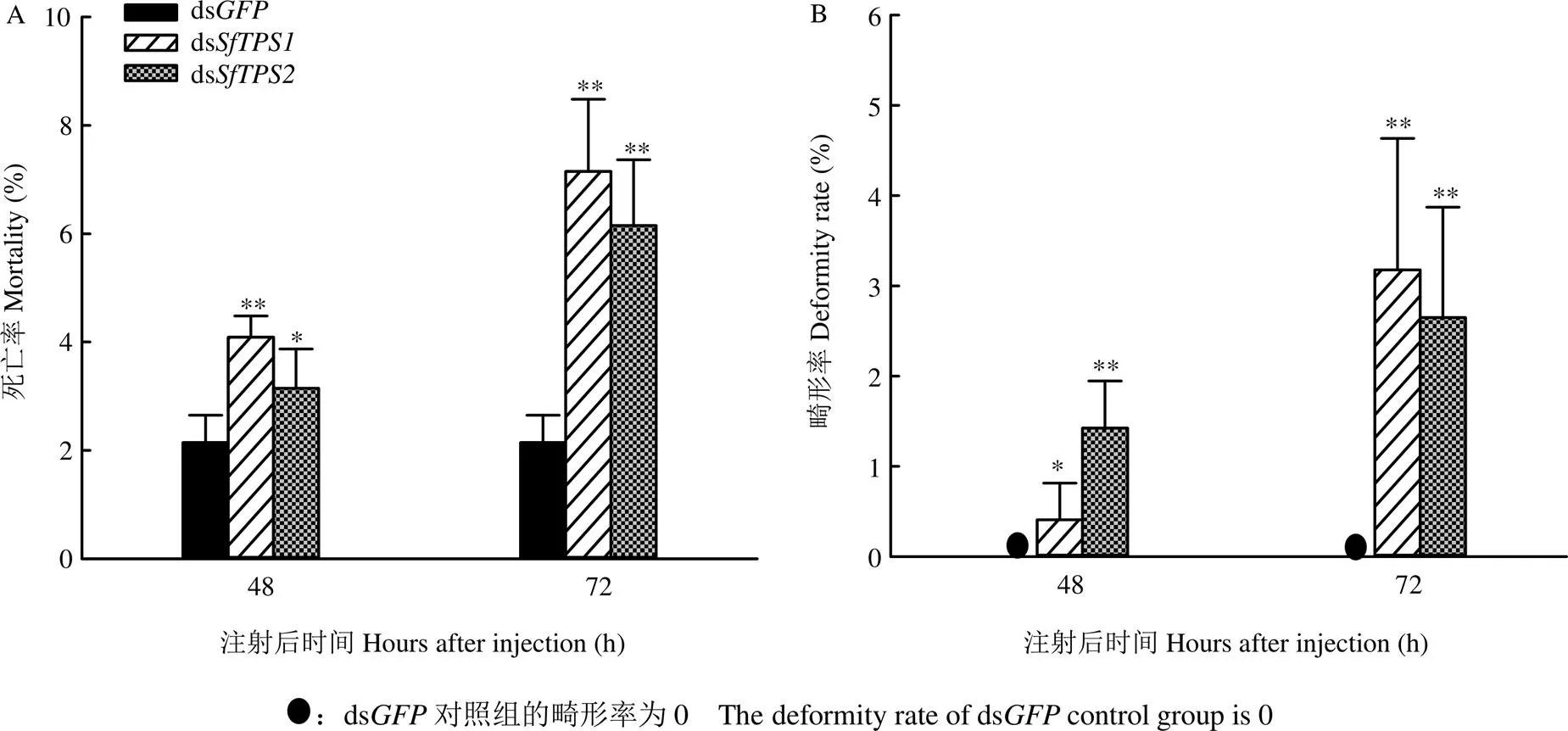
图5 SfTPS RNAi后白背飞虱的畸形率和死亡率
当沉默昆虫发育的关键基因后,通常会在不同的组织表型上显示出来[34-36]。如甜菜夜蛾()表达被抑制后48 h和204 h,其死亡率分别为50.94%和66.76%,显著低于ds对照组[22]。同样,褐飞虱和表达被抑制后,成虫出现蜕皮障碍,翅不能完全形成,畸形率达到20%,而死亡率接近30%[19];褐飞虱表达被抑制后,同样出现类似的蜕皮畸形现象[21];而在白背飞虱中,未发现蜕皮困难的畸形,仅发现翅能够生长完整,但存在一定的畸形(图2-C),72 h内死亡率也比畸形率要高(图5)。综合褐飞虱和白背飞虱的功能研究情况,表明部分飞虱在表达被抑制后,无明显的畸形便死亡,其原因可能是肠道围食膜或气管的几丁质合成受到影响[37],更为可能的是由于能量代谢被调控而引起死亡[11]。
几丁质合成的通路始于海藻糖酶,终于几丁质合成酶(CHS),几丁质合成和降解的动态平衡在昆虫蜕皮中起着尤为重要的作用[13,15]。抑制褐飞虱、和表达后发现,对和的干扰会导致褐飞虱翅畸形、细腰、表皮皱缩甚至死亡[27]。而当表达被抑制时,昆虫同样会出现发育畸形、体重减轻、几丁质合成减少、生长受阻、飞行减少甚至死亡的现象[10],特别是采用海藻糖酶抑制剂处理褐飞虱后,其几丁质含量显著下降[38]。这些研究表明,和等表达抑制后,会降低几丁质含量,而本试验中发现白背飞虱和表达被抑制后,几丁质含量基本是显著上升的(图3),飞虱成虫翅发育为长翅,无缩小畸形等,也间接表明几丁质含量较高(图2-C)。而在赤拟谷盗()中,表达抑制后,在72 h存在上升或显著上升,在48 h和72 h均显著下降,部分虫体不能正常化蛹,并且几丁质含量降低[39]。这是否说明和可能调控飞虱几丁质通路的结果或效果不同?能够抑制或提高几丁质酶(chitiase,Cht)的表达[25,33],打破合成的平衡,导致几丁质含量降低。而表达抑制后,能够促进的表达(图4),增加几丁质含量(图3),并且在时间节点上,干扰白背飞虱和后几丁质含量及、的变化趋势一致,而在时间节点的变化趋势有差异(图3、图4),这说明两个对几丁质代谢的影响机制不完全相同。同样部分昆虫中表达被抑制后也能够使几丁质的合成受到抑制[39],导致几丁质代谢平衡的紊乱。对褐飞虱和的功能研究发现,当和表达抑制后48 h,和表达降低或显著降低,而和在72 h却表达上升或显著上升[33]。为什么在飞虱和赤拟谷盗中存在不一样的情况,可能与飞虱的短翅和长翅型有一定的关联,图2-C中白背飞虱为长翅型,其几丁质含量在上升,而褐飞虱短翅型中几丁质合成明显受到阻碍[19]。综上所述,当抑制白背飞虱几丁质合成通路中或其他酶基因的表达,会导致几丁质含量降低从而导致蜕皮困难现象;而几丁质含量的上升也能导致昆虫翅发育畸形及死亡。
4 结论
海藻糖合成酶基因()作为海藻糖合成的关键基因,其能够介导几丁质合成酶基因()表达以调控几丁质合成,即当白背飞虱海藻糖合成途径中表达被抑制后,会通过促进的表达,提高几丁质含量,影响昆虫的生长及翅发育。
[1] BARRION A T, LITSINGER J A. Taxonomy of rice insect pests and their arthropod parasites and predators//Heinrichs E A.. Manila, Philippines: Wiley Eastern Ltd., India and IRRI, 1994: 13-362.
[2] 赵梦, 欧阳芳, 张永生, 李魏, 曹婧, 戈峰. 2000-2010年我国水稻病虫害发生与为害特征分析. 生物灾害科学, 2014, 37(4): 275-280.
ZHAO M, OUYANG F, ZHANG Y S, LI W, CAO J, GE F. Characteristics of occurrence and damage from diseases and insect pests in rice production in China during 2000-2010., 2014, 37(4): 275-280. (in Chinese)
[3] 赵颖, 黄凤宽, 童晓立, 庞雄飞. 水稻品种对褐飞虱不同生物型抗性的HPLC分析. 华南农业大学学报, 2005, 26(2): 52-55.
ZHAO Y, HUANG F K, TONG X L, PANG X F. HPLC analysis of rice variety resistance to different biotypes of., 2005, 26(2): 52-55. (in Chinese)
[4] WANG Y C, TANG M, HAO P Y, YANG Z F, ZHU L L, HE G C. Penetration into rice tissues by brown planthopper and fine structure of the salivary sheaths., 2008, 129(3): 295-307.
[5] XI Y, PAN P L, YE Y X, YU B, XU H J, ZHANG C X. Chitinase-like gene family in the brown planthopper,., 2015, 24(1): 29-40.
[6] XI Y, PAN P L, ZHANG C X. The-N-acetylhexosaminidase gene family in the brown planthopper,., 2015, 24(6): 601-610.
[7] GHAFFAR M B, PRITCHARD J, FORD-Lloyd B. Brown planthopper (Stål) feeding behavior on rice germplasm as an indicator of resistance., 2011, 6(7): e22137.
[8] 唐斌, 魏苹, 陈洁, 王世贵, 张文庆. 昆虫海藻糖酶的基因特性及功能研究进展. 昆虫学报, 2012, 55(11): 1315-1321.
TANG B, WEI P, CHEN J, WANG S G, ZHANG W Q. Progress in gene features and functions of insect trehalases., 2012, 55(11): 1315-1321. (in Chinese)
[9] 唐斌, 徐青叶, 赵丽娜, 王世贵, 张帆. 昆虫海藻糖及其合成酶基因的特性与功能研究进展. 应用昆虫学报, 2014, 51(6): 1397-1405.
TANG B, XU Q Y, ZHAO L N, WANG S G, ZHANG F. Progress in research on the characteristics and functions of trehalose and thegene in insects., 2014, 51(6): 1397-1405. (in Chinese)
[10] SHUKLA E, THORAT L J, NATH B B, GAIKWAD S M. Insect trehalase: physiological significance and potential applications., 2015, 25(4): 357-367.
[11] 唐斌, 张露, 熊旭萍, 汪慧娟, 王世贵. 海藻糖代谢及其调控昆虫几丁质合成研究进展. 中国农业科学, 2018, 51(4): 697-707.
TANG B, ZHANG L, XIONG X P, WANG H J, WANG S J. Advances in trehalose metabolism and its regulation of insect chitin synthesis., 2018, 51(4): 697-707. (in Chinese)
[12] CHEN J, TANG B, CHEN H, YAO Q, HUANG X, CHEN J, ZHANG D, ZHANG W Q. Different functions of the insect soluble and membrane-bound trehalase genes in chitin biosynthesis revealed by RNA interference., 2010, 5(4): e10133.
[13] 张文庆, 陈晓菲, 唐斌, 田宏刚, 陈洁, 姚琼. 昆虫几丁质合成及其调控研究前沿. 应用昆虫学报, 2011, 48(3): 475-479.
ZHANG W Q, CHEN X F, TANG B, TIAN H G, CHEN J, YAO Q. Insect chitin biosynthesis and its regulation., 2011, 48(3): 475-479. (in Chinese)
[14] TANG B, WANG S, WANG S G, WANG H J, ZHANG J Y, CUI S Y. Invertebrate trehalose-6-phosphate synthase gene: genetic architecture, biochemistry, physiological function, and potential applications., 2018, 9: 30.
[15] ZHU K Y, MERZENDORFER H, ZHANG W Q, ZHANG J Z, MUTHUKRISHNAN S. Biosynthesis, turnover, and functions of chitin in insects., 2016, 61: 177-196.
[16] CHEN X F, TIAN H G, ZOU L Z, TANG B, HU J, ZHANG W Q. Disruption oflarval development by silencing chitin synthase gene A with RNA interference., 2008, 98(6): 613-619.
[17] ZHAO L N, YANG M M, SHEN Q D, LIU X J, SHI Z K, WANG S G, TANG B. Functional characterization of three trehalase genes regulating the chitin metabolism pathway in rice brown planthopper using RNA interference., 2016, 6: 27841.
[18] 陈静, 张道伟. 德国小蠊两个海藻糖合成酶基因的克隆、组织分布及温度诱导表达分析. 昆虫学报, 2015, 58(10): 1046-1053.
CHEN J, ZHANG D W. Molecular cloning, tissue distribution and temperature-induced expression of two trehalose-6-phosphate synthase genes in(Blattodea: Blattellidae).,2015, 58(10): 1046-1053. (in Chinese)
[19] YANG M M, ZHAO L N, SHEN Q D, XIE G Q, WANG S G, TANG B. Knockdown of two trehalose-6-phosphate synthases severely affects chitin metabolism gene expression in the rice brown planthopper., 2017, 73(1): 206-216.
[20] 陈静. 褐飞虱遗传多样性及其海藻糖合成酶基因功能的分析[D]. 广州: 中山大学, 2010.
CHEN J. Genetic diversity and function analysis of agene of[D]. Guangzhou: Sun yat-sen University, 2010. (in Chinese)
[21] 唐斌, 沈祺达, 曾伯平, 肖仲久, 邱玲玉, 潘碧莹, 李昆, 张道伟. 褐飞虱一个新的海藻糖合成酶基因的特性、发育表达及RNAi效果分析. 中国农业科学, 2019, 52(3): 466-477.
TANG B, SHEN Q D, ZENG B P, XIAO Z J, QIU L Y, PAN B Y, LI K, ZHANG D W. Characteristics, developmental expression and RNAi effect analysis of a novel trehalose-6-phosphate synthase gene in., 2019, 52(3): 466-477. (in Chinese)
[22] TANG B, CHEN J, YAO Q, PAN Z Q, XU W H, WANG S G, ZHANG W Q. Characterization of a trehalose-6-phosphate synthase gene fromand its function identification through RNA interference., 2010, 56(7): 813-821.
[23] 张道伟, 陈静, 郭玉双. 白背飞虱海藻糖合成酶基因的克隆及序列分析. 黑龙江农业科学, 2012(5): 14-19.
ZHANG D W, CHEN J, GUO Y S. Cloning and sequence analysis ofgene from., 2012(5): 14-19. (in Chinese)
[24] 张露, 朱世城, 郑好, 沈祺达, 王世贵, 唐斌. 褐飞虱海藻糖酶基因在表皮几丁质代谢中的调控作用. 中国农业科学, 2017, 50(6): 1047-1056.
ZHANG L, ZHU S C, ZHENG H, SHEN Q D, WANG S G, TANG B. Regulatory function of trehalase genes on chitin metabolism in the cuticle of., 2017, 50(6): 1047-1056. (in Chinese)
[25] 曹传旺, 高彩球.昆虫生化与分子生物学实验技术.哈尔滨: 东北林业大学出版社, 2009: 24-26.
CAO C W, GAO C Q.. Harbin: Northeast Forestry University Press, 2009: 24-26. (in Chinese)
[26] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))method., 2001, 25(4): 402-408.
[27] WANG Y, FAN H W, HUANG H J, XUE J, WU W J, BAO Y Y, XU H J, ZHU Z R, CHENG J A, ZHANG C X. Chitin synthase 1 gene and its two alternative splicing variants from two sap-sucking insects,and(Hemiptera: Delphacidae)., 2012, 42(9): 637-646.
[28] THOMPSON S N. Trehalose - The insect ‘blood’ sugar., 2003, 31: 205-285.
[29] AVONCE N, MENDOZA-VARGAS A, MORETT E, ITURRIAGA G. Insights on the evolution of trehalose biosynthesis., 2006, 6: 109.
[30] LU X Y, LI J Q, YANG J H, LIU X N, MA J.transcriptome of the desert beetle(Coleoptera: Tenebrionidae) using illumine RNA-seq technology.,2014, 41(11): 7293-7303.
[31] FIRE A, XU S Q, MONTGOMERY M K, KOSTAS S A, DRIVER S E, MELLO C C. Potent and specific genetic interference by double-stranded RNA in., 1998,391: 806-811.
[32] MA Z, ZHU P, SHI H, GUO L, ZHANG Q, CHEN Y, CHEN S, ZHANG Z, PENG J, CHEN J. PTC-bearing mRNA elicits a genetic compensation response via Upf3a and COMPASS components., 2019, 568(7751): 259-263.
[33] ZHANG L, QIU L Y, YANG H L, WANG H J, ZHOU M, WANG S G, TANG B. Study on the effect of wing bud chitin metabolism and its developmental network genes in the brown planthopper,,by knockdownofgene., 2017, 8: 750.
[34] ZHU Q S, ARAKANE Y, BEEMAN R W, KRAMER K J, MUTHUKRISHNAN S. Functional specialization among insect chitinase family genes revealed by RNA interference., 2008,
[35] BELLES X. Beyond: RNAiand functional genomics in insects., 2010, 55: 111-128.
[36] SCOTT J G, MICHEL K, BARTHOLOMAY L C, SIEGFRIED B D, HUNTER W B, SMAGGHE G, ZHU K Y, DOUGLAS A E. Towards the elements of successful insect RNAi., 2013, 59(12): 1212-1221.
[37] CHEN X F, YANG X, KUMAR N S, TANG B, SUN X J, QIU X M, HU J, ZHANG W Q. The class A chitin synthase gene of: Molecular cloning and expression patterns., 2007, 37(5): 409-417.
[38] TANG B, YANG M M, SHEN Q D, XU Y X, WANG H J, WANG S G. Suppressing the activity of trehalase with validamycin disrupts the trehalose and chitin biosynthesis pathways in rice brown planthopper,., 2017, 137: 81-90.
[39] Chen Q W, Jin S, Zhang L, Shen Q D, Wei P, Wei Z M, Wang S G, Tang B. Regulatory functions of trehalose-6-phosphate synthase in the chitin biosynthesis pathway in(Coleoptera: Tenebrionidae) revealed by RNA interference., 2018, 108(3): 388-399.
Regulation function of trehalose-6-phosphate synthase genes on chitin synthesis in
ZHANG DaoWei1, YU YaYa2, PAN BiYing3, KANG Kui1, ZENG BoPing1, CHEN Jing2, TANG Bin1,3
(1College of Biology and Agriculture, Zunyi Normal University/Key Laboratory of Protection and Utilization of Animal Resource in Chishui River Basin, Zunyi 563006, Guizhou;2College of Basic Medical Science, Zunyi Medical University, Zunyi 563006, Guizhou;3College of Life and Environmental Science, Hangzhou Normal University, Hangzhou 310036)
【】It is well known that trehalose-6-phosphate synthase (TPS) plays an important role in trehalose synthesis, which can mediate trehalose metabolism to regulate chitin synthesis and insect development. 【】In this study, the effect of silencingwas detected, the molting status ofwas observed and the content of chitin and the quantitative expression of chitin synthase (CHS) gene were determined through inhibiting the expression ofby RNAi in. The purpose is to explore the potential regulatory effects ofon the chitin synthesis in.【】Thepopulation, which has been fed in laboratory for many years, was used as experimental material. The double-stranded RNA (dsRNA) ofandwere synthesizedin order to study the potential function of, the RNA of two ds(dsand ds) was injected into, respectively. Firstly, after dsRNA injection, the total RNA ofwas extracted by Trizol method at 48 h, and the first strand DNA was synthesized as the template of quantitative real-time PCR (qRT-PCR). As well as qRT-PCR was used to detect the silencing ofexpression for the effect of RNAi. Secondly, the whole chitin ofwas detected at 48 and 72 h after dsRNA injection, and photographs were taken of the winged developmental malformations. Finally, the relative expression level ofinwas detected by qRT-PCR, and the roles ofand2 in the regulation of chitin synthesis were analyzed.【】Compared with dsinjection, the expression ofincreased after dsand dsinjection, as well as the chitin content increased, which lead to the wing deformity of. The qRT-PCR results showed that the expression ofwas significantly inhibited after dsRNA injection of a single, which was less than 30% of that in the control group injected with ds. In addition, the expression of anotheralso decreased significantly after a singledsRNA injection. The adult wings ofwere all long wings after dsand ds2 injection. Some deformities such as wing curl in a certain ratio had been found in these long wings, and a certain ratio of mortality was found at 48 and 72 h. The chitin content increased significantly at 72 h after these two dsRNA injection. Compared with the control group, the expression ofandincreased significantly at 72 h after dsinjection, followed it increased significantly at 48 and 72 h after dsinjection. In the same time, the expression ofincreased significantly after dsand dsinjection.【】Thecan control the synthesis of chitin through the regulation of chitin synthase gene in. The results are helpful to evaluate the regulatory role ofinand other insects and as the potential pest control target. It provides a theoretical basis for further development and screening of effective trehalose-6-phosphate synthase inhibitors to controlpests and so on.
white-backed planthopper(); trehalose-6-phosphate synthase (TPS); RNA interference;chitin synthesis; quantitative real-time PCR (qRT-PCR)
10.3864/j.issn.0578-1752.2019.19.007

2019-05-05;
2019-06-10
国家自然科学基金(31560511,31672081)、贵州省科学技术基金(黔科合JZ字[2014]2014号)
张道伟,E-mail:zhangdw1000@163.com。
唐斌,Tel:571-28865680;E-mail:tbzm611@163.com
(责任编辑 岳梅)
