近零磁场下灰飞虱转录表达分析稳定性内参基因筛选
2019-10-12刘凡奇万贵钧曾路影李春绪潘卫东陈法军
刘凡奇,万贵钧,曾路影,李春绪,潘卫东,陈法军
近零磁场下灰飞虱转录表达分析稳定性内参基因筛选
刘凡奇1,万贵钧1,曾路影1,李春绪1,潘卫东2,陈法军1
(1南京农业大学植物保护学院,南京 210095;2中国科学院电工研究所生物电磁学北京市重点实验室,北京 100190)
地磁场(geomagnetic field,GMF)并不是稳定不变的,其随时间和空间时刻变化。目前,随着对动物磁生物学研究的日益深入,基于实时荧光定量PCR (qRT-PCR)技术开展的磁响应基因转录表达谱研究有力促进了磁响应通路的鉴定和磁感受机制的揭示。【】筛选近零磁场(near-zero magnetic field,NZMF)下短翅型灰飞虱()稳定表达的内参基因,使对目的基因的定量分析更加准确。迁飞性昆虫灰飞虱采自江苏省农业科学院试验田并在室内使用TN1三叶期稻苗进行扩繁(温度:(25.0±1.0)℃,相对湿度:70%—90%,光周期:14L﹕10D)。采用亥姆霍兹线圈室内模拟近零磁场(NZMF;<500 nT)和地磁场(GMF;~50 000 nT),人工模拟磁场强度有效处理空间为直径30 cm的球形空间,试验过程中严格控制除磁场强度外的环境因子(温度:(25.0±1.0)℃,相对湿度:75%,光周期:14L﹕10D)并利用磁通门计每日对人工模拟磁场进行校准和监测,灰飞虱连同TN1三叶期稻苗均置于试管中进行暴露处理,每隔两日与对照磁场中稻苗对调以避免稻苗潜在磁响应对灰飞虱的影响。利用Trizol法分别提取初羽化灰飞虱雌、雄成虫总RNA,检测各生物学重复RNA质量并调至含量一致,反转录为cDNA,利用qRT-PCR技术并结合常用内参筛选分析软件geNorm、NormFinder、BestKeeper以及在线综合分析系统RefFinder对在NZMF和GMF两种磁场强度下灰飞虱体内的内参基因稳定性进行评估筛选,其中,待评估的11个常用内参基因包括、(和)、()、()、()、()、()、()、()和()。不同磁场环境(NZMF vs. GMF)下,灰飞虱短翅雌成虫和表达稳定性在geNorm和NormFinder两种评估方法中都居于前两位,与BestKeeper软件的结果略有差异,进而利用在线工具RefFinder对以上3种方法的评估结果进行稳定性综合排序,结果表明稳定性最好,稳定性次之;灰飞虱短翅雄成虫中,基于geNorm、NormFinder和BestKeeper 3种评估方法,和表达稳定性中均居于前两位,而表达稳定性虽在NormFinder和BestKeeper中处于前两位,但其在geNorm中稳定性较低,最后,通过在线工具RefFinder综合分析表明,稳定性最好,稳定性次之。明确了不同磁场强度(NZMF vs. GMF)下适用于灰飞虱短翅雌、雄成虫中稳定表达的内参基因,其中,若使用双内参系统,雌成虫中可使用和搭配,雄成虫中可使用和搭配,为稳定表达的内参基因系统。此外,在灰飞虱短翅型雌、雄成虫中均可作为稳定的单一内参基因使用。研究结果确保了对灰飞虱响应磁场强度变化研究中关键目的基因转录表达的准确定量,并为今后开展磁场强度变化下的转录表达谱分析提供了有力保障。
灰飞虱; 近零磁场; 磁场强度;实时荧光定量PCR;内参基因筛选
0 引言
【研究意义】一个世纪前,人类首次提出“磁场地图”的观点[1]。地磁场(geomagnetic field,GMF)为包括昆虫在内的多种动物,如帝王蝶、海龟、龙虾等,提供了定向和位置信息[2]。此外,磁场强度改变可对许多动物的生长发育及新陈代谢产生影响,这些不同强度的磁场可依据强度范围划分为弱磁场(<1 mT)、中等强度磁场(1 mT—1 T)和强磁场(>1 T)[3-7]。地磁场强度由赤道向两极呈现由低到高的渐变态势,其范围从赤道附近的~25 μT到南北磁极的~65 μT[8]。迁飞昆虫多可进行跨纬度长距离迁移[9],这必然涉及其迁出地与迁入地的地磁强度差异[10]。基因表达分析被广泛应用于生命科学领域,在基于磁场强度变化的磁响应研究中发挥重要作用。实时荧光定量PCR(qRT-PCR)作为对基因进行转录水平表达分析的重要技术手段,具有特异性强、覆盖范围广、操作方便、实时性等特点。qRT-PCR包括相对定量和绝对定量,其中相对定量应用更加广泛,可在处理和对照组中均稳定表达的内参基因系统对定量结果的准确性和可重复性至关重要。常用的()、()等内参基因是否可在磁场强度差异处理下的动物体内稳定表达,至今尚无验证。因此,筛选出在磁场强度变化环境下能稳定表达的内参基因对于磁响应基因信号通路的准确鉴定具有重要意义,对生物磁感受机制的揭示具有积极促进作用。【前人研究进展】内参基因是维持细胞生命活动所必需的,在所有细胞中均可表达的一类基因,此观点在前基因组时代提出,研究发现,传统内参基因在不同外界因子处理、生物的不同发育历期、不同组织部位、不同生理条件下表达水平均可能存在差异。因此,科研人员需针对不同外界处理、不同研究对象寻找特异性稳定表达的内参基因(系统)。目前已发表的基于磁场强度变化的磁响应研究中,曾选用[11]、[12]、[13]、()[14-15]、[16]、[17]等作为内参基因。虽然曾有研究对强磁场下细胞系内内参基因稳定性进行评估,但由于细胞系和活体动物内细胞外环境存在较大差异,有必要对活体动物体内内参基因的稳定性进行重新评估。另外,强磁场和弱磁场引起磁生物学效应的机制可能不同,前者可能类似于非特异性的胁迫效应,而近零磁场(near-zero magnetic field,NZMF)等弱磁场可能由与动物磁定向类似的磁感受机制介导[18-19],因此选择与自然地磁场强度差异仅为地磁强度水平的近零磁场作为磁场强度变化处理,所评估出的稳定内参基因对后续特异性磁响应机制转录水平研究更具有普适性。目前,利用细胞系开展的生物对磁场强度变化磁响应研究表明,近零磁场处理将显著影响肌动蛋白(Actin)的组装[12],因此参与Actin蛋白表达调控的相关基因(如)可能受磁场强度变化的影响,从而无法作为不同磁场强度处理实验中的内参基因。【本研究切入点】灰飞虱()广泛分布于东亚、东南亚、北非及欧洲等地区[20-21],其寄主范围广,具有翅的多型现象(长翅型和短翅型),并表现出趋光和迁飞特性[22]。近年来以稻飞虱为模式昆虫开展的基于磁场强度变化的磁生物学效应研究进一步突出了稻飞虱在磁生物学研究领域的潜在模式作用[23-24]。NZMF与自然GMF的磁场强度差异仅为地磁强度水平,既可将其视为屏蔽地磁场的阴性对照,又可利用其探究地磁强度水平磁场强度变化对生物的潜在磁效应,且由于该磁场强度更能反映生物正常生理性磁响应,因此评估筛选可用于灰飞虱对NZMF(vs. GMF)磁响应研究中的稳定内参基因(系统)将是本研究及后续磁感受机制研究的重要切入点。【拟解决的关键问题】利用人工磁场模拟磁场强度变化(NZMF vs. GMF),以灰飞虱初羽化1日龄短翅雌、雄成虫作为研究对象,筛选可在近零磁场和对照地磁场中稳定表达的内参基因,为灰飞虱磁响应研究中关键目标基因的转录表达精确分析提供方法学依据,提高后续动物特异性磁响应基因信号转导通路鉴定的准确性。
1 材料与方法
试验于2017年在南京农业大学完成。
1.1 供试水稻与虫源
所用灰飞虱虫源采自江苏省农业科学院试验田。用于繁殖灰飞虱种群的水稻品种为感虫品种TN1,水稻盆栽(直径×高度:7 cm×10 cm)置于人工气候箱(型号:GXZ-500B;精度:±1.0℃;RH:±10%;光照强度:15 000 lx;生产厂家:宁波江南实验仪器有限公司),日夜环境温度为(25.0±1.0)℃,相对湿度为70%—90%,光周期为14L﹕10D。于水稻三叶期稻苗用于接种灰飞虱,以木村B营养液提供水稻苗营养。
1.2 近零磁场(NZMF)发生装置
正常GMF的地磁强度范围一般在25—65 μT[8]。本研究使用自主研发的直流电型亥姆霍兹线圈控制磁场强度装置(发明专利授权号:ZL201310003381.4)模拟了NZMF处理组(<500 nT)和GMF对照组(~50 000 nT)两种磁场,以筛选可在NZMF和GMF下均稳定表达的内参基因。人工模拟磁场强度的有效处理空间在直径为30 cm的球形范围内。单头灰飞虱饲养于生长单株三叶期TN1水稻苗的玻璃试管中,并一同置于NZMF处理组和GMF对照组中,每两日对调处理和对照组中的稻苗以避免稻苗的潜在磁响应引起的试验误差,具体处理细节参照文献[13]。试验过程中使用温湿度及光照控制装置,控制条件为温度(25.0±1.0)℃,相对湿度75%,光周期14L﹕10D。使用磁通门计(型号:191A;精度:±1 nT;厂家:中国青岛中宇环泰科技有限公司)每日对人工磁场发生装置内的磁场强度进行监测校准,以保证试验处理所需的磁场强度的稳定性和准确性。
1.3 试验方法
用Trizol法提取分别来自于NZMF和GMF中的初羽化灰飞虱短翅雌、雄成虫总RNA,每个样品设置3个生物学重复和3个技术重复。由微量分光光度计(型号:NanoDrop 2000C,美国Thermo公司)检测试验样本的RNA浓度和质量,将样本RNA统一调至100 ng,参照PrimeScriptTMRT Reagent Kit with gDNA Eraser(Perfect real-time)试剂盒的说明书进行反转录得到cDNA,稀释20倍后采用20 μL反应体系进行荧光定量PCR,参见SYBY Premix Ex Taq试剂盒:(1)反应体系(总体积20.0 μL):SYBR® Premix Ex TaqTM(Tli RNaseH Plus)10.0 μL,ddH2O 7.8 μL,Forward Primer(10 μmol·L-1)0.4 μL,Reverse Primer(10 μmol·L-1)0.4 μL,ROX Reference Dye II 0.4 μL,cDNA 1.0 μL;(2)反应条件:95℃ 30 s;95℃ 5 s,60℃ 34 s,40个循环;熔解曲线:95℃ 15 s;60℃ 1 min,95℃ 15 s。引物和保守序列分别为()、(和)、()、()、()、()、()、()、()和()(表1)。
1.4 数据分析
目前,用于分析不同试验条件下内参基因稳定性的软件有多种,其中,基于Excel统计学分析方法主要有geNorm、NormFinder和BestKeeper以及在线分析软件RefFinder等。
geNorm和NormFinder软件在导入数据前需将原始数据CT值进行线性方程转化,计算每个基因的相对表达量2-ΔCT值,输入软件后得到各个内参基因的平均表达稳定值(M),根据M值大小进行排序,M值越小,稳定性越高。geNorm软件通过标准化因子配对差异分析得到变异值(V),并以0.15作为差异分析的默认值,当Vn/Vn+1<0.15时,按照稳定性排序确定合适内参基因数目为n个。BestKeeper软件是将原始CT值导入BestKeeper软件中,在每个基因之间配对,产生相关系数及标准差等,根据相关系数和标准差的大小对内参基因的稳定性进行评价。相关系数越大,标准差越小,内参基因稳定性越好。RefFinder是一种在线分析软件,通过以特定算法综合分析上述软件的不同分析结果并给出内参基因稳定性的综合排序。本文中箱形图中横线示中位数,上下尾须分别示意上四分位数(Q3)+1.5×四分位距(Q3-Q1)和下四分位数(Q1)-1.5×四分位距(Q3-Q1)。
2 结果
2.1 灰飞虱雌成虫qRT-PCR内参基因的筛选
提取灰飞虱短翅雌成虫RNA,反转录成cDNA后进行qRT-PCR反应,得到11个内参基因的CT值为19.96—28.03,由于CT代表基因表达量,CT值越小基因表达量越高,CT值越大基因表达量越低。因此,由图1可见,表达量最高,表达量最低。其中,和表达丰度居于前两位,平均CT值分别为20.29和20.74。对原始CT值做箱形图分析后发现,和表达量数据分布较为集中,而和表达量数据分布较为分散。利用geNorm、NormFinder和BestKeeper软件对上述11个内参基因的稳定性进行评估,结果如表2所示,和表达稳定性在geNorm和NormFinder两种评估方法中都居于前两位,与BestKeeper软件的结果略有差异,可能是软件算法不同造成的。因此。利用在线工具RefFinder对以上3种方法的评估结果进行稳定性综合排序,结果表明稳定性最好,稳定性次之(表2)。
为了确定合适数目的内参基因,采用geNorm软件进一步分析,geNorm通过标准化因子配对差异分析得出两两比较的变异值(V),并以0.15为默认值,当Vn/Vn+1<0.15时,说明无必要使用数量≥n+1的内参基因为内参,因此即可按照稳定性排序确定合适内参基因数目为n个。分析结果如图2所示,V2/3=0.049<0.15,故不需要引入第3个内参基因。因此,近零磁场下,灰飞虱短翅雌成虫进行qRT-PCR反应时,稳定性较高的EF-1和RPL9搭配使用即可为理想的内参体系。
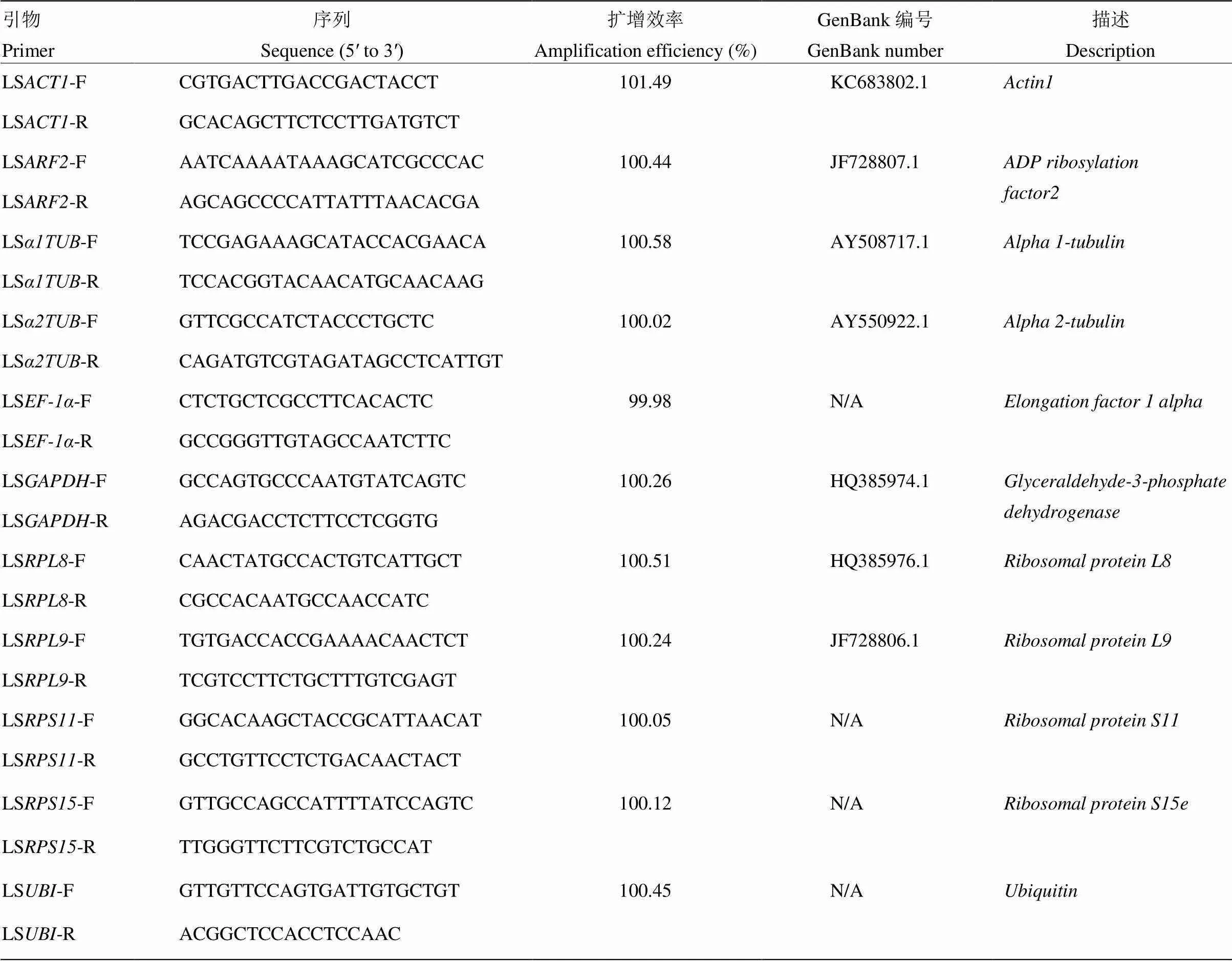
表1 内参基因引物信息

图1 11个候选内参基因在灰飞虱短翅雌成虫中的表达水平
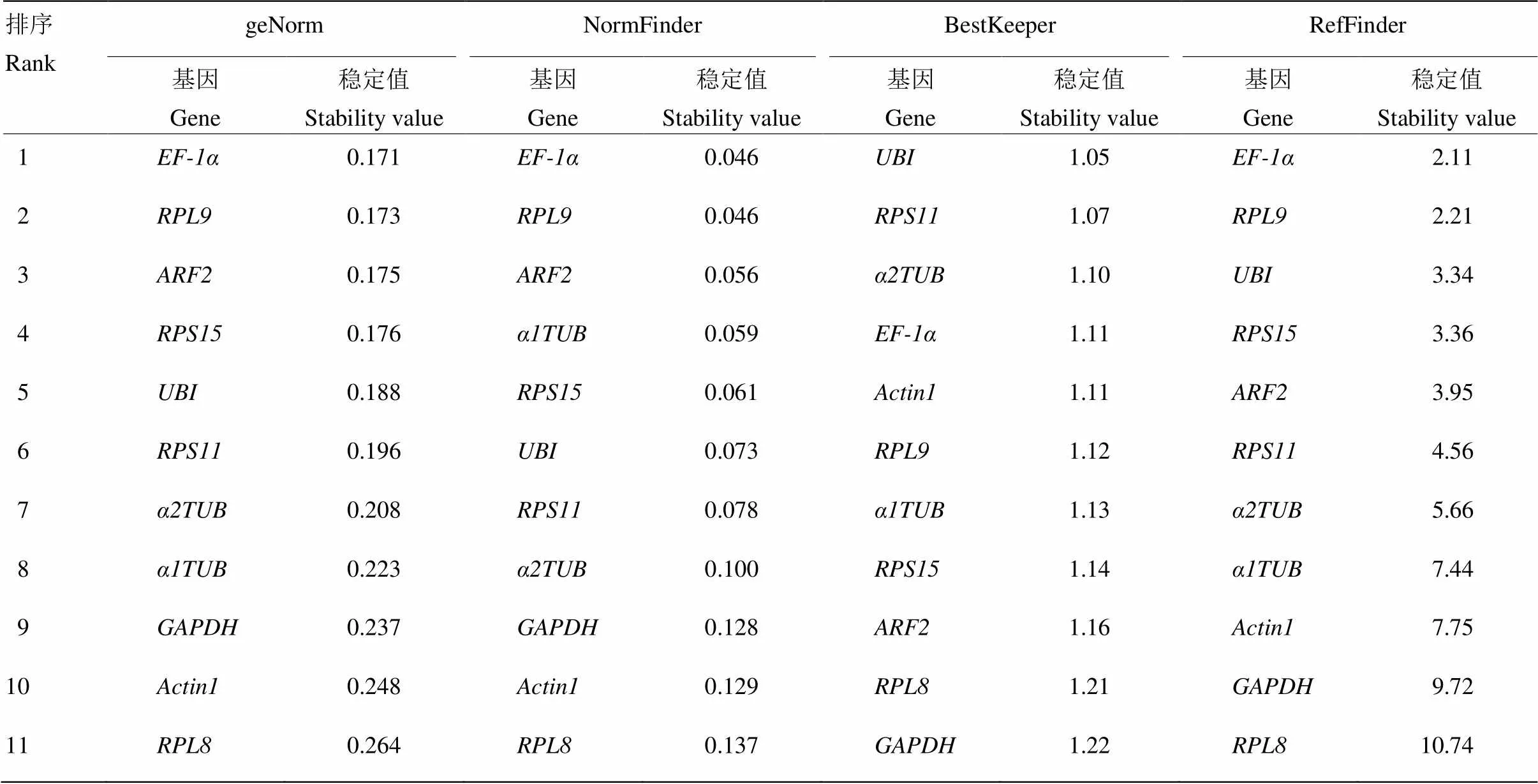
表2 利用geNorm、NormFinder、BestKeeper和RefFinder分析灰飞虱短翅雌成虫中各内参基因稳定性
2.2 灰飞虱雄成虫qRT-PCR内参基因的筛选
提取灰飞虱短翅雄成虫RNA,反转录成cDNA后进行qRT-PCR反应,得到11个内参基因的CT值为17.21—32.24。由图3中可见,表达量最高,表达量最低。其中,和表达丰度居于前两位,平均CT值分别为17.53和20.80,丰度最高基因与雌虫一致。对原始CT值分析后发现,和表达量数据分布较为集中,而和表达量数据分布较为分散。利用geNorm、NormFinder和BestKeeper软件对上述11个内参基因的稳定性进行评估,结果如表3所示,和表达稳定性geNorm、NormFinder和BestKeeper 3种评估方法中都居于前3位,而表达稳定性在NormFinder和BestKeeper中分别处于第2位和第1位,但在geNorm中稳定性比较低。最后,通过在线工具RefFinder分析得出,稳定性最好,稳定性次之(表3)。

图2 利用geNorm软件分析候选内参基因的配对差异值(雌成虫)
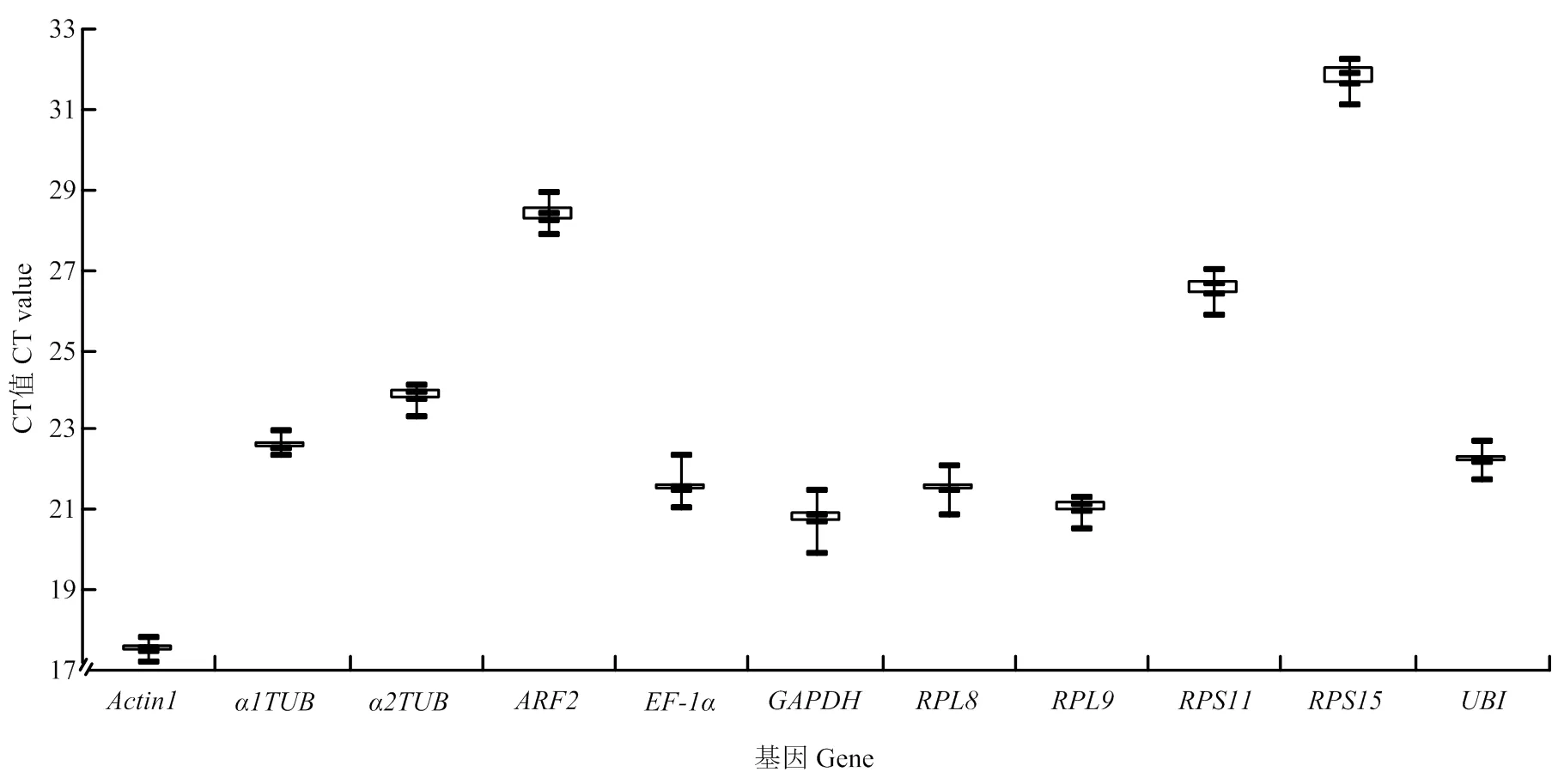
图3 11个候选内参基因在灰飞虱短翅雄成虫中的表达水平

表3 利用geNorm、NormFinder、BestKeeper和RefFinder分析灰飞虱短翅雄成虫中各内参基因稳定性
为了确定合适数目的内参基因,采用geNorm软件进一步分析。结果如图4所示,V2/3=0.052<0.15,故不再引入第 3 个内参基因。因此,近零磁场下,和结合使用即可作为灰飞虱短翅雄成虫qRT-PCR反应中理想的内参基因体系。

图4 利用geNorm软件分析候选内参基因的配对差异值(雄成虫)
3 讨论
利用qRT-PCR技术进行试验时,基因表达量受多种因素影响,如RNA质量、反转录效率及下游处理步骤的多变性等[25-26],为减少试验误差,需引入内参基因,对试验结果进行标准化校正[27]。内参基因多为维持细胞生命活动所必须且在所有细胞中均可表达的一类基因。理想的内参基因应满足以下条件:(1)在不同发育阶段、不同细胞组织器官、不同环境中均可稳定表达[28];(2)表达不受细胞周期控制,不受外源或内源信号影响[29];(3)表达水平与目的基因表达水平一致[30]。内参基因可提高结果准确性,但在多变的试验条件下,内参基因稳定性受到影响,即使在一种环境条件下适用的内参基因在其他环境下不一定能够稳定表达[31],且不同生物之间也存在一定差异。因此,选择稳定表达的内参基因对于结果的准确性有重要作用[32-34]。Gutierrez等[35]研究发现,使用未验证的内参基因测定目的基因表达量结果与正常结果存在较大偏差;Vandesompele等[36]研究表明,使用单个内参基因进行试验时,表达量差异较小的基因可能难以被发现,甚至可能得到与预期不一致的试验结果。因此,在基因表达量测定时,选择稳定表达的内参基因作为参考标准,可减少测定过程中不确定因素的影响,保证结果的准确性和试验的可重复性。
本研究发现,近零磁场下,在灰飞虱短翅雌成虫体内稳定表达,但在灰飞虱短翅雄成虫体内稳定性极低;在灰飞虱短翅雄成虫体内表达稳定,而在灰飞虱短翅雌成虫体内稳定性一般。该结果表明,即使是同一种生物在相同发育历期,其内参基因表达的稳定性可因性别而异,进一步证明内参基因校正有利于提高基因表达分析结果的准确性。实际上,除了性别因素之外,还有多种因素会影响内参基因的表达水平。对柑橘全爪螨()的研究发现,和表达量受温度胁迫影响较小,可作为热生物学研究的内参基因;和表达量受不同药剂影响较小,可作为毒理学研究的理想内参基因[37];表达水平在不同发育阶段变化较小,可作为发育生物学研究的理想内参基因。对小菜蛾()研究发现,表达水平在不同发育阶段变化较小,为理想的内参基因;Bt毒素诱导下小菜蛾PCR结果表明,能稳定表达,可作为这一条件下理想的内参基因[38]。橘小实蝇()不同组织部位内参基因稳定性研究结果表明,和在中肠和马氏管中表达水平稳定;和在脂肪体中能稳定表达,可作为相应组织基因表达量测定时的标准化内参基因[39]。Lord等对赤拟谷盗()的基因表达水平研究发现,能稳定表达,为理想的内参基因[40]。
此外,近零磁场下,不仅在灰飞虱短翅雌成虫中稳定表达,同时在灰飞虱短翅雄成虫中也有较高的稳定性。可参与翻译的调控、GTP酶活性的调控等,在动物生长发育过程中发挥重要作用。基于的稳定表达,该基因是近零磁场下灰飞虱短翅雌、雄成虫进行qRT-PCR首选的内参基因。但是,在灰飞虱处于其他磁场强度下能否作为内参基因使用,仍需进一步验证。
4 结论
不同磁场环境(NZMF vs. GMF)下,和在短翅雌成虫体内能稳定表达,可作为理想的双内参基因体系;和在短翅雄成虫体内稳定表达,可作为理想的双内参基因体系;在短翅型雌、雄成虫对近零磁场的磁响应研究中,均表现出稳定表达的特性,可作为单一内参基因进行基因转录水平表达研究。研究结果明确了不同磁场强度下适用于灰飞虱短翅雌、雄成虫中稳定表达的内参基因,确保了对灰飞虱响应磁场强度变化研究中关键目标基因转录表达水平的准确定量,可为今后开展磁场强度变化下的转录表达谱分析提供有力保障。
[1] WALLRAFF H G. The magnetic map of homing pigeons: an evergreen phantom., 1999, 197(2): 265-269.
[2] LOHMANN K J. Q & A: Animal behaviour: Magnetic-field perception., 2010, 464(7292): 1140-1142.
[3] ROSEN A D. Mechanism of action of moderate-intensity static magnetic fields on biological systems., 2003, 39(2): 163-173.
[4] SAVIĆ T, JANAĆ B, TODOROVIĆ D, PROLIĆ Z. The embryonic and post-embryonic development in twospecies exposed to the static magnetic field of 60 mT., 2011, 30(2): 108-114.
[5] WAN G J, JIANG S L, ZHAO M, ZHAO J Y, ZHANG Y C, PAN W D, SWORD G A, CHEN F J. Geomagnetic field absence influences adult body weight of a migratory insect, potentially through appetite regulation., 2019, doi:10.1101/737361.
[6] ZHANG Y C, WAN G J, WANG W H, LI Y, YU Y, ZHANG Y X, CHEN F J, PAN W D. Enhancement of the geomagnetic field reduces the phototaxis of rice brown planthopperassociated with frataxin down-regulation., 2019, doi:10.1111/ 1744-7917.12714.
[7] POLIDORI E, ZEPPA S, POTENZA L, MARTINELLI C, COLOMBO E, CASADEI L, AGOSTINI D, SESTILI P, STOCCHI V. Gene expression profile in cultured human umbilical vein endothelial cells exposed to a 300 mT static magnetic field., 2012, 33(1): 65-74.
[8] FINLAY C C, MAUS S, BEGGAN C D, BONDAR T N, CHAMBODUT A, CHERMOVA T A, CHULLIAT A, GOLOVKOV V P, HAMILTON B, HAMOUDI M,. International geomagnetic reference field: the eleventh generation., 2010, 183(3): 1216-1230.
[9] CHAPMAN J W, REYNOLDS D R, WILSON K. Long-range seasonal migration in insects: mechanisms, evolutionary drivers and ecological consequences., 2015, 18(3): 287-302.
[10] WAN G J, LIU R Y, LI C X, HE J L, PAN W D, SWORD G A, HU G, CHEN F J. Geomagnetic field intensity as a cue for the regulation of insect migration., 2019, doi:10.1101/733782.
[11] CUNHA C, PANSERI S, MARCACCI M, TAMPIERI A. Evaluation of the effects of a moderate intensity static magnetic field application on human osteoblast-like cells., 2012, 2(6): 263-268.
[12] Mo W C, Zhang Z J, WANG D L, LIU Y, BARTLETT P F, HE R Q. Shielding of the geomagnetic field alters actin assembly and inhibits cell motility in human neuroblastoma cells., 2016, 6: 22624.
[13] WAN G J, JIANG S L, ZHAO Z C, XU J J, TAO X R, SWORD G A, GAO Y B, PAN W D, CHEN F J. Bio-effects of near-zero magnetic fields on the growth, development and reproduction of small brown planthopper,and brown planthopper,., 2014, 68: 7-15.
[14] WAN G J, WANG W J, XU J J, YANG Q F, DAI M J, ZHANG F J, SWORD G A, PAN W D, CHEN F J. Cryptochromes and hormone signal transduction under near-zero magnetic fields: new clues to magnetoreception in a rice planthopper., 2015, 10(7): e0132966.
[15] WAN G J, YUAN R, WANG W J, FU K Y, ZHAO J Y, JIANG S L, PAN W D, SWORD G A, CHEN F J. Reduced geomagnetic field may affect positive phototaxis and flight capacity of a migratory rice planthopper., 2016, 121: 107-116.
[16] ALEMÁN E I, MOREIRA R O, LIMA A A, SILVA S C, GONZÁLEZ- OLMEDO J L, CHALFUN-JUNIOR A. Effects of 60 Hz sinusoidal magnetic field onestablishment, multiplication, and acclimatization phases ofseedlings., 2014, 35(6): 414-425.
[17] WALTHER M, MAYER F, KAFKA W, SCHUTZE N. Effects of weak, low-frequency pulsed electromagnetic fields (BEMER type) on gene expression of human mesenchymal stem cells and chondrocytes: anstudy., 2007, 26(3): 179-190.
[18] HORE P J, MOURITSEN H. The radical-pair mechanism of magnetoreception., 2016, 45: 299-344.
[19] BINHI V N, PRATO F S. Rotations of macromolecules affect nonspecific biological responses to magnetic fields., 2018, 8: 13495.
[20] KISIMOTO R. Flexible diapauses response to photoperiod of a laboratory selected line in the small brown planthopper,Fallén., 1989, 24(1): 157-159.
[21] OTUKA A, MATSUMURA M, SANADA-MORIMURA S, TAKEUCHI H, WATANABE T, OHTSU R, INOUE H. The 2008 overseas mass migration of the small brown planthopper,, and subsequent outbreak of rice stripe disease in western Japan., 2010, 45(2): 259-266.
[22] 程遐年, 陈若篪, 习学, 杨联民, 朱子龙, 吴进才, 钱仁贵, 杨金生. 稻褐飞虱迁飞规律的研究. 昆虫学报, 1979, 22(1): 1-21.
CHENG X N, CHEN R C, XI X, YANG L M, ZHU Z L, WU J C, QIAN R G, YANG J S. Studies on the migrations of brown planthopperstal, 1979, 22(1): 1-21. (in chinese)
[23] 贺静斓, 张明, 刘瑞莹, 万贵钧, 潘卫东, 陈法军. 近零磁场下干扰磁响应关键基因对褐飞虱寿命的影响. 中国农业科学, 2019, 52(1): 45-55.
HE J L, ZHANG M, LIU R Y, WAN G J, PAN W D, CHEN F J. Effects of the interference of key magnetic response genes on the longevity of brown planthopper () under near-zero magnetic field., 2019, 52(1): 45-55. (in chinese)
[24] 张明, 刘瑞莹, 贺静澜, 袁锐, 万贵钧, 潘卫东, 陈法军. 近零磁场下褐飞虱翅型分化及其长翅成虫正趋光性和飞行能力研究. 昆虫学报, 2019, 62(1): 82-90.
ZHANG M, LIU R Y, HE J L, YUAN R, WAN G J, PAN W D, CHEN F J. Wing-form differentiation, phototaxis and flight performance of the brown planthopper,(Hemiptera: Delphacidae) under near-zero magnetic fields., 2019, 62(1): 82-90. (in chinese)
[25] HUGGETT J, DHEDA K, BUSTIN S, ZUMLA A. Real-time RT-PCR normalisation; strategies and considerations., 2005, 6(4): 279-284.
[26] STEINAU M, RAJEEVAN M S, UNGER E R. DNA and RNA references for qRT-PCR assays in exfoliated cervical cells., 2006, 8(1): 113-118.
[27] SUZUKI T, HIGGINS P J, CRAWFORD D R. Control selection for RNA quantitation., 2000, 29(2): 332-337.
[28] BUSTIN S A. Quantification of mRNA using real-time reverse transcription PCR (RT-PCR): trends and problems., 2002, 29(1): 23-39.
[29] THELLIN O, ZORIZ W, LAKAYE B, DE BORMAN B, COUMANS B, HENNEN G, GRISAR T, LGOUT A, HEINEN E. Housekeeping genes as internal standards: use and limits., 1999, 75(2/3): 291-295.
[30] DHEDA K, HUGGETT J F, BUSTIN S A, JOHNSON M A, ROOK G, ZUMLA A. Validation of housekeeping genes for normalizing RNA expression in real-time PCR., 2004, 37(1): 112-119.
[31] VOLKOV R A, PANCHUK I I, SCHÖFFL F. Heat-stress-dependency and developmental modulation of gene expression: the potential of house-keeping genes as internal standards in mRNA expression profiling using real-time RT-PCR., 2003, 54(391): 2343-2349.
[32] BUSTIN S A, BENES V, NOLAN T, PFAFFL M W. Quantitative real-time RT-PCR—a perspective., 2005, 34: 597-601.
[33] VANGUILDER H D, VRANA K E, FREEMAN W M. Twenty-five years of quantitative PCR for gene expression analysis., 2008, 44(5): 619-626.
[34] DERVEAUX S, VANDESOMPELE J, HELLEMANS J. How to do successful gene expression analysis using real-time PCR., 2010, 50(4): 227-230.
[35] GUTIERREZ L, MAURIAT M, GUÉNIN S, PELLOUX J, LEFEBVRE J F, LOUVET R, RUSTERUCCI C, MORITZ T, GUERINEAU F, BELLINI C, VAN Wuytswinkel O. The lack of a systematic validation of reference genes: a serious pitfall undervalued in reverse transcription-polymerase chain reaction (RT-PCR) analysis in plants., 2008, 6(6): 609-618.
[36] VANDESOMPELE J, PRETER K D, PATTYN F, POPPE B, VAN ROY N, DE PAEPE A, SPELEMAN F. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multipleinte internal control genes., 2002, 3(7): research0034.1.
[37] NIU J Z, DOU W, DING T B, YANG L H, SHEN G M, WANG J J. Evaluation of suitable reference genes for quantitative RT-PCR during development and abiotic stress in(McGregor) (Acari: Tetranychidae)., 2012, 39(5): 5841-5849.
[38] 符伟, 谢文, 张卓, 吴青君, 王少丽, 张友军. Bt毒素诱导下小菜蛾实时定量PCR内参基因的筛选. 昆虫学报, 2012, 55(12): 1406-1412.
FU W, XIE W, ZHANG Z, WU Q J, WANG S L, ZHANG Y J. Selection of valid reference genes for gene expression studies by quantitative real-time PCR in(Lepidoptera: Plutellidae) after exposure to Bt toxin., 2012, 55(12): 1406-1412. (in chinese)
[39] SHEN G M, JIANG H B, WANG X N, WANG J J. Evaluation of endogenous references for gene expression profiling in different tissues of the oriental fruit fly(Diptera: Tephritidae)., 2010, 11: 76.
[40] LORD J C, HARTZER K, TOUTGES M, OPPERT B. Evaluation of quantitative PCR reference genes for gene expression studies inafter fungal challenge., 2010, 80(2): 219-221.
Selection of Stable Internal Reference Genes for Transcript Expression Analyses inUnder Near-Zero Magnetic Field
LIU FanQi1, Wan GuiJun1, Zeng LuYing1, Li ChunXu1, Pan WeiDong2, Chen FaJun1
(1College of Plant Protection, Nanjing Agricultural University, Nanjing 210095;2Beijing Key Laboratory of Bioelectromagetics, Institute of Electrical Engineering, Chinese Academy of Sciences, Beijing 100190)
【】The geomagnetic field (GMF) is not constant, it can change with time and space. At present, with the development of research on animal magnetic biology, the study on transcriptional profiling of magnetic response genes with quantitative real-time PCR (qRT-PCR) has greatly promoted the identification of magnetic response pathway and the uncovering of magnetoreception mechanism.【】The objective of this study is to screen the internal reference genes of the brachypterous small brown planthopper () under near-zero magnetic field (NZMF), and to make the quantification of target genes more accurate.【】The population of, a migratory insect, was collected from the experimental fields of Jiangsu Academy of Agricultural Sciences and expanded indoors using TN1 three-leaf rice seedlings (temperature: (25.0±1.0)℃, relative humidity: 70%-90%, photoperiod: 14L﹕10D). Helmholtz coils system was used to simulate the near-zero magnetic field (NZMF; <500 nT) vs. geomagnetic field (GMF; ~ 50 000 nT), the artificial simulated magnetic field intensity was homogeneous within a spherical space with a diameter of 30 cm. During the experiment, environmental factors other than the magnetic field intensity were strictly controlled (temperature: (25.0±1.0)℃, relative humidity: 75%, photoperiod: 14L﹕10D) and the artificial simulated magnetic field was calibrated and monitored daily using a fluxgate magnetometer. Theand TN1 three-leaf rice seedlings were placed in a test tube for exposure treatment. Every two days, the rice seedlings in control and treatment magnetic fields were swapped to avoid the influence triggered by the potential magnetic response of rice seedlings on. Trizol method was used to extract the total RNA of the female and male adults of, respectively. The quality of total RNA was inspected and adjusted to the same mass, and cDNA was then made by reverse transcription. using qRT-PCR technique and combined with the common internal reference selection software including geNorm, NormFinder, BestKeeper, and the online integrated analysis system RefFinder, the stability of internal reference genes inunder NZMF and GMF was evaluated and screened. Among them, 11 common candidate internal reference genes to be evaluated included,(and),(),(),(),(),(),(),(), and(). 【】For brachypterous female adults under different magnetic field environments (NZMF vs. GMF), the expression stability ofandranked as the top two in the two assessment software of geNorm and NormFinder, which was slightly different from the results of BestKeeper software. Furthermore, the stability of the above three methods was sorted by online tool RefFinder. The results showed that the stability of EF-1was the best,followed by. For brachypterousmale adults under different magnetic field environments (NZMF vs. GMF), based on the three evaluation methods of geNorm, NormFinder, and BestKeeper, the expression stability ofandranked as the top two. Although the expression stability ofwas in the top two in NormFinder and BestKeeper, its stability was low in geNorm. Finally, through the online tool RefFinder synthesis analysis, it was shown that the stability ofwas the best, followed by.【】Stably expressed reference genes in the brachypterous male and female adults ofwere clarified under different magnetic field intensities (NZMF vs. GMF). For a double reference gene system, thecombination ofand, and the combination ofandcan be used in the brachypterous female and male adults, respectively, which is a stable reference gene system. Also,can be used alone as a stable reference gene in both male and female brachypterous adults of. The results of this study ensure the accuratequantification of transcription expression of key target genes in response to changes in magnetic field intensity, and provide a strong guarantee for the future analysis of transcription expression profile under changes in magnetic field intensity.
; near-zero magnetic field; magnetic field intensity; quantitative real-time PCR (qRT-PCR); internal-reference gene selection
10.3864/j.issn.0578-1752.2019.19.006

2019-05-05;
2019-06-03
国家自然科学基金(31470454,31701787)、江苏省自然科学基金青年基金(BK20160717)、中央高校基本科研业务费(KYZ201818,KJQN201820)、国家重点研发计划(2017YFD0200400)、江苏省“青蓝工程”优秀中青年学术带头人项目
刘凡奇,E-mail:fanqiliu2014@163.com。
陈法军,E-mail:fajunchen@njau.edu.cn
(责任编辑 岳梅)
