RGD靶向超声造影剂对大鼠2期压力性损伤创面的靶向性研究
2019-10-11闫常帅陈江琼王笑一胡芳张杰
闫常帅,陈江琼,王笑一,胡芳,张杰△
压力性损伤(pressure injury,PI)是医院、社区及养老机构中长期卧床患者最常见的并发症,也是严重的护理不良事件。其中2 期压力性损伤最为常见,极易发展成慢性难愈性伤口,后期合并感染、败血症、全身衰竭,大大增加了患者死亡率。压力性损伤的治疗和护理非常棘手,国内学者在影响因素、评估量表、风险预测模型等方面做出了充分的研究,但其临床应用仍十分有限。近年来,以动物模型为基础的实验性研究逐渐得到国内外学者的关注。研究表明,整合素αvβ3在肿瘤、炎症、创面愈合等过程中均呈高表达,有促新生血管生成的作用[1],而炎症反应和新生血管的生成是压力性损伤形成及愈合过程中的重要病理过程,但整合素αvβ3在压力性损伤中的作用鲜有报道。精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp,RGD)三肽序列可以与整合素αvβ3特异性结合,是靶向药物制备中较为成熟的靶头[2]。随着分子影像学的发展,超声造影成为评估皮肤肿瘤和创面损伤的新手段[3-4],若压力性损伤创面有整合素αvβ3的表达,将RGD 靶向超声造影剂用于压力性损伤的评估,可能实现靶向显影和靶向给药,为压力性损伤评估和治疗提供新的思路。
1 材料与方法
1.1 实验动物 健康雄性SD 大鼠36 只,SPF 级,体质量(200±10)g,饲养于清洁明亮、温度(25±2)℃、湿度(50±5)%、通风良好的动物房,自由饮水取食。适应性饲养1周后按照随机数字表法分为实验组和对照组,每组18只。
1.2 主要仪器和试剂 圆形磁铁(10 mm×2 mm,1.9 g,1 450 Gs)、彩色多普勒超声诊断仪(Esaote MyLab Class C,意大利)。10%水合氯醛、脱毛膏(Veet 公司,法国),兔抗整合素αvβ3多克隆抗体(北京博奥森),二棕榈酰磷脂酰胆碱(DPPC,Avanti 公司,美国),二硬脂酰磷脂酰乙醇胺-聚乙二醇2000(DSPE-PEG2000)、精氨酸-甘氨酸-天冬氨酸多肽偶联二硬脂酰磷脂酰乙醇胺-聚乙二醇2000(RGD-PEG2000,corden公司,瑞士)。
1.3 模型的建立及标本留取 2组大鼠以10%水合氯醛(300 mg/kg)腹腔注射麻醉后,去除臀部毛发,备皮范围约5 cm×4 cm,脱毛膏脱毛后涂抹一层凡士林。实验组大鼠麻醉清醒后,采用皮肤桥法造模[5],提起备皮区域皮肤,将2 片圆形磁铁吸附于皮褶两侧,压迫2 h,造成局部皮肤缺血,然后移除0.5 h,使缺血皮肤再灌注,此为1个循环,每日循环4次,夜间保持压迫状态至次日,然后先移除磁铁0.5 h,再开始新的循环,连续压迫3 d。期间对照组除备皮外不做任何处理。3 d后根据2016年美国国家压疮咨询小组(NPUAP)最新发布的分期系统[6],评估实验组大鼠创面是否达到2 期压力性损伤的标准。成模标准为部分皮层缺失,真皮层暴露;伤口床基底面为粉红色或红色,湿润,也可出现完整或破裂的血清性水疱;脂肪层和深部组织未暴露,无肉芽组织、腐肉和焦痂。实验组大鼠处理完毕后剪取包括创缘在内圆形皮肤组织(直径约为12 mm),对照组大鼠剪取相同部位和大小的正常皮肤组织,均用10%福尔马林浸泡固定。
1.4 检测方法
1.4.1 HE染色 取充分固定的皮肤标本,石蜡包埋,切片厚度为5 μm。依照常规二甲苯脱蜡,梯度乙醇脱水,苏木素染核,盐酸乙醇分化,淡氨水返蓝,伊红染色,梯度乙醇脱水,二甲苯透明,中性树胶封片后于光镜下观察。
1.4.2 免疫组化染色检测整合素αvβ3的表达 石蜡切片常规脱蜡至水,蒸馏水冲洗,PBS溶液浸泡5 min,0.1 mmol/L 枸橼酸缓冲液煮沸修复抗原,3%H2O2去离子水孵育15~20 min,以消除内源性过氧化物酶,正常山羊血清封闭15 min。滴加兔抗整合素αvβ3一抗(1∶400稀释)于4 ℃冰箱过夜。次日滴加二抗,常规DAB 显色,中性树胶封片。以PBS 代替一抗作为阴性对照,用已知阳性片作为阳性对照。显微镜下每张切片选择4 个高倍镜视野(×400)观察并拍照,其中2 个皮肤表层,2个新生血管。
1.5 超声造影剂的制备和靶向效果评估
1.5.1 RGD 靶向纳米泡和空白纳米泡的制备 精确称量DPPC(5 mg)、RGD-PEG2000(2 mg)、DSPE-PEG2000(1 mg),溶于0.5 mL 含10%甘油的PBS 溶液,涡旋混合器混匀,密闭容器中充入全氟化碳惰性气体,然后置于银汞胶囊震荡器震荡50 s,形成RGD靶向纳米泡,即RGD靶向超声造影剂(粒径468 nm,电位-4.2 mV)。取等质量的DPPC 和DSPEPEG2000 按上述方法制得空白纳米泡(粒径482 nm,电位-3.5 mV)。
1.5.2 RGD 靶向超声造影剂的靶向效果评估 实验组大鼠成模后均行超声造影检查。大鼠麻醉后俯卧位固定,暴露创面,选用LA523高频线阵探头,用自制支架固定,调整探头位置,至良好切面,仪器各项参数在整个实验过程中不变。经尾静脉分别注射空白纳米泡和RGD 靶向纳米泡0.5 mL(2×107/mL),2次注射间隔至少10 min,以确保第1次注射的造影剂完全消退后再注射第2 次。注射后即刻启动动态存储功能,待造影剂注入后30 s,将超声诊断仪切换至flash模式,给予超声空化[机械指数(MI)=0.3],爆破局部纳米泡,再次切换至造影模式,待再次灌注后3 min,记录全部造影数据。超声造影检查结束后,每个视频取4个灌注较稳定的位置,测量空化前后造影增强强度(intensity,I,dB)并计算差值,即靶向黏附值(ΔI)=空化前I值-空化后I值。
1.6 统计学方法 使用SPSS 23.0 软件进行统计学分析,符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 成模情况 实验组18 只大鼠均成功制备2 期压力性损伤模型,皮肤创面变薄,红色,淤血,边缘水肿,真皮受损缺失,未见皮下组织暴露,达到2 期压力性损伤标准;对照组皮肤未见明显变化,见图1。
2.2 2组大鼠皮肤组织病理学变化 对照组复层鳞状上皮、表皮、真皮、皮下组织结构清晰,真皮层毛囊、皮脂腺等数量较多,见图2A;真皮层纤维致密,无炎症细胞浸润,见图2B。实验组皮肤表面凹凸不平,部分上皮结构断裂或缺失,未缺失部分鳞状上皮压缩变薄,部分坏死,细胞层次减少,结构不清,见图2C;真皮层内毛囊以及皮肤附属器明显减少,纤维排列紊乱,可见大量炎症细胞浸润,见图2D。
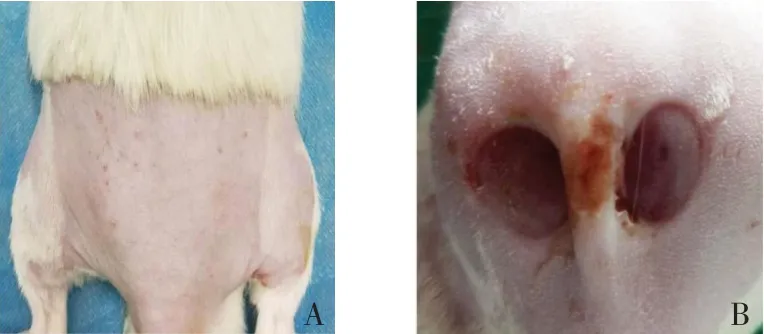
Fig.1 The rat skin appearance of control group and experimental group图1 2组大鼠皮肤外观
2.3 2组大鼠整合素αVβ3表达情况 2组大鼠皮肤组织除皮脂腺存在非特异性染色外,实验组大鼠皮肤组织中血管内皮细胞、表皮细胞均见棕黄色染色,整合素αvβ3呈阳性,对照组未见棕黄色染色,整合素αvβ3表达呈阴性,见图3。
2.4 RGD 靶向超声造影剂的靶向效果评估 二维超声下,实验组创面皮肤可见凹形下陷,创缘水肿增厚。注入空白纳米泡后,可见肌肉层先增强,然后向皮肤层缓慢灌注,皮肤层创缘增强稍快于创面且较稳定,强度略高于创面,组织坏死或血管闭塞区域可见充盈缺损,见图4A。超声空化后,增强强度与空化前未见明显差别,见图4B。注入RGD靶向纳米泡后,灌注过程与空白纳米泡相同,但是增强强度略高于空白纳米泡,见图4C。RGD靶向纳米泡给予超声空化后,增强强度略低于空化前,见图4D。RGD 靶向纳米泡靶向黏附值明显高于空白纳米泡,见表2。
3 讨论
传统观念认为,压力性损伤的形成是由于局部受压引起缺血缺氧,造成代谢产物堆积,细胞坏死。但近年研究发现,除缺血损伤外,再灌注造成的损伤是更重要的因素[7]。皮肤对缺血的耐受力虽然强于心、脑、肾等器官,但皮肤PI具有反复多次损伤和长期累积的特殊效应。本研究中动物模型的构建采用皮肤桥法,且设置压迫2 h,放松0.5 h的缺血再灌注周期,最大限度地模拟了临床中PI的形成过程。
整合素家族是细胞表面重要的黏附和信号传导受体,在调控细胞的黏附、增殖、分化、转移、凋亡过程中有重要作用[8]。该家族是由许多结构和功能相似的蛋白质组成的一系列膜受体,每个整合素分子都是由α 和β 这2 条链(亚基)通过非共价键形成的异二聚体跨膜糖蛋白,2 个亚基不同的组合形成了20多种整合素。其中,整合素αVβ3是一个经典的靶向成像和治疗的结合位点,可以与RGD肽特异性结合,近年来受到国内外极大的关注。大量研究已证明整合素αVβ3在肿瘤新生血管[9]、脉络膜新生血管[10]、伤口新生血管[11]中呈高表达。也有研究将其配体RGD 肽结合其他材料用于种植体引导牙周骨再生[12]、生物活性材料促进骨折愈合[13]等领域,取得了明显的效果。本研究HE染色结果显示,实验组损伤达真皮层,并有大量炎细胞浸润,达到了2期压力性损伤程度。免疫组化染色显示整合素αVβ3在新生的毛细血管内皮细胞和上皮细胞中高表达,说明整合素αVβ3参与了2期压力性损伤的形成。Ichioka等[14]的研究也证明了整合素αVβ3抑制剂能够减少大鼠皮肤缺血再灌注损伤中白细胞和血管内皮细胞的相互作用[14]。本研究中对照组整合素αVβ3表达阴性,说明在静止或成熟血管内皮细胞表面整合素αVβ3呈极低水平表达或无表达,但在压力性损伤中表达显著上升,这与压力性损伤过程中涉及创伤、炎症、缺血、缺氧、血管重塑、细胞增殖等病理过程有关。若以整合素αVβ3作为靶向结合位点,将RGD肽连接于空白造影剂,即可制备RGD 靶向超声造影剂,从而使造影剂向整合素αVβ3表达的部位黏附聚集,增强创面显影效果。
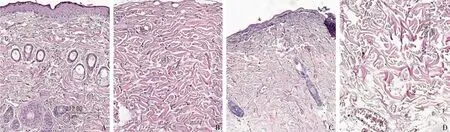
Fig.2 Comparison of HE staining of rat skin between the control group and the experimental group图2 对照组和实验组大鼠皮肤HE染色比较

Fig.3 Comparison of immunohistochemical staining of rat skin between the control group and the experimental group图3 对照组和实验组大鼠皮肤免疫组化染色对比

Fig.4 Pre-and post-cavitation images of two kinds of nano-bubble in experimental group图4 实验组大鼠两种纳米泡空化前后图像
Tab.2 Comparison of targeted adhesion value(ΔI)between two kinds of nano-bubble in experimental group表2 实验组大鼠2种纳米泡空化前后靶向黏附值(ΔI)比较(n=18,dB,±s)
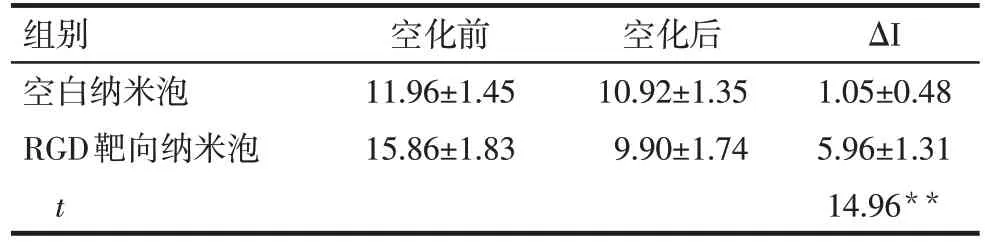
Tab.2 Comparison of targeted adhesion value(ΔI)between two kinds of nano-bubble in experimental group表2 实验组大鼠2种纳米泡空化前后靶向黏附值(ΔI)比较(n=18,dB,±s)
**P<0.01
组别空白纳米泡RGD靶向纳米泡t空化前11.96±1.45 15.86±1.83空化后10.92±1.35 9.90±1.74 ΔI 1.05±0.48 5.96±1.31 14.96**
超声造影剂是一种磷脂包裹惰性气体形成的微泡或纳米泡,是一种良好的血池显影剂,皮肤微小血管在超声探头适当声波下也可显影。同时,也可控制超声探头瞬间释放出高能量的超声波,局部纳米泡在机械能和热能的作用下爆破,失去显影功能,称为超声空化作用。本研究成功制备了靶向整合素αVβ3的RGD 靶向造影剂,并通过超声空化的原理,验证了其靶向性。当RGD靶向造影剂注入静脉后,除了血管中流动的纳米泡,还有少量与血管内皮细胞表面整合素αVβ3靶向结合的纳米泡。空化前RGD 纳米泡已完成蓄积及靶向黏附,此时血池中显影的为游离纳米泡与RGD靶向纳米泡。而空化后,所有纳米泡均被击破失去显影,而血液循环带来新的纳米泡在2~3 s 后重新灌注,再次显影,但尚未靶向黏附于血管内皮细胞,故空化后重新显影的为血池中游离纳米泡。因此,纳米泡空化前后增强强度的差值,即靶向黏附值,可用于衡量纳米泡靶向黏附的效果。本研究中RGD 靶向纳米泡靶向黏附值明显高于空白纳米泡,证明RGD靶向纳米泡大大提高了局部造影剂的浓度,明显增强了显影效果,即RGD靶向纳米泡在大鼠2期压力性损伤中具有靶向性,这与损伤局部表达整合素αVβ3有关。既往有学者将RGD靶向阻断剂用于大鼠切口疝[15]、将整合素αVβ3抗体用于下肢静脉溃疡患者[16],将RGD嵌合纤连蛋白用于小鼠慢性伤口[17],发现均有加速愈合的效果。因此,本实验为下一步使用RGD靶向造影剂评估压力性损伤和递送促愈合药物奠定了基础。
综上所述,本研究证明了整合素αVβ3在大鼠2期压力性损伤模型中呈高表达,同时验证了RGD靶向超声造影剂在2 期压力性损伤中良好的靶向效果,有助于为压力性损伤的分期和深度判断提供客观依据。后期有可能在RGD 靶向超声造影剂基础上携载促愈合药物,进而实现压力性损伤的靶向治疗。但整合素αVβ3表达的时间规律和RGD 靶向超声造影剂在其他分期压力性损伤中的评估效果有待进一步研究。
