高速逆流色谱法从小叶金钱草中分离制备三种黄酮苷类化合物
2019-09-11宋道光樊鑫宇徐顺连熊雯豆段向兰
宋道光,樊鑫宇,徐顺连,熊雯豆,段向兰,陈 志
(青海师范大学生命科学学院,青藏高原药用动植物资源重点实验室,青海西宁 810008)
小叶金钱草(HydrocotylesibthorpioidesLam.)为伞形科天胡荽属植物天胡荽[1],是中国传统中药之一,可全草入药,具有抗炎、镇痛、利胆等功效[2]。根据文献报道可知,小叶金钱草含有黄酮类、萜类、甾醇和香豆素类等化学成分,通过柱层析分离手段,能够分离得到黄酮苷类成分[3-4]。黄酮苷成分富含酚羟基结构,因而具有抗氧化、清除自由基等多种重要的药理活性,进而在食品医药等领域应用广泛[5-6]。截至目前,小叶金钱草只作为民间用药,尚未被中国药典收录,因此对小叶金钱草黄酮苷类等化学成分及药理活性的深入研究具有重要意义。
利用传统及现代分离手段可实现复杂天然产物的提取和分离,如硅胶、反相硅胶(ODS)、葡聚糖凝胶(Sephadex LH-20)、大孔吸附树脂和制备性高效液相色谱等。虽然上述诸多方法可以实现许多化合物的分离,但存在所需溶剂多、分离时间长以及对填料不可逆吸附等问题。高速逆流色谱(high speed counter-current chromatography,HSCCC)依据化合物在两相不互溶的溶剂中的分配系数不同,可以实现结构极性相似及复杂天然产物的分离[7]。本研究采用高速逆流色谱分离小叶金钱草中的三种极性较大的黄酮苷类成分,这对于进一步研究小叶金钱草的化学成分及其活性提供分离方法及思路,为以后更好地开发小叶金钱草提供了理论依据。
1 材料与方法
1.1 材料与仪器
小叶金钱草 购于西宁城北百信大药房,经青海师范大学植物学陈志教授鉴定,为伞形科天胡荽属植物天胡荽,HydrocotylesibthorpioidesLam.;葡聚糖凝胶(Sephadex LH-20) 安徽博美生物科技有限公司;氯仿、正己烷、乙酸乙酯、正丁醇、乙醇、乙腈、甲酸(分析纯),高效液相色谱所用的乙腈(色谱纯) 天津市百世化工有限公司;水 二次蒸馏水。
RE.52AA旋转蒸发器 上海亚荣生化仪器厂;真空脱气过滤装置 美国Waters公司;KJ-11030AL型超声波清洗器 深圳市科洁超声科技有限公司;Waters 600高效液相色谱仪 美国Waters公司;Waters 2998 PAD二极管阵列检测器 美国Waters公司;Waters 2707自动进样器 美国Waters公司;HSCCC TBE-300B型高速逆流色谱仪(柱体积300 mL) 中国上海同田生化技术有限公司;N2000双通道色谱工作站 浙江大学智达信息工程有限公司;Bruker-500 MHz NMR(AVANCE III HD)核磁共振仪 瑞士Bruker公司。
1.2 实验方法
1.2.1 小叶金钱草乙酸乙酯提取物及分离样品的制备 将购买的小叶金钱草药材用中药粉碎机粉碎,过40目筛。称取20 kg药材粉末分次置于KJ-11030AL型超声波清洗器中,按液料比10∶1 mL/g,加入70%(V/V)乙醇溶液,于60 ℃超声提取1 h,过滤除去药渣,将20 kg药渣重复提取四次。合并提取液,旋转蒸发得到棕褐色粘稠浸膏。浸膏用蒸馏水混悬,依次用10倍量的石油醚、乙酸乙酯萃取5次。将乙酸乙酯萃取液浓缩得到小叶金钱草乙酸乙酯萃取物,4 ℃避光保存备用。
取50 g乙酸乙酯萃取物,用50 mL甲醇溶解后用0.45 μm滤膜过滤,滤液上样硅胶柱层析(5 cm×150 cm),然后分别用不同比例的氯仿-甲醇(50∶1、25∶1、10∶1、5∶1、2∶1、1∶3)进行洗脱,每梯度各洗脱2柱体积,1/20柱体积为一馏分,10.0 mL/min流速洗脱。收集氯仿-甲醇1∶3洗脱液,旋转蒸发除去溶剂,得到硅胶分离样品。硅胶分离样品用蒸馏水溶解,并过0.45 μm滤膜并上Sephadex LH-20柱,分别用水、10%、20%、30%、40%、50%、75%、100%甲醇洗脱,每个比例洗脱2个柱体积,1/20柱体积为一馏分,1.0 mL/min流速洗脱,收集70%甲醇洗脱组份,旋蒸除去溶剂并于-70 ℃冷冻干燥24 h,得到Sephadex LH-20分离样品。其余甲醇洗脱馏分的化学成分另做研究。
1.2.2 高效液相色谱分析条件 色谱柱:Waters 600 SunFireTMC18柱(4.6 mm×250 mm,5 μm),流动相为乙腈-0.1%甲酸(15~40%乙腈,0~70 min),流速为1.0 mL/min,柱温为25 ℃,检测波长254 nm,进样10 μL分析。高效液相色谱(HPLC-PAD)紫外光谱扫描范围:200~400 nm。
取一定量乙酸乙酯萃取物、硅胶柱分离样品和Sephadex LH-20分离样品,分别用乙腈溶解,经0.45 μm针头过滤器过滤后,进行HPLC分析,色谱峰面积在色谱图中所占比例即为化合物纯度。
1.2.3 高速逆流色谱溶剂系统的选择
1.2.3.1 溶剂系统的确定 参考高速逆流色谱分离黄酮苷类化合物的相关报道选择溶剂系统[8-9],这些溶剂系统都包含正丁醇和水,并添加其他辅助溶剂如乙酸乙酯、正己烷等。按照溶剂极性的不同,配制体积比为1∶2∶2的乙酸乙酯-正丁醇-水,1∶1∶1的正己烷-正丁醇-水和1∶1∶1∶0.1的正己烷-正丁醇-水-冰乙酸系统,考察此三个比例系统对分配系数K的影响。
1.2.3.2 正己烷-正丁醇-水系统比例的确定 按照正己烷-正丁醇-水-冰乙酸的体积比配制溶剂系统,比例依次为:1∶1∶1∶0.1、1∶1.5∶1∶0.1和1∶1.7∶1∶0.1,分别考察正己烷和正丁醇对分配系数K的影响。
1.2.3.3 K值的测定 通过高效液相色谱测定目标化合物在溶剂系统中的分配系数K。K值定义为上相中目标化合物的色谱峰面积(S上)除以下相中目标化合物的色谱峰面积(S下)(K=S上/S下)。筛选K值在0.2~5.0的溶剂系统用于高速逆流色谱。为达到好的分离效果,待分离化合物的分配系数K值应在0.2~5.0之间,且相邻两化合物的分离度(a=K1/K2,K1>K2)应该大于1.5[10]。
1.2.4 高速逆流色谱法分离制备小叶金钱草中的黄酮苷 按比例配制正己烷-正丁醇-水-冰乙酸(1∶1.7∶1∶0.1,V/V/V/V)两相溶剂系统,置于分液漏斗中充分振摇后,在室温下静置过夜。再将上下相进行分离,并超声脱气20 min,上相为固定相(正己烷、正丁醇),下相为流动相(水、冰乙酸)。以20 mL/min的流速将上相泵入主机。待主机中充满上相后,启动主机正相旋转按键FWD,调整主机转速为800 r/min。再以2 mL/min的流速泵入超声脱气后的下相。待流动相流出主机后,平衡数分钟等待基线平稳后,计算固定相保留率(Sf),计算方法为:Sf(%)=[(螺旋管体积-流出固定相体积)/螺旋管体积]×100。
开启TBD 2000检测系统,设置检测波长为254 nm,采集数据。取Sephadex LH-20纯化后的样品100 mg,用20 mL上相溶解,由进样阀上样,记录色谱图,收集各分离组分。
1.2.5 化合物核磁共振波谱表征 通过对已分离化合物进行1H NMR和13C NMR谱图的测定,将化合物1H NMR和13C NMR图谱在MestReNova中处理,并对化学位移进行积分和偶和常数(J)的计算。J的计算方法为:(低场化学位移-高场化学位移)×核磁兆数。1H NMR二重峰、双二重峰(分别表示为d及dd)需计算J值,单峰(s)、三重峰(t)及以上不计算J值。通过与文献化合物报道数据进行1H NMR化学位移及J和13C NMR化学位移比对,结果一致即确定化合物结构,结构式通过ChemBioDraw 14.0画出。
2 结果与讨论
2.1 HPLC分析结果
按照1.2.2方法分析样品:图1(a)为小叶金钱草乙酸乙酯萃取物的HPLC色谱图,小叶金钱草乙酸乙酯萃取物所含化学成分较为复杂,通过硅胶层析分离(图1(b))可知,乙酸乙酯萃取物中的化学成分进一步得到富集。而经Sephadex LH-20纯化后(图1(c)),HPLC色谱峰较少,有利于分配系数摸索及溶剂系统的优化选择。由图1(c)可知,峰1的保留时间为19.331 min,峰2的保留时间为24.427 min,峰3的保留时间为31.683 min。图1(d)、图1(e)和图1(f)分别为峰1、峰2和峰3的紫外光谱,色谱峰在峰带I:300~400 nm及峰带II:220~280 nm有明显紫外吸收,符合黄酮类化合物紫外光谱吸收特征,即峰1、峰2和峰3为黄酮类化合物[12]。通过HPLC对目标组份进行分析,三种化合物均实现了较好的基线分离。
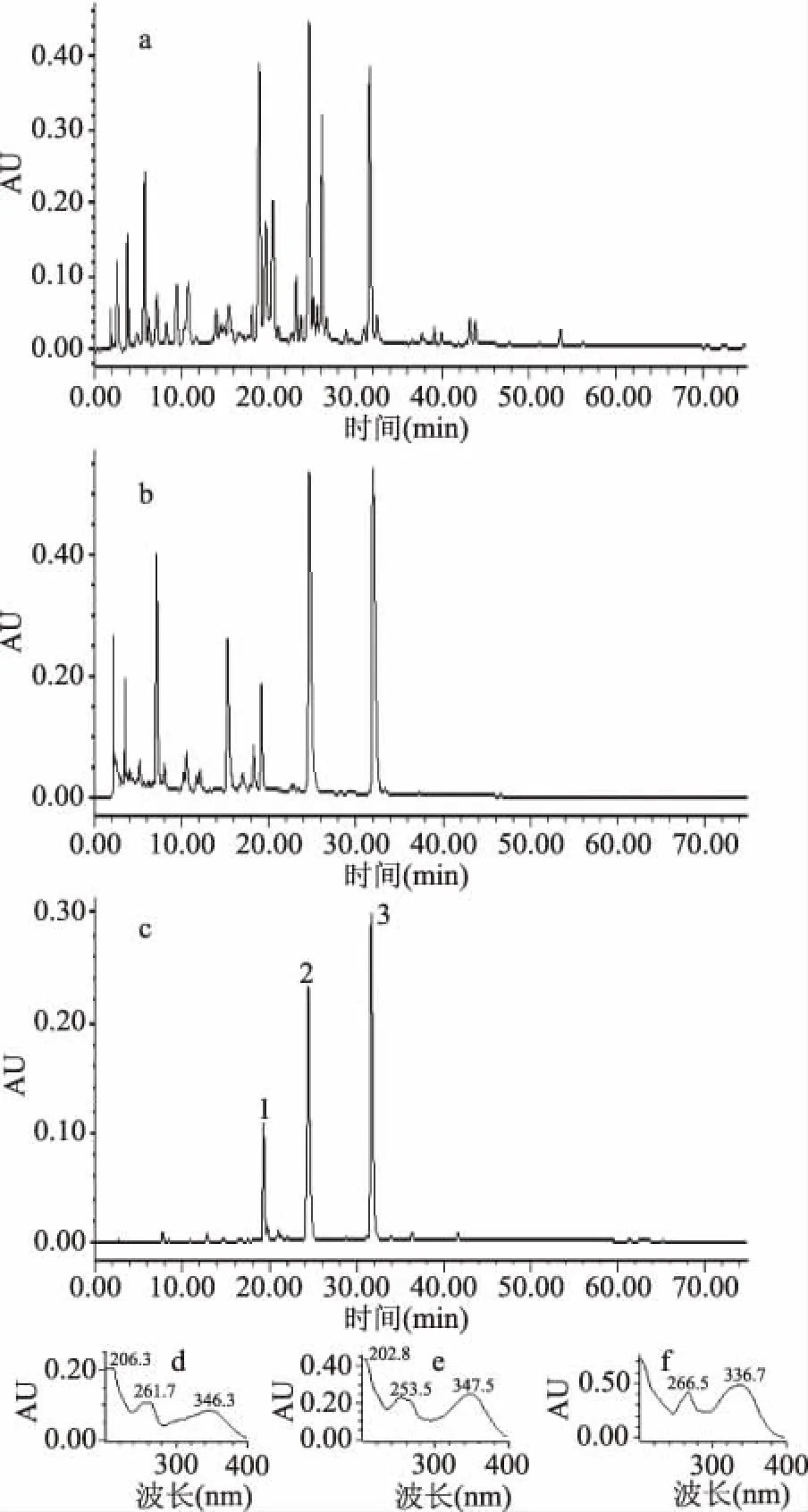
图1 小叶金钱草乙酸乙酯部位(a)、硅胶洗脱组份(b)、 Sephadex LH-20纯化(c)的高效液 相色谱图及峰1(d)、峰2(e)、峰3(f)的紫外光谱Fig.1 HPLC chromatogram of the EtOAc-soluble fractions(a),silica gel eluted fraction(b)and Sephadex LH-20 eluted fraction(c)of Hydrocotyle sibthorpioides Lam. and UV spectrum of peak1(d),2(e)and 3(f)
2.2 HSCCC溶剂系统的优化
通过HSCCC分离天然产物,下列条件非常重要:两相溶剂系统的分配系数适中,即待分离化合物的分配系数位于0.2~5.0之间;两相溶剂分层时间短(一般小于30 s);固定相有较高的保留率。具备上述条件的溶剂系统方能实现好的分离效果[10]。
2.2.1 溶剂系统的确定 HPLC分析得知,分离化合物的极性较大,根据黄酮类化合物的结构特点和文献报道[8-9],本研究选择了HSCCC适合分离大极性物质的正丁醇体系,经HPLC测定了化合物在不同体系中的分配系数,各溶剂体系及相应分配系数K值见表1。

表1 小叶金钱草提取物在不同溶剂体系中的分配系数KTable 1 Partition coefficients(K)of the extract of Hydrocotyle sibthorpioides Lam.in different two phase solvent systems
在初步的试验当中,目标化合物易溶于乙酸乙酯、正丁醇和水。从表1的数据可以看出,不选用乙酸乙酯系统的原因如下:1号和2号溶剂系统乙酸乙酯-正丁醇-水(1∶2∶1、1∶4∶2,V/V/V)分配系数过大,所需分离时间较长;由1.2.3.3可知化合物分离度需大于1.5,而2、3号化合物分离度小于1.5;虽然减小乙酸乙酯的比例可以改善分离度,但乙酸乙酯系统两相分层时间较长,且分离度仍小于正己烷体系。因此1、2、3号溶剂系统不适合作为高速逆流色谱溶剂系统。当用正己烷替换系统中乙酸乙酯后,分配系数大大减小而分离度大大增加。
在正己烷体系当中,物质的分离度较大,但分配系数较小,通过增加正丁醇的比例,可以有效地增加分配系数,与此同时分离度虽有所减小,但仍大于2。Chen T等[11]报道了在溶剂体系当中添加酸可以改善物质的分离程度,因此在4号系统中添加冰乙酸来改善物质的分离,进一步探索正己烷-正丁醇-水-冰乙酸溶剂比例。
2.2.2 正己烷-正丁醇-水-冰乙酸比例的确定 由表1中(3、4号)可以发现,添加冰乙酸虽然对目标物的分离度几乎没有影响,但却有效地增加了目标化合物的分配系数。由表2可以看出,当增加正丁醇比例时,分配系数增加,分离度减小。在表2的2号溶剂比例下,3号化合物分配系数达到3。因分配系数越大,所需分离时间越长,色谱峰拖尾严重,所需流动相越多,因此继续增加正丁醇比例意义不大。综上所述,通过调节正丁醇的比例,并添加冰乙酸辅助调节分配系数,能够在保证物质的最大分离度的前提下,尽可能地缩短分离时间,节约溶剂,最终选择正己烷-正丁醇-水-冰乙酸(1∶1.7∶1∶0.1,V/V/V/V)两相溶剂系统分离目标化合物。

表2 小叶金钱草提取物在正己烷-正丁醇-水-冰乙酸溶剂体系中的分配系数 KTable 2 Partition coefficients(K)of the extract of Hydrocotyle sibthorpioides Lam. in n-hexane/n-BuOH/water/glacial acetic acidsolvent systems
2.3 HSCCC分离结果
采用溶剂系统正己烷-正丁醇-水-冰乙酸(1∶1.7∶1∶0.1,V/V/V/V),参照1.2.4中固定相保留率计算方法,Sf=[(300-112)]/300×100%=62.7%。按照1.2.4 的方法对1.2.1中得到的Sephadex LH-20纯化样品进行高速逆流色谱分离,得到4个分离组分,见图2。
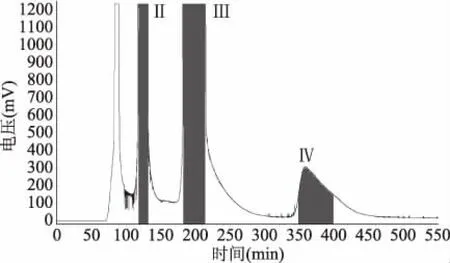
图2 小叶金钱草乙酸Sephadex LH-20 分离样品的高速逆流色谱图Fig.2 HSCCC chromatogram of the Sephadex LH-20 purified sample from EtOAc-soluble fractions of Hydrocotyle sibthorpioides Lam.
收集图2中的各组分进行HPLC分析。峰Ⅱ-Ⅳ样品HPLC分析结果见图3,其中峰Ⅱ图3(a)、Ⅲ图3(b)、Ⅳ图3(c)为目标化合物,分别对应图1(c)中的1、2和3号化合物。保留时间和纯度分别为:峰Ⅱ-1号,Rt=19.331 min,94.08%;峰Ⅲ-2号,Rt=24.427 min,97.82%;峰Ⅳ-3号,Rt=31.4683 min,92.98%。各色谱图中小图对应各色谱峰的紫外吸收光谱,由紫外光谱分析得知,色谱峰紫外吸收在峰带Ⅰ,300~400 nm及峰带Ⅱ,220~280 nm有明显紫外吸收,符合黄酮类化合物紫外光谱吸收特征[12],故所分离得到的三种化合物为黄酮类化合物。
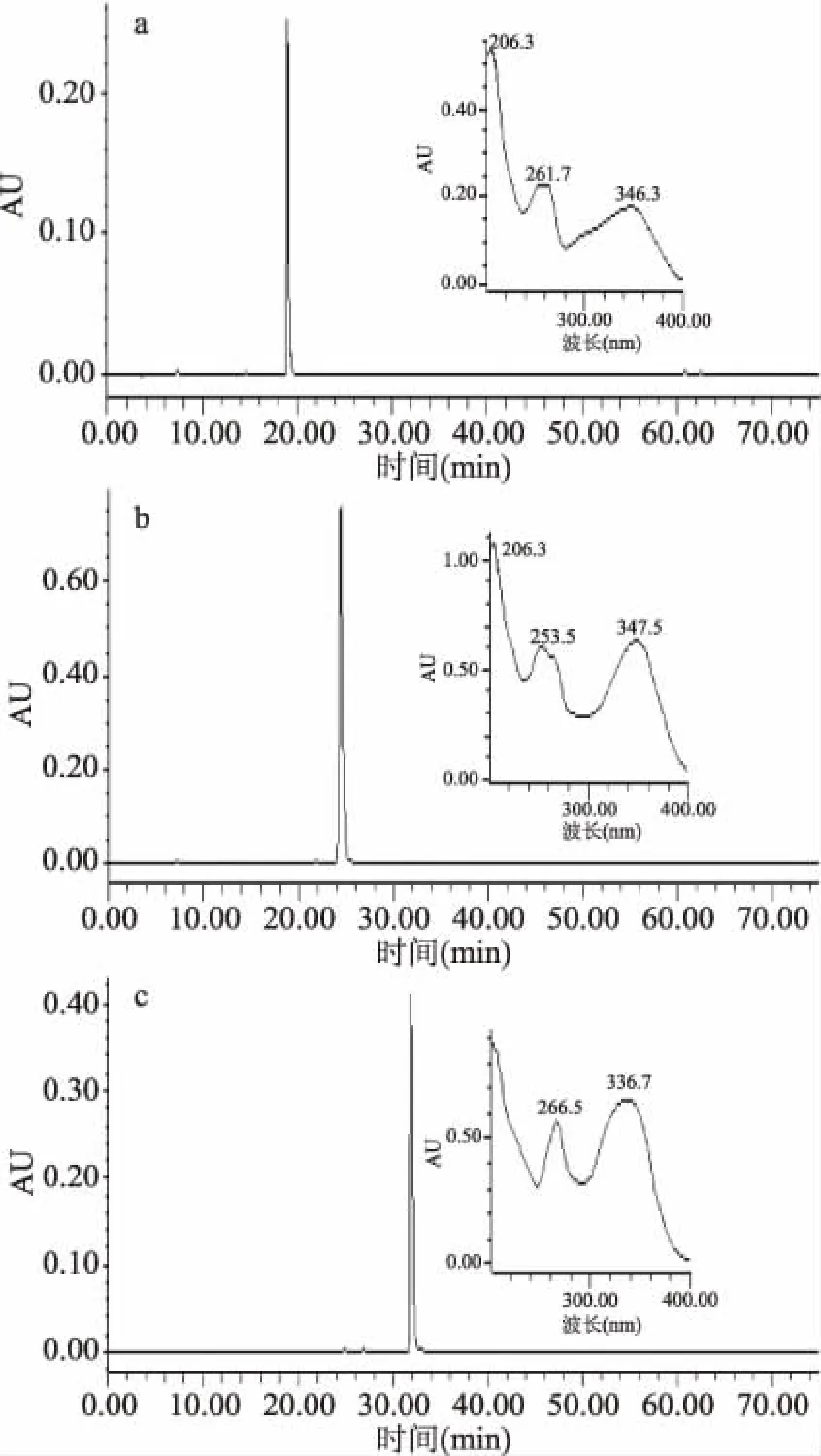
图3 峰Ⅱ(a)、Ⅲ(b)、Ⅳ(c)组分的 HPLC色谱图Fig.3 HPLC chromatogram of effluent fraction Ⅱ(a),Ⅲ(b)and Ⅳ(c)
2.4 结构表征
所分离得到化合物冷冻干燥后称重得峰Ⅱ(1号)化合物9.23 mg,峰Ⅱ(2号)化合物8.98 mg和峰Ⅲ(3号)化合物22.93 mg。经1H NMR和13C NMR鉴定为峰II:杨梅素 3,3′-二-α-L-鼠李糖苷(化合物1)、峰Ⅲ:木犀草素-7-O-β-D-葡萄糖醛酸苷(化合物2)和峰Ⅳ:芹菜素-7-O-β-D-葡萄糖醛酸苷(化合物3),其结构式见图4。
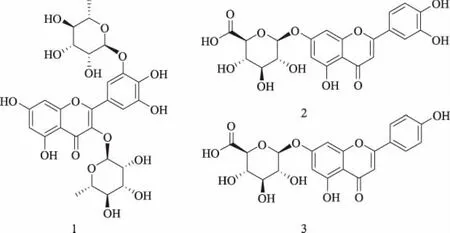
图4 杨梅素 3,3′-二-α-L-鼠李糖苷(化合物1)、木犀草素-7-O-β-D-葡萄糖醛酸苷
化合物1的1H NMR和13C NMR数据如下:1H NMR(DMSO-d6,500 MHz,ppm):δ 12.64(1H,s,5-OH),10.91(1H,s,7-OH),9.53(1H,s,5′-OH),9.19(1H,s,4′-OH),7.11(1H,d,J=1.9 Hz,2′-H),7.10(1H,d,J=1.9 Hz,6′-H),6.37(1H,d,J=1.9 Hz,8-H),6.21(1H,d,J=1.9 Hz,6-H),5.23(1H,s,3-rha-1-H),5.21(1H,s,3′-rha-1-H),3.49~3.96(4H,m,3-rha-2,3,4,5),3.13~3.96(4H,m,3′-rha-2,3,4,5),1.17(3H,d,J=6.2 Hz,3′-rha-CH3),0.83(3H,d,J=6.2 Hz,3-rha-CH3);13C-NMR(DMSO-d6,125 MHz,ppm):δ 178.3(C-4),164.9(C-7),161.8(C-5),157.9(C-9),156.9(C-2),146.5(C-3′),145.4(C-5′),111.6(C-2′),139.4(C-4′),134.7(C-3),120.1(C-1′),110.7(C-6′),104.6(C-10),102.3(C-1″),101.1(C-1‴),99.2(C-6),94.0(C-8),72.4(C-4″),71.7(C-4‴),71.1(C-3″),70.9(C-2″),70.9(C-3‴),70.8(C-2″),70.6(C-2‴),70.4(C-5″),70.0(C-5‴),18.4(C-6‴),17.9(C-6″)。根据已报道文献比对[13],化合物1为杨梅素 3,3′-二-α-L-鼠李糖苷(Myricetin 3,3 ′-di-α-L-rhamnopyranoside)。
化合物2的1H NMR和13C NMR数据如下:1H NMR(DMSO-d6,500 MHz,ppm):δ 13.00(1H,s,5-OH),9.99(1H,brs,4′-OH),9.44(1H,brs,3′-OH),7.45(1H,dd,J=2.1 Hz,8.4 Hz,6′-H),7.43(1H,d,J=2.1 Hz,2′-H),6.91(1H,d,J=8.25 Hz,5′-H),6.81(1H,d,J=2.0 Hz,8-H),6.76(1H,s,3-H),6.46(1H,d,J=2.0 Hz,6-H),5.27(1H,d,J=7.3 Hz,glc-1),3.08~4.02(4H,m,Glu A-2,3,4,5);13C-NMR(DMSO-d6,125 MHz,ppm):δ 182.4(C-4),170.8(C-6″),164.9(C-2),163.0(C-7),161.6(C-5),157.4(C-9),150.4(C-3′),146.3(C-4′),121.8(C-1′),119.6(C-6′),116.5(C-5′),114.0(C-2′),105.9(C-10),103.6(C-3),99.9(C-1″),99.7(C-6),95.0(C-8),76.2(C-5″),75.7(C-3″),73.3(C-2″),71.8(C-4″);根据已报道文献比对[14],化合物2为木犀草素-7-O-β-D-葡萄糖醛酸苷(Luteolin 7-O-β-D-glucuronide)。
化合物3的1H NMR和13C NMR数据如下:1H NMR(DMSO-d6,500 MHz,ppm):δ 12.98(1H,s,5-OH),10.47(1H,brs,4′-OH),7.95(2H,d,J=8.5 Hz,2′,6′-H),6.95(2H,d,J=8.5 Hz,3′,5′-H),6.86(1H,s,3-H),6.86(1H,d,J=1.7 Hz,8-H),6.46(1H,d,J=1.7 Hz,6-H),5.25(1H,d,J=7.3 Hz,Glu A-1),3.29~3.99(4H,m,glc-2,3,4,5);13C-NMR(DMSO-d6,125 MHz,ppm):δ 182.4(C-4),171.1(C-6″),164.8(C-2),163.1(C-7),161.9(C-5),161.6(C-4′),157.4(C-9),129.1(C-2′,6′),121.4(C-1′),116.5(C-3′,5′),105.9(C-10),103.3(C-3),99.8(C-6),99.7(C-1″),95.1(C-8),76.3(C-5″),75.6(C-3″),73.3(C-2″),71.9(C-4″);根据已报道文献比对[15],化合物3为芹菜素-7-O-β-D-葡萄糖醛酸苷(Apigenin 7-O-β-D-glucuronide)。
3 结论
本文建立了从小叶金钱草分离纯化极性较大黄酮苷类化合物的HSCCC分离方法,应用高速逆流色谱法正己烷-正丁醇-水-冰乙酸(1∶1.7∶1∶0.1,v/v/v/v)两相溶剂系统,在转速800 r/min、流速2 mL/min的条件下,从小叶金钱草中分离制备了三种黄酮苷类化合物:杨梅素3,3′-二-α-L-鼠李糖苷,木犀草素-7-O-β-D-葡萄糖醛酸苷和芹菜素-7-O-β-D-葡萄糖醛酸苷,纯度均高于90%,为进一步研究小叶金钱草的化学成分、药效以及综合利用奠定了一定的理论基础。
