平菇高丝氨酸乙酰基转移酶基因的克隆及异源表达优化
2019-09-11左泽红郭丽琼林俊芳张中浩
左泽红,魏 韬,郭丽琼,*,林俊芳,*,张中浩
(1.华南农业大学食品学院生物工程系,广东广州 510640; 2.广东省微生态制剂工程技术研究中心,广东广州 510640)
蛋氨酸,又称甲硫氨酸,是人和动物体内唯一的含硫必需氨基酸,在动物饲料[1-2]、食品和医药[3]等领域被广泛应用。蛋氨酸原材料的获得方法主要有化学合成法[4]、微生物发酵法[5-8]和酶法。其中,酶法合成以高丝氨酸为原料,通过高丝氨酸乙酰基转移酶(homoserine acetyltransferase,HTA)乙酰化为O-乙酰高丝氨酸,再经过直接硫化或者转硫化途径最终生成蛋氨酸[9](见图1)。该法操作简单,绿色安全,是目前最具有应用前景的生产方式。而HTA作为该法中的第一个酶,对蛋氨酸的合成至关重要。

图1 蛋氨酸生物合成途经Fig.1 Methionine biosynthesis pathway注:CGS:胱硫醚c-合成酶;CBL:胱硫醚b-裂解酶; OAHS:邻乙酰转移酶硫氢化酶;MS:蛋氨酸合成酶。
HTA属于α/β水解酶超家族[10],自1967年首次从真菌中发现HTA以来[11],已发现近90种来源于不同属的HTA。目前已发现的HTA主要来源于枯草芽孢杆菌(Bacillussubtilis)、蜡状芽孢杆菌(Bacilluscereus)、铜绿假单胞菌(Pseudomonasaeruginosa)、结核分枝杆菌(Mycobacteriumtuberculosis)、流感嗜血菌(Haemophilusinfluenzae)、钩端螺旋体(Leptospirainterrogans)、金黄色葡萄球菌(Staphylococcusaureus)、酿酒酵母(Saccharomycescerevisiae)和裂殖酵母(Schizosaccharomycespombe)等[12-14],而在食用菌中尚未见报道。平菇(Pleurotusostreatus)是一种常见的灰色食用菇。根据已公布的P.ostreatusPC15基因组注释结果,其基因组可能含有编码HTA的基因,可作为蛋氨酸酶法合成的备选基因。
为研究不同来源HTA在蛋氨酸酶法合成中的情况,国内外多个研究小组进行了不同角度的尝试。1987年,Yamagata[15]研究了一株野生型和六株甲硫氨酸营养缺陷型酿酒酵母的HTA,其中,4株缺陷型菌株的细胞提取物中显示出了酶活性,分别为24.7、1.52、20.3及7.22 mU/mg。刘琳[16]以pET-22b(+)为表达载体,将来源于钩端螺旋体的hta基因在大肠杆菌BL21中表达,其酶活为0.033 U/mg。后来,Thangavelu等[17]以pDEST42为表达载体,将来源于金黄色葡萄球菌的hta基因在大肠杆菌BL21中表达,并对其酶学性质进行了测定,高丝氨酸和乙酰辅酶A的Kcat/Km分别为3×10、4×105M-1S-1。其中,大肠杆菌表达系统是目前应用最为广泛的蛋白酶表达系统[18],具有遗传背景清晰、生长迅速、表达高效、待选质粒和宿主多等优点[19]。但是,该系统也存在一定的缺点和局限性,如二硫键形成能力较弱[20]、缺乏真核细胞蛋白翻译后的修饰系统[21-22]、表达的异源蛋白经常以不溶且无催化活性的包涵体形式存在等。故而,探究重组蛋白在大肠杆菌中的有效可溶性表达具有较高的学术价值和应用前景。为减少包涵体、提高外源蛋白的可溶性表达量,一般有宏观和微观两种解决方式,宏观上,通过对诱导条件进行优化以提高蛋白酶的可溶性表达[23];微观上,通过寻找合适的表达载体和表达宿主来提高外源蛋白的有效可溶性表达。
针对大肠杆菌表达系统的优势及提高外源蛋白有效可溶性表达的解决办法,本研究以台湾白平菌丝球总RNA为模板,通过反转录PCR克隆获得了hta基因,并利用网上在线工具分析了该基因及其蛋白质序列,再以pET-32a(+)为表达载体,将重组质粒pET32a-hta在大肠杆菌BL21(DE3)中成功实现表达,为了提高可溶性HTA蛋白在大肠杆菌的表达水平,对异丙基硫-β-半乳糖苷(IPTG)终浓度、诱导温度和诱导时间进行了优化,同时,也探究了不同表达载体、宿主对HTA比活力的影响,以期为进一步大规模生产蛋氨酸打下基础。
1 材料与方法
1.1 材料与仪器
平菇菌种(台湾白平) 江苏省高邮市科学食用菌研究所;克隆载体pMDTM18-T Takara;表达载体pET32a(+) 中山大学生命科学学院刘玉焕教授赠送;表达载体pET22b(+) 艾瑞生物技术有限公司;大肠杆菌DH5a、BL21(DE3)、Rosetta(DE3)、Origami B(DE3)、Rosetta gami(DE3)plysS 上海唯地生物技术有限公司;Ex Taq酶、2×PCR Mix酶 东盛生物科技有限公司;限制性内切酶EcoR I、Sal I、T4 DNA连接酶 赛默飞世尔科技有限公司;HP Fungal RNA Kit 飞扬生物工程有限公司;琼脂糖凝胶DNA回收试剂盒、质粒小量快速抽提试剂盒 美基生物科技有限公司;TransScript one-Step gDNA Removal and cDNA Synthesis superMix反转录试剂盒 北京全式金生物技术有限公司;Bradford Protein Assay Kit Takara;Super-Pref PAGE Gel(12%,15well)蛋白胶 广州纽新生物科技有限公司。
5804R高速冷冻离心机 德国Eppendorf公司;ZS-RSD3台式恒温振荡器 上海旻泉仪器有限公司;SKJH-1109超净工作台 上海苏坤有限公司;ETC811基因扩增仪 东盛兴业科学仪器有限公司;EPS-300核酸电泳仪 上海天能科技有限公司;Basic 041BR蛋白质电泳仪、GelDoCTMXR+凝胶快速成像系统 美国Bio-Rad公司;LC-2030高效液相色谱仪 日本岛津公司。
1.2 实验方法
1.2.1 高丝氨酸乙酰基转移酶基因hta的克隆 根据已报道的P.ostreatusPC15中的hta基因(Genbank登录号:KDQ30216.1)的核苷酸序列,利用软件Primer5设计PCR扩增引物,其中上游引物为HTA-F:5′-ATGGCGGCTTTCGCAAATCTCAT-3′,下游引物为HTA-R:5′-TTACCATCTTGTGATATCGACC TCCGC-3′。采用Fungal RNA Kit试剂盒提取平菇菌丝球总RNA,采用反转录试剂盒合成cDNA的第一链,以cDNA的第一链为模版进行PCR扩增,反应体系为:1 μL 模版,上、下游引物各2 μL,5 μL 10×Ex Taq Buffer,4 μL dNTP Mixture,0.25 μL Ex taq,加ddH2O至50 μL。反应条件为:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸81 s,30个循环,72 ℃再延伸5 min。PCR产物回收后与克隆载体pMDTM18-T于4 ℃连接过夜,连接产物转化大肠杆菌DH5a感受态细胞,经菌落PCR验证后,将结果呈阳性的克隆子送往广州天一辉远生物技术有限公司测序。

表1 质粒的多克隆位点、抗生素抗性及诱导剂分析Table 1 Analysis of multiple cloning sites,antibiotic resistance and inducer of plasmid
1.2.2 高丝氨酸乙酰基转移酶hta基因序列分析 使用网上在线软件ExPAS-ProtParam tool、Protscale、PSIPRED、SWISS-MODEL分析hta基因编码氨基酸序列的理化性质、亲疏水性、二级结构和三级结构。
1.2.3hta基因表达载体的构建 以阳性克隆子测序正确的重组克隆质粒pMD18-T-hta为模版,在上、下游引物的5′端分别加上酶切位点EcoRI和SalI进行PCR扩增,回收获得的PCR产物与空载体pET32a分别用限制性内切酶EcoR I 和Sal I进行双酶切,回收目的基因及载体DNA片段后用T4 DNA 连接酶连接,连接产物转化大肠杆菌BL21(DE3)感受态细胞,经菌落PCR及测序验证后,获得含有重组表达载体(pET32a-hta)的重组大肠杆菌(BL21/pET32a-hta)。
1.2.4 重组菌的hta基因诱导表达及其产物的SDS-PAGE分析 将重组大肠杆菌(BL21/pET32a-hta)接种于10 mL LB液体培养基(含100 μg/mL Amp+)中,37 ℃,200 r/min过夜培养;以1%的接种量将1 mL活化后的菌液接种于100 mL LB(含100 μg/mL Amp+)液体培养基中,37 ℃、200 r/min培养至OD600值为0.6,加入终浓度为0.5 mmol/L的IPTG,16 ℃、120 r/min诱导表达16 h。发酵液于4 ℃、4000 r/min离心收集菌体,用10 mL的PBS(pH7.4)重悬菌体,冰浴超声破碎(300 W,工作时间3 s,间歇时间3 s,全程时间5 min)后,4 ℃、8000 r/min离心10 min,收集上清,沉淀溶于等量的PBS(pH7.4)中,上清液、沉淀液分别取样进行SDS-PAGE电泳,待电泳结束后将蛋白胶用考马斯亮蓝染色液染色30 min,再换脱色液过夜脱色至胶块上出现清晰条带,用GelDoCTMXR+凝胶快速成像系统拍照,根据蛋白电泳条带粗步分析HTA蛋白的表达情况。
1.2.5 重组菌的hta基因诱导表达条件的优化 为了探究重组酶的最优表达条件,按1.2.4的方法分别对诱导温度、IPTG终浓度、诱导时间进行优化,根据SDS-PAGE电泳条带粗步分析HTA蛋白的表达情况,以期得到最适的表达条件。
1.2.5.1 诱导温度对重组蛋白表达的影响 设置IPTG终浓度为0.5 mmol/L,分别在温度37、30、25、20、16 ℃下诱导表达16 h。
1.2.5.2 IPTG终浓度对重组蛋白表达的影响 设置IPTG终浓度分别为0.2、0.4、0.6、0.8、1.0、1.2 mmol/L,在25 ℃下诱导表达16 h。
1.2.5.3 诱导时间对重组蛋白表达的影响 设置IPTG终浓度为0.2 mmol/L,在25 ℃下分别诱导4、8、12、14、16、20、24 h。
1.2.6 HTA酶活鉴定 将重组大肠杆菌(BL21/pET32a-hta)在最适条件下诱导表达,并按1.2.4中的方法收集菌体,超声破碎离心后的上清液即为粗酶液,采用Protein Assay Kit试剂盒测定粗酶液中蛋白浓度。HTA酶活力单位1U为37 ℃、pH7.5的条件下,每分钟转化acetyl-CoA生成1 μmol CoA所需的酶量。重组酶HTA反应体系(600 μL)为:100 mmol/L磷酸钾(pH7.5),25%蔗糖,0.13 mmol/L乙酰辅酶A(acetyl-CoA),10 mmol/L高丝氨酸,80 μL粗酶液,37 ℃孵育30 min;其中,阴性对照设置为不含酶只含底物的反应体系。HPLC条件为:WondaSil® C18Superb色谱柱(5 μm,4.6 mm×250 mm),流动相为磷酸盐缓冲液(pH7.0)∶甲醇=(90∶10),检测波长为259 nm,流速为1 mL/min,柱温为30 ℃,进样量为20 μL。在该液相条件下对CoA标品制作标准曲线,采用面积外标法对样品进行定量分析,并根据样品中CoA的产量计算其比活力。
1.2.7 重组菌的hta基因诱导表达系统的优化 为了探究重组酶的最适表达体系,选取了pET32a、pET22b 两个表达载体,Rosetta(DE3)、Origami B(DE3)、Rosetta gami(DE3)plysS 三个表达宿主,组合了6组体系(Rosetta/pET32a-hta、Origami B/pET32a-hta、Rosetta gami plysS/pET32a-hta、Rosetta/pET22b-hta、Origami B/pET22b-hta、Rosetta gami plysS/pET22b-hta),以BL21/pET32a-hta为参照,在IPTG终浓度为0.2 mmol/L、温度为25 ℃的条件下诱导表达16 h,按1.2.6的方法将上清粗酶液进行反应后,采用HPLC测定CoA浓度并计算比活力,以期得到最适的表达系统。
1.3 数据处理
使用Excel软件进行数据处理和图形的制作。
2 结果与分析
2.1 高丝氨酸乙酰基转移酶hta基因的克隆
以HTA-F/HTA-R为引物,使用RT-PCR法从平菇中扩增hta基因片段,经1%的琼脂糖凝胶电泳检测,获得一条约为1338 bp的亮带,与预期条带大小一致(见图2)。将回收的PCR产物与pMD18-T载体连接转化后,随机挑取LB(Amp+)固体培养基上长出的单菌落进行菌落PCR验证,阳性克隆子测序后经DNAMAN软件进行核苷酸序列比对,结果与NCBI已上传的P.ostreatusPC15基因组中的hta基因(GenBank登录号:KDQ30216.1)DNA序列一致性为100%,说明已成功克隆hta基因。

图2 平菇cDNA的RT-PCR扩增hta基因Fig.2 RT-PCR amplification of hta gene注:M:DNA Marker3;1、2:hta基因。
2.2 高丝氨酸乙酰基转移酶hta基因功能预测分析
通过ExPAS-ProtParam tool对hta基因所编码的蛋白质进行理化分析,得到hta基因所编码蛋白大小为49 kDa,由445个氨基组成,等电点pI 5.93。利用NCBI-Conserved Domains Search database进行保守结构序列分析,结果显示HTA属于α/β水解酶超家族,结构域序列号为c126325,结构域匹配E值为3.07e-161。利用Signal P 3.0对该氨基酸序列进行信号肽预测,结果表明并不存在信号肽特征。使用protscale在线分析氨基酸序列亲疏水性结果如图3所示。图3中,正值越大,表示越疏水,负值越大,表示越亲水,介于+0.5和-0.5的为两性氨基酸,可知HTA的前后两端无明显的亲疏水性,中间部分亲水。如图4为PSIPRED分析HTA的二级结构结果。由图4可知,该氨基酸序列主要由无规则卷曲、螺旋和延伸链组成。利用SWISS-MODEL预测蛋白质的三级结构,结果如图5所示。由图5可知,该蛋白具有明显的空间结构且主要由螺旋和无规则卷曲组成,这与PSIPRED的分析预测结果一致。

图3 氨基酸序列亲疏水性分析Fig.3 The hydrophilicity and hydrophobicity analysis of the amino acid sequence

图4 HTA的二级结构分析Fig.4 The secondary structure analysis of HTA

图5 高丝氨酸乙酰基转移酶三级结构图Fig.5 The tertiary structure of HTA
2.3 重组菌的hta基因诱导表达及其产物的SDS-PAGE分析
将构建好的表达载体pET32a-hta转化BL21(DE3)鉴定后,按1.2.4中的方法进行诱导表达,收集菌体溶于10 mL的PBS(pH7.4)中,超声破碎释放细胞中的蛋白,破碎液离心后可溶性蛋白主要存在于上清液中,而包涵体因其不可溶性主要聚集在沉淀中,将沉淀溶于等量的PBS(pH7.4)后,上清液、沉淀液分别取样进行SDS-PAGE分析,结果如图6所示。由图6可以看出,在68.7 kDa(49 kDa+载体自带蛋白19.7 kDa)处有清晰条带,但主要存在于菌体破碎后的沉淀中,说明HTA重组蛋白在大肠杆菌中成功得到了表达,并且表达的蛋白只有少量以可溶性形式存在,而大部分重组蛋白仍以包涵体形式存在。

图6 表达产物的SDS-PAGE分析Fig.6 SDS-PAGE analysis of expression products注:M:蛋白Marker,图7~图9同; 箭头标注处为HTA重组蛋白。
2.4 重组菌的hta基因诱导表达条件的优化
2.4.1 诱导温度的优化 工程菌BL21/pET32a-hta在不同温度下诱导表达产物的SDS-PAGE结果如图7所示。由图7可知,当温度为25 ℃及以上温度时,可溶性HTA蛋白的表达量相对较高;在16、20 ℃时,可溶性HTA蛋白的表达量相对较低。可能是因为温度过低,菌体生长慢,外源蛋白表达速度低,从而导致最终重组蛋白中可溶性表达量减少。一般认为温度越高,蛋白表达越快[24],积累的蛋白多肽来不及正确折叠,而易形成无活性的包涵体;而较低的诱导温度有利于重组蛋白折叠形成正确的结构,提高外源蛋白的可溶性,因此,在后续实验中,选取25 ℃作为最适诱导温度。
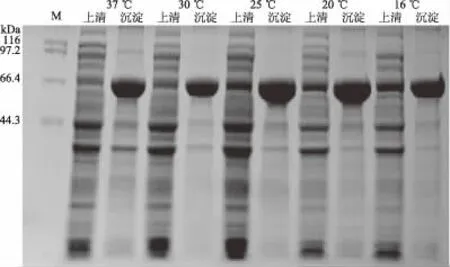
图7 不同诱导温度对HTA蛋白表达的影响Fig.7 Effects of different induction temperatures on HTA expression
2.4.2 IPTG浓度的优化 工程菌BL21/pET32a-hta在不同IPTG终浓度下诱导表达产物的SDS-PAGE结果如图8所示。由图8可知,当IPTG终浓度为0.2、0.4 mmol/L时,上清液中可溶性HTA蛋白的表达量相对较高,再增加IPTG浓度,可溶性HTA蛋白的表达量不再增加,反倒有下降趋势。IPTG是乳糖类似物,少量的IPTG即能诱导乳糖操纵子,浓度过高会对菌体产生毒害作用[25],影响细胞的生长状态,从而影响可溶性蛋白的表达量。因此,在后续实验中,选取IPTG终浓度为0.2 mmol/L作为最适诱导剂浓度。
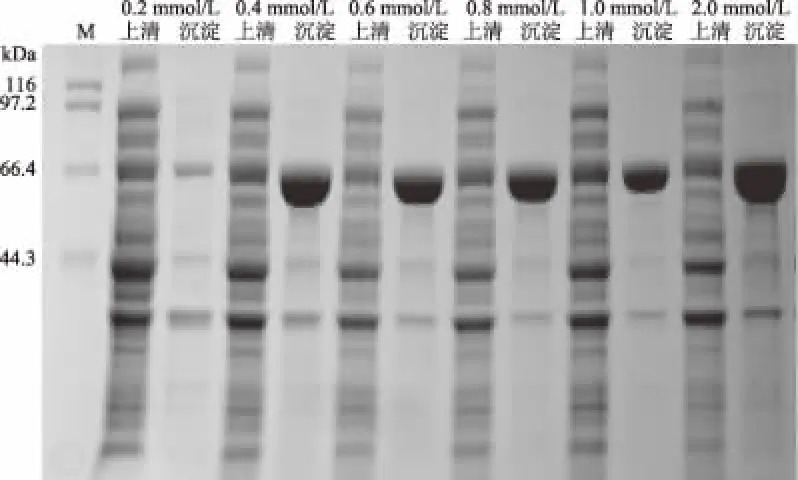
图8 不同IPTG浓度对HTA蛋白表达的影响Fig.8 Effect of different IPTG concentrations on HTA expression
2.4.3 诱导时间的优化 工程菌BL21/pET32a-hta在不同诱导时间下诱导表达产物的SDS-PAGE结果如图9所示。由图9可知,随着诱导时间的增加,可溶性HTA蛋白的表达量有上升的趋势,而在16 h以后,可溶性HTA蛋白的表达量增加并不明显。因此,为考虑时间成本,在后续实验中,选取诱导时间为16 h作为最适诱导时间。
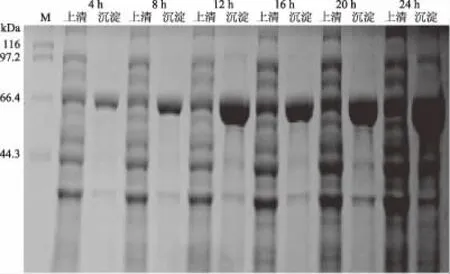
图9 不同诱导时间对HTA蛋白表达的影响Fig.9 Effects of different induction time on HTA expression
2.5 HTA酶活鉴定
HTA能够催化高丝氨酸和acetyl-CoA发生反应生成O-乙酰高丝氨酸和CoA,本实验通过检验产物CoA的生产来鉴定酶活性。HPLC结果如图10所示。图10a中显示CoA标准品的出峰时间为8.357 min;图10b中确未见到有洗脱峰的出现,说明没有酶的存在,产物不会生成;10c中反应体系反应后出现洗脱峰时间为8.359 min 左右,出峰时间与标准品CoA 基本一致,所以HPLC结果初步证明HTA具有转移乙酰基活性,按1.2.6中的方法计算得到其比活力为1.6 mU/mg。
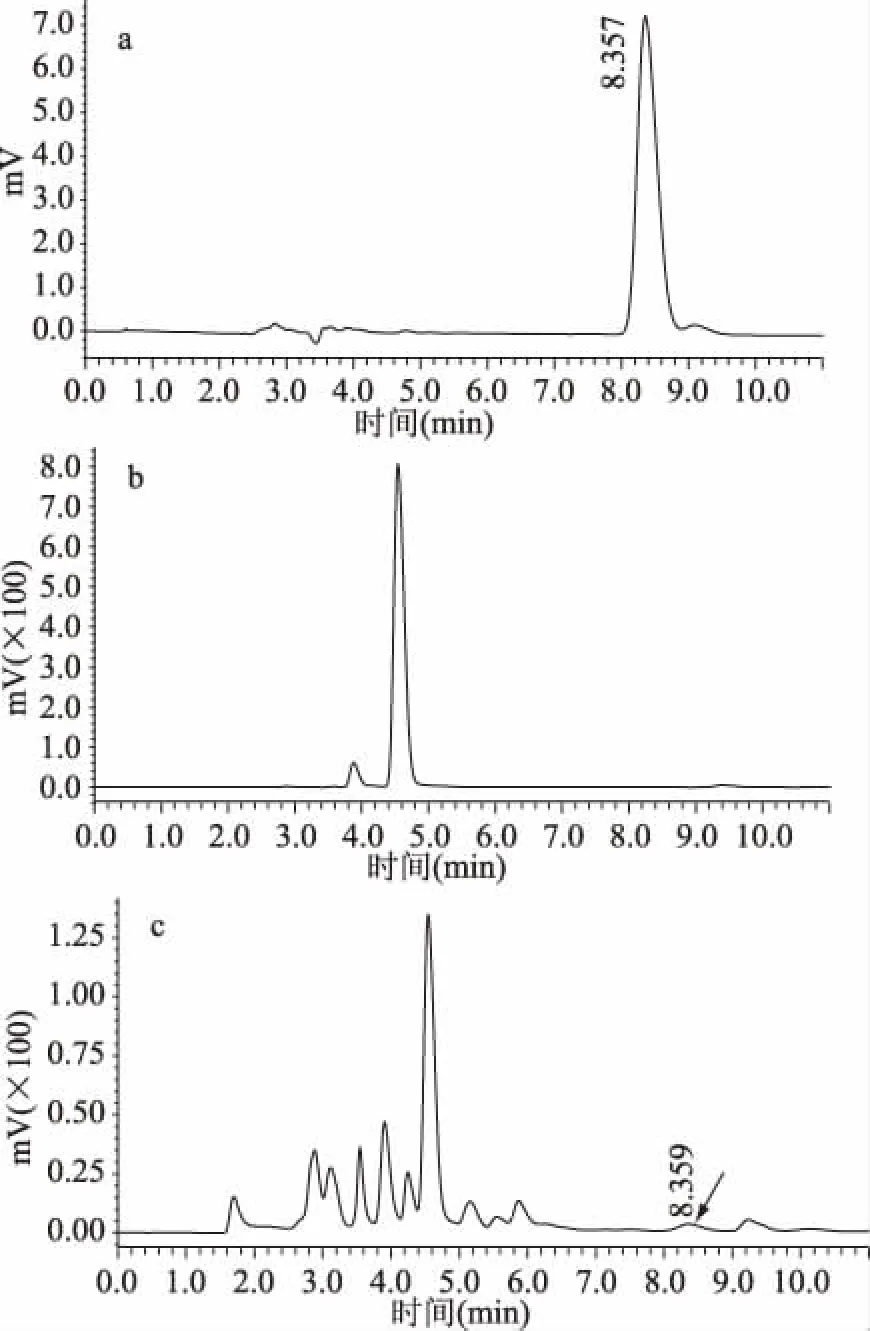
图10 HPLC检测结果Fig.10 HPLC test results注:a:CoA标准品;b:不添加酶的阴性对照; c:添加酶液的反应体系;箭头标注处为目标产物峰。
2.6 表达系统的优化
7株工程菌诱导表达产物的SDS-PAGE结果如图11所示。由图11可知,当表达载体为pET32a时,在68.7 kDa(49 kDa+载体自带蛋白19.7 kDa)处有清晰条带;当表达载体为pET22b时,在51 kDa(49 kDa+载体自带蛋白5 kDa)处有条带,说明重组蛋白均成功得到表达。将7组表达体系诱导表达的可溶性HTA蛋白进行酶活检测,结果如图12所示。由图12可知,当表达载体为pET32a-hta,表达宿主为Rosetta时,工程菌Rosetta/pET32a-hta诱导表达的HTA比活力最高,其最高比活力为2.2 mU/mg。
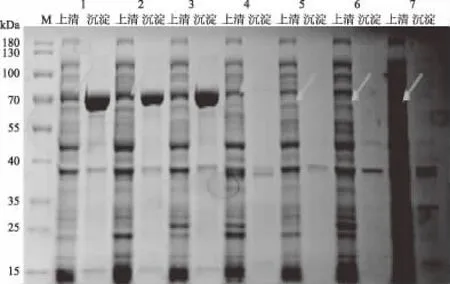
图11 不同表达体系HTA蛋白表达情况Fig.11 Expression of HTA in different expression systems

图12 不同表达体系HTA比活力Fig.12 Specific activity of HTA in different expression systems注:1:BL21/pET32a-hta;2:Rosetta/pET32a-hta; 3:Origami B/pET32a-hta;4:Rosetta gami plysS/pET32a-hta; 5:Rosetta/pET22b-hta;6:Origami B/pET22b-hta; 7:Rosetta gami plysS/pET22b-hta。
3 讨论与结论
包涵体是大肠杆菌高效表达重组蛋白时由于错误的折叠形成的蛋白质多聚体,并无生物活性,故而,探究重组蛋白在大肠杆菌中有效的可溶性表达具有较高的学术价值和广泛的应用前景,但是蛋白质的种类纷繁复杂,理化性质各不相同,目前无法得到一个可以提高可溶性表达的通用方法,因而,针对不同的基因必须要对诱导条件进行优化,才能获得最大程度的可溶性表达。本研究中,对hta基因的诱导条件进行了优化,结果表明:当IPTG终浓度为0.2 mmol/L,诱导温度为25 ℃,诱导时间为16 h时,可溶性蛋白的表达量最高。
pET32a和pET22b属于pET系列表达载体,是在原核生物中用来表达目的蛋白常用的表达载体,在T7 噬菌体启动子和宿主菌提供的T7 RNA聚合酶的作用下能进行转录和翻译,其中pET22b是pET系统中的分泌型表达载体,它主要靠载体上的pelB信号肽分泌目的蛋白到细胞周质中,而pET32a载体则是在细胞质中将重组蛋白进行表达。本实验中,当选用pET22b载体时,可溶性蛋白的比活力相对较低,可能是因为通过超声破碎法并未能将细胞周质空间的重组蛋白完全释放出来,另外本研究也采用渗透压休克法对表达载体为pET22b的工程菌进行周质蛋白提取,得到结果也并不理想。因此,当通过超声破碎法释放目的蛋白时,为获得高比活力的可溶性蛋白,应选取pET32a表达载体。
不同的宿主菌对蛋白的可溶性表达也具有一定影响,当异源目的基因的mRNA在大肠杆菌中过表达时,tRNA的数量直接反映了mRNA的密码子偏倚性,不充足的tRNA库可能导致翻译延迟、成熟前翻译终止、翻译移码和氨基酸错配,最终导致外源蛋白的活性丧失,而本研究所采用的表达宿主Rosetta(DE3)菌株能够补充大肠杆菌缺乏的6种稀有密码子(AUA、AGG、AGA、CUA、CCC、GGA)对应的tRNA,提高外源基因尤其是真核基因在原核系统中的表达水平。此外,由于大肠杆菌的细胞质呈还原环境,致使重组蛋白无法折叠形成正确二硫键,因此构建促进二硫键形成的宿主不失为一种提高蛋白可溶表达的途径,而本研究所采用的表达宿主Origami B(DE3)菌株包含突变的硫氧还蛋白还原酶和谷胱甘肽还原酶基因,表达主要还原途径的两个关键酶,有利于形成正确折叠的含有二硫键的蛋白。表达宿主Rosetta gami(DE3)pLysS赋予其Rosetta(DE3)和Origami B(DE3)的优点,本研究中当表达宿主为Rosetta gami(DE3)pLysS时虽然解决了包涵体的问题,但可溶性蛋白的含量和比活力却降低了,可能是因为该菌株携带的pLysS质粒含有表达T7溶菌酶的基因,降低了目的基因的背景表达水平。Rosetta(DE3)、Origami B(DE3)及Rosetta gami(DE3)pLysS菌株均有自己独特的优势提高外源蛋白的可溶性表达,具体选择哪一种菌株还要视情况而定。当以酶活力为参考依据,本研究中选用表达宿主Rosetta(DE3)时,工程菌Rosetta/pET32a-hta诱导表达的HTA蛋白比活力最高,为2.2 mU/mg。
