赤苍藤茎叶水提物抗痛风作用的实验研究
2019-09-10许崇摇韦贵云朱丹王璐琪周秋妹蒋伟哲
许崇摇 韦贵云 朱丹 王璐琪 周秋妹 蒋伟哲

摘 要 目的:研究赤苍藤茎叶水提物(ASLE)的抗痛风作用。方法:取小鼠随机分为正常组、模型组、别嘌醇组(阳性对照,5 mg/kg)和ASLE低、中、高剂量组(1 300、2 600、5 200 mg/kg,按生药量计;下同),每组10只。除正常组外,其余各组小鼠均灌胃氧嗪酸钾以复制高尿酸血症模型;造模1 h后,正常组和模型组小鼠均灌胃等体积生理盐水,各给药组小鼠灌胃相应药物,每日1次,连续7 d。末次给药后1 h,采用酶比色法检测各组小鼠血尿酸(SUA)、血肌酐(Scr)水平。另取小鼠随机分为正常组、模型组、吲哚美辛组(阳性对照,7.5 mg/kg)和ASLE低、中、高剂量组,每组10只。正常组和模型组小鼠均灌胃等体积生理盐水,各给药组小鼠灌胃相应药物,每日1次,连续7 d。末次给药后,除正常组外,其余各组小鼠均于足趾部注射微晶尿酸钠以复制痛风性关节炎模型。分别于造模前及造模后1、2、4、6、8 h时采用缚线法测量各组小鼠致炎肢足趾同一部位周径,并计算足趾肿胀度;使用动物血液分析仪检测其白细胞(WBC)、中性粒细胞(NEU)和淋巴细胞(LYM)计数;采用酶比色法检测血清SUA、Scr水平;采用Griess法检测足趾组织中一氧化氮(NO)的含量。结果:高尿酸血症模型实验结果显示,模型组小鼠血清SUA、Scr水平均较正常组显著升高(P<0.01);与模型组比较,各给药组小鼠上述指标均显著降低(P<0.05或P<0.01)。痛风性关节炎模型实验结果显示,模型组小鼠血清SUA水平,足趾肿胀度(2~8 h),WBC、NEU、LYM计数以及NO含量均较正常组显著升高(P<0.05或P<0.01);与模型组比较,不同给药组小鼠SUA、Scr水平(ASLE各剂量组),足趾肿胀度[吲哚美辛组和ASLE高劑量组(2~8 h)、ASLE低剂量组(2、6 h)、ASLE中剂量组(6 h)],WBC和NEU计数(各给药组),LYM计数(吲哚美辛组)以及NO含量(除ASLE低剂量组外的各给药组)均显著降低(P<0.05或P<0.01)。结论:ASLE的抗痛风作用可能与促进尿酸代谢、抗炎以及保护或改善肾功能等有关。
关键词 赤苍藤;茎叶;水提物;痛风;高尿酸血症;痛风性关节炎;小鼠
ABSTRACT OBJECTIVE: To study the anti-gout effect of aqueous extract from the stems and leaves of Erythropalum scandens (ASLE). METHODS: The mice were randomly divided into normal group, model group, allopurinol group (positive control, 5 mg/kg), ASLE low-dose, medium-dose and high-dose groups (1 300, 2 600, 5 200 mg/kg, by raw material; similarity hereinafter), with 10 mice in each group. Except for normal group, other groups were given potassium oxonate intragastrically to induce hyperuricemia model. One hour after modeling, normal group and model group were given constant volume of normal saline intragastrically; administration group was given relevant medicine intragastrically, once a day, for consecutive 7 d. One hour after last administration, the levels of serum uric acid (SUA) and serum creatinine (Scr) were detected by colorimetry assay. Another mice were randomly divided into normal group, model group, indomethacin group (positive control, 7.5 mg/kg), ASLE low-dose, medium-dose and high-dose groups, with 10 mice in each group. Normal group and model group were given constant volume of normal saline intragastrically; administration group was given relevant medicine intragastrically, once a day, for consecutive 7 d. After last administration, except for normal group, the mice were given sodium microcrystalline urate via toes to induce gouty arthritis model. Before and 1, 2, 4, 6, 8 h after modeling, the circumference of the same part of the inflamed limbs and toes of mice in each group was measured by wire binding method, and the degree of toe swelling was calculated. The number of white blood cell (WBC), neutrophil (NEU) and lymphocyte (LYM) were detected by animal hematology analyzer. The levels of SUA and Scr were measured by colorimetry assay. The content of NO in toe tissue was determined by Griess method. RESULTS: The experimental results of hyperuricemia model showed that the levels of SUA and Scr in mice were significantly higher in model group than those in normal group (P<0.01). Compared with model group, above indexes of mice were decreased significantly in administration group (P<0.05 or P<0.01). The experimental results of gouty arthritis model showed that the level of SUA, the degree of toe swelling (2-8 h), the number of WBC, NEU and LYM, NO content in model group were increased significantly, compared with normal group (P<0.05 or P<0.01). Compared with model group, the levels of SUA and Scr (ASLE groups), the degree of toe swelling [indomethacin group, ASLE high-dose group (2-8 h), ASLE low-dose group (2, 6 h), ASLE medium-dose group (6 h)], the number of WBC and NEU (administration groups), the number of LYM (indomethacin group) and NO content (administration groups except for ASLE low-dose group) were decreased significantly in administration groups (P<0.05 or P<0.01). CONCLUSIONS: The anti-gout effect of ASLE may be associated with promoting uric acid metabolism, anti-inflammatory and improving renal function.
KEYWORDS Erythropalum scandens; Stems and leaves; Aqueous extract; Gout; Hyperuricemia; Gouty arthritis; Mice
尿酸产生过多或者尿酸排泄受阻是引发高尿酸血症的关键因素,而高尿酸血症则是痛风发生的重要生理生化基础[1-2]。若血尿酸(SUA)水平持续升高,尿酸盐结晶在关节腔或软组织中沉积,则可引发红、肿、热、痛等痛风性关节炎现象,且常伴有肥胖、高血脂症、糖尿病、高血压以及心脑血管疾病等内源性并发症[3-4]。目前,临床上常用的化学治疗药物包括减少尿酸生成和促进尿酸排泄类药物(如别嘌醇、非布司他、苯溴马隆等)以及止痛抗炎类药物(如布洛芬、吲哚美辛、秋水仙碱、激素类等),但上述药物毒副作用明显,长期使用可导致胃肠或肝肾等损害[5]。因此,高效低毒的中药类抗痛风药物具有重要的开发价值。
赤苍藤(Erythropalum scandens Bl.)为铁青树科多年生常绿大型木质藤本植物,别名牛耳藤、蚂蟥藤、十丈藤、龙须藤等,主要分布于我国云南、广西、广东、贵州等地,在东南亚各国也有分布,其性平、味微苦,具有清热利湿、祛风活血等功效[6-7]。同时,其嫩芽也是一种可食用的野生蔬菜,具有较高的食用价值[8-9]。近年来,该植物的活性成分及其抗痛风作用受到学者的日益关注,冯旭等[10]对赤苍藤叶挥发油化学成分进行了分析,共鉴定出36种成分;黄元河等[11]对其藤茎进行了初步研究,发现其醇提物的急性毒性较低,并可改善小鼠的高尿酸血症,但具体作用活性成分尚不明确。目前,关于赤苍藤茎叶抗痛风作用的研究报道较少,且大多数研究者只利用了其藤茎和嫩芽部位,而其余茎叶部位则被丢弃。鉴于该部位可能含有与其藤茎等部位相似的成分,同时从合理利用药用资源的角度出发,本课题组参考民间使用赤苍藤水煎剂防治痛风的实践经验[6-7],利用氧嗪酸钾灌胃复制高尿酸血症小鼠模型,利用微晶型尿酸钠(MSU)注射复制痛风性关节炎小鼠模型[1-2],通过检测相应指标的变化,初步评价赤苍藤茎叶水提物(ASLE)的抗痛风作用,旨在为该药材的综合开发利用提供实验依据。
1 材料
1.1 仪器
7100型全自动生化分析仪(日本Hitachi公司);EL204型万分之一电子天平[梅特勒-托利多仪器(上海)有限公司];202-4型电热恒温干燥箱(上海跃进医疗器械有限公司);XT-2000iv型动物血液分析仪(日本Sysmex公司);MR22i型低温高速离心机(法国Jouan公司);Spectra Max Plus 384型连续光谱扫描式酶标仪(美国Molecular Devices公司);CD-UPH-Ⅱ-20L型超纯水器(成都越纯科技有限公司)。
1.2 药材、药品与试剂
赤苍藤茎叶药材由广西柏朗健康产业发展有限公司提供(批号:20160311,产地:广西崇左市大新县),经广西医科大学药学院朱丹副教授鉴定为铁青树科赤苍藤(E. scandens Bl.)的部分茎段和叶子。将药材除杂、洗净,干燥后粉碎,备用。
吲哚美辛肠溶片(阳性对照,山西云鹏制药有限公司,批号:20160513,规格:25 mg);别嘌醇片(阳性对照,广东彼得药业有限公司,批号:20140502,规格:0.1 g);氧嗪酸钾(山东西亚化学工业有限公司,批号:O3054,純度:99%);MSU(上海恒斐生物科技有限公司,批号:RQ3589R476,纯度:99%);氯化钠注射液(生理盐水,辰欣药业股份有限公司,批号:1609070725,规格:500 mL ∶ 4.5 g);一氧化氮(NO)试剂盒(碧云天生物技术研究所,批号:S0021);SUA、血肌酐(Scr)测定试剂盒(南京建成生物工程研究所,批号分别为20161103、20160725);其余试剂均为分析纯,水为超纯水。
1.3 动物
SPF级昆明种小鼠,雄性,体质量(25±2)g,由广西医科大学实验动物中心提供,动物使用许可证:SYXK桂2014-0003。
2 方法
2.1 溶液的配制
2.1.1 ASLE灌胃液 取赤苍藤茎叶粉末500 g,用8倍量水(g/mL)煎煮2次,每次1.5 h,合并2次提取液,减压浓缩,冷冻干燥,即得ASLE(每100 g药材得ASLE 5.324 5 g)。临用前,用生理盐水适量进行稀释。
2.1.2 氧嗪酸钾混悬液 取氧嗪酸钾适量,研磨成细粉,用生理盐水制成质量浓度为25 mg/mL的混悬液,备用。
2.1.3 MSU混悬液 取MSU 50 mg,经常规高温高压(121 ℃,0.115 MPa)灭菌30 min后,用生理盐水制成浓度为2.5%的混悬液,于4 ℃冰箱中保存,用前摇匀。
2.1.4 吲哚美辛混悬液 取吲哚美辛肠溶片适量,研磨成细粉,用生理盐水制成质量浓度为1 mg/mL的混悬液,备用。
2.1.5 别嘌醇混悬液 取别嘌醇片适量,研磨成细粉,用生理盐水制成质量浓度为0.5 mg/mL的混悬液,备用。
2.2 氧嗪酸钾致小鼠高尿酸血症模型实验
取小鼠60只,适应性喂养1周后,按体质量分层并随机分为6组,分别为正常组、模型组、别嘌醇组(阳性对照,5 mg/kg;剂量参考文献[12]和本课题组前期预实验结果)以及ASLE低、中、高剂量组[1 300、2 600、5 200 mg/kg,按生药量计;剂量参考民间用法(成人口服生药量20~30 g/d)和本课题组前期预实验结果,并按体表面积法换算而得],每组10只。正常组小鼠灌胃等体积生理盐水,其余各组小鼠均灌胃氧嗪酸钾混悬液(250 mg/kg,每日1次,连续7 d)以复制高尿酸症模型。每日灌胃氧嗪酸钾1 h后,正常组和模型组小鼠灌胃等体积生理盐水,各给药组小鼠灌胃相应药物,每日1次,连续7 d(末次给药前需禁食、不禁水12 h)。末次给药后1 h,于小鼠眼球采血适量,室温自然凝血2 h后,于4 ℃下以3 500 r/min离心10 min,分离上层血清,采用酶比色法以全自动生化分析仪检测各组小鼠血清SUA、Scr水平,严格按照相应试剂盒说明书操作。
2.3 MSU致小鼠痛风性关节炎模型实验
取小鼠60只,适应性喂养1周后,按体质量分层并随机分为6组,分别为正常组、模型组、吲哚美辛组(阳性对照,7.5 mg/kg;剂量参考文献[13]和本课题组前期预实验结果)以及ASLE低、中、高剂量组(1 300、2 600、5 200 mg/kg,按生药量计;剂量设置依据同“2.2”项),每组10只。正常组和模型组小鼠均灌胃等体积生理盐水,各给药组小鼠灌胃相应药物,每日1次,连续7 d。造模前用缚线法测量小鼠右足跖周径,并记录。末次给药后,正常组外,其余各组小鼠均于右后足趾部用医用酒精局部消毒,将0.1 mL MSU混悬液注入关节腔以复制痛风性关节炎模型,正常组小鼠于相同位置注射0.1 mL无菌生理盐水。分别于造模后1、2、4、6、8 h采用缚线法测量致炎肢足趾同一部位周径,计算足趾肿胀度。足趾肿胀度(mm)=致炎后足趾周径-给药前足趾周径。测量完成后,于小鼠眼球取血0.5 mL,置于乙二胺四乙酸(EDTA)抗凝管中,使用动物血液分析仪检测各组小鼠白细胞(WBC)、中性粒细胞(NEU)和淋巴细胞(LYM)计数;参照“2.2”项下方法采血1 mL,分离血清,并同法检测其血清SUA、Scr水平。采血后处死各组小鼠,以医用酒精消毒后,迅速于致炎关节处剪下足部,剥皮剪碎,于-20 ℃冰箱中保存。取受试关节周围软组织适量,称定质量,按质量比1 ∶ 9加入4 ℃生理盐水稀释,制成10%组织匀浆,于4 ℃下以3 500 r/min离心10 min,取上清液,采用Griess法以连续光谱扫描式酶标仪检测小鼠关节组织中NO的含量,严格按照相应试剂盒说明书操作。
2.4 统计学方法
采用SPSS 13.0软件对数据进行统计分析。计量资料均以x±s表示,组间比较采用t检验。P<0.05表示差异有统计学意义。
3 结果
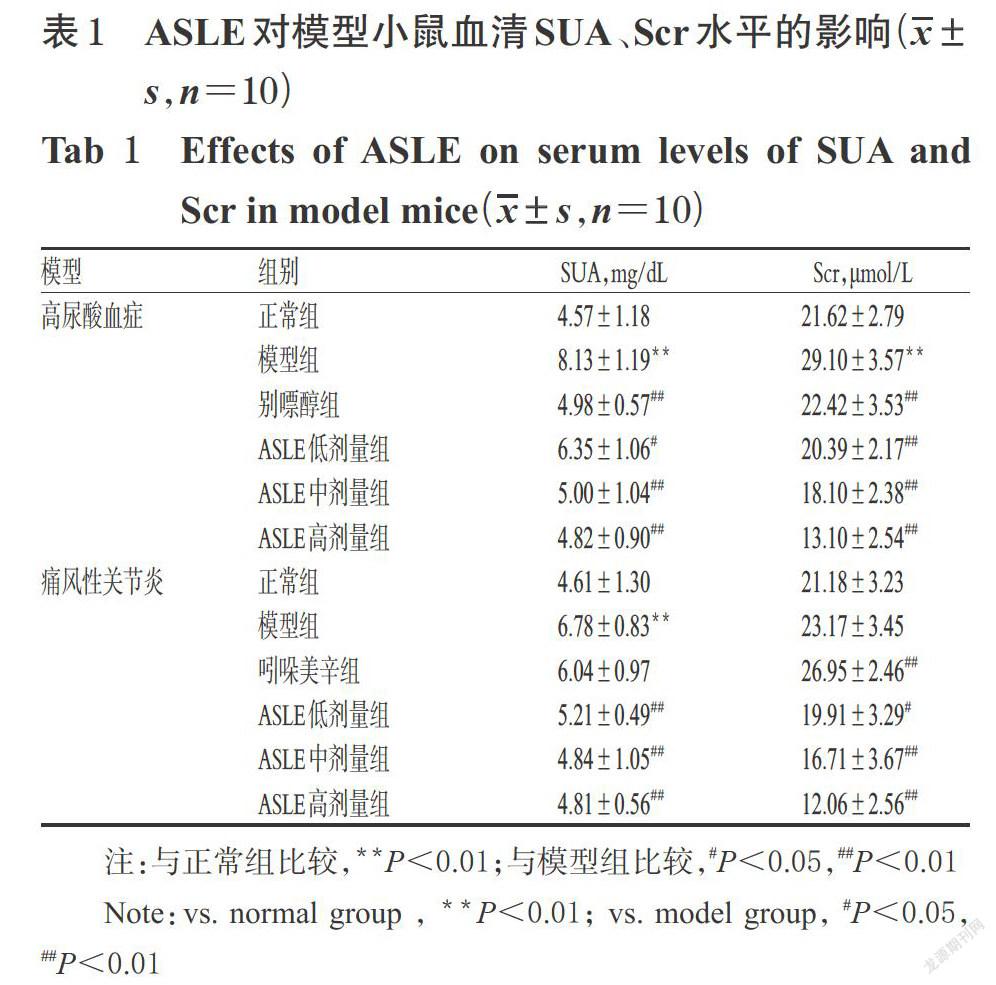
3.1 ASLE对模型小鼠血清SUA、Scr水平的影响
高尿酸血症模型实验结果显示,与正常组比较,模型组小鼠血清SUA、Scr水平均显著升高(P<0.01);与模型组比较,各给药组小鼠上述指标均显著降低(P<0.05或P<0.01)。痛风性关节炎模型实验结果显示,与正常组比较,模型组小鼠血清SUA水平显著升高(P<0.01);与模型组比较,ASLE各剂量组小鼠血清SUA、Scr水平均显著降低,吲哚美辛组小鼠血清Scr水平显著升高(P<0.05或P<0.01),详见表1。
3.2 ASLE对痛风性关节炎模型小鼠足趾肿胀度的影响
与正常组比较,模型组造模后2~8 h时小鼠足趾肿胀度均显著升高(P<0.01),其中6 h时小鼠足趾肿胀最为明显(测量值最大);与模型组比较,吲哚美辛组和ASLE高剂量组造模后2~8 h,ASLE低剂量组造模后2、6 h,ASLE中剂量组造模后6 h时小鼠足跖肿胀度均显著降低(P<0.05或P<0.01),详见表2。
3.3 ASLE对痛风性关节炎模型小鼠WBC、NEU、LYM计数的影响
与正常组比较,模型组小鼠WBC、NEU、LYM计数均显著升高(P<0.05或P<0.01);与模型组比较,各给药组小鼠WBC、NEU计数以及吲哚美辛组小鼠LYM计数均显著降低(P<0.05或P<0.01),详见表3。
3.4 ASLE对痛风性关节炎模型小鼠足趾组织中NO含量的影响
与正常组比较,模型组小鼠足趾组织中NO含量显著升高(P<0.01);与模型组比较,吲哚美辛组和ASLE中、高剂量组小鼠足趾组织中NO含量均显著降低(P<0.05或P<0.01),详见表3。
4 讨论
赤苍藤为多年生大型藤本植物,在广西崇左、百色等地已有多年的使用历史。赤苍藤嫩芽作为蔬菜食用后常排出具有明显臭味的排泄物,因此也被称為“排毒菜”[8-9]。民间用药实践显示,经常食用其嫩芽或藤茎等的水煎液能预防或减轻痛风的发生,具有清热、利尿、利湿等功效[6-7]。目前,对该植物的相关研究比较少,其药理物质基础与活性部位均尚不明确。为此,本研究根据其民间用药习俗,初步考察了ASLE对痛风疾病模型动物相关指标的影响。
痛风的发病机制较为复杂,且由于人体缺乏尿酸酶,故目前尚无理想的痛风疾病动物模型,因此研究者常应用多种模型相结合的方式,从多个角度来考察受试药物的作用及其可能机制[1]。氧嗪酸钾能抑制尿酸酶,使尿酸不能被催化氧化为尿囊酸排出体外,从而造成体内尿酸水平升高;MSU可通过直接注入关节腔而诱发实验动物急性痛风性关节炎[2]。上述两种痛风疾病造模方法简便,是用以评价受试药物抗痛风作用的常用模型。
SUA水平长期异常升高所致的高尿酸血症是痛风发病的重要生理生化基础[1-2];MSU在关节组织中沉积、析出,从而诱发炎症反应,引起炎症介质释放、氧化应激增加、大量氧自由基(如NO)生成增多,导致相应组织损伤,Scr水平升高,WBC、NEU、LYM等细胞聚积,促使关节等出现红肿、疼痛等症状,最终导致痛风性关节炎、痛风石、关节畸形及肾功能受损等疾病的发生与发展[3-4]。由此可见,上述因子和细胞均在高尿酸血症和痛风的发生、发展中发挥了重要的作用,因此检测上述指标可一定程度地反映体内相关疾病的发生和进展情况[14-15]。别嘌醇可抑制体内的嘌呤氧化酶,减少尿酸的生成,临床上常用于高尿酸血症的治疗;吲哚美辛等非甾体抗炎药,虽对SUA的影响不明显,但在通过减轻炎症反应和炎症损伤来缓解关节炎症状等方面的效果较为理想[13,16]。因此,本研究选择上述两种药物作为相应实验的阳性对照,以SUA、Scr、WBC、NO等作为考察指标,初步评价了ASLE对模型小鼠的保护作用。
本研究结果显示,高尿酸血症模型组小鼠的SUA、Scr水平和痛风性关节炎模型组小鼠的SUA水平均较正常组显著升高,痛风性关节炎模型组小鼠的足跖肿胀度(2~8 h),WBC、NEU、LYM计数以及足趾组织中NO含量均较正常组显著升高。这提示氧嗪酸钾、MSU可导致小鼠相应指标的变化,模型复制成功。经药物干预后,不同给药组小鼠SUA、Scr水平(ASLE各剂量组),足趾肿胀度[吲哚美辛组和ASLE高剂量组(2~8 h)、ASLE低剂量组(2、6 h)、ASLE中剂量组(6 h)],WBC和NEU计数(各给药组),LYM计数(吲哚美辛组)以及NO含量(除ASLE低剂量组外的其余各给药组)均较模型组显著降低。这提示ASLE可不同程度地降低氧嗪酸钾和MSU所引起的SUA、Scr水平升高,改善MSU所引起的小鼠足趾肿胀,降低WBC、NEU计数和足趾组织中NO含量,且通过促进尿酸代谢、抗炎、抗氧化等途径来发挥对小鼠肾功能的保护作用[17],可成为预防和治疗痛风的一个新选择。本研究结果还显示,吲哚美辛组小鼠Scr水平较模型组显著升高,而对SUA水平无显著影响,提示吲哚美辛可能会对肾功能造成损伤,与已有文献的结果[18]基本一致。此外,ASLE对痛风性关节炎模型小鼠LYM计数的改善作用可能不及阳性对照药物,但具体机制有待后续研究继续探讨。
综上所述,ASLE的抗痛风作用可能与促进尿酸代谢、抗炎以及保护或改善肾功能等有关,但其具体的物质基础和作用机制还有待进一步研究。
参考文献
[ 1 ] 何宏明,冯育林,张武岗,等.不同方法建立高尿酸血症动物模型研究进展[J].江西中医药,2015,46(12):72-75.
[ 2 ] 时乐,徐立.痛风性关节炎动物模型的研究现状与展望[J].中国实验动物学报,2006,14(1):71-74.
[ 3 ] KEENAN RT,PILLINGER MH. Hyperuricemia,gout,and cardiovascular disease:an important “muddle”[J]. Bull NYU Hos Jt Dis,2009,67(3):285-290.
[ 4 ] 高丽娟,傅晓英.高尿酸血症与代谢综合征及其各组分关系的研究进展[J].新医学,2011,42(4):276-278.
[ 5 ] 陈光亮,周媛凤,张颖.治疗痛风和高尿酸血症药物研究进展[J].中国临床药理学与治疗学,2017,22(1):104- 109.
[ 6 ] 中国科学院中国植物志编辑委员会.中国植物志:第二十四卷[M].北京:科学出版社,1988:46.
[ 7 ] 何顺志,徐文芬.贵州中草药资源研究[M].贵阳:贵州科技出版社,2007:236.
[ 8 ] 钟业聪.两种野生木本蔬菜[J].植物雜志,1990(4):13.
[ 9 ] 隆卫革,黎素平,安家成,等.森林蔬菜赤苍藤营养分析与评价[J].食品研究与开发,2017,38(24):124-127.
[10] 冯旭,李耀华,梁臣艳,等.赤苍藤叶挥发油化学成分分析[J].时珍国医国药,2014,25(6):1338-1339.
[11] 黄元河,黎星星,潘乔丹,等.赤苍藤醇提物的急性毒性及对小鼠高尿酸血症的影响[J].中国民族民间医药,2017,26(5):52-54.
[12] 缪明星,王星,陆琰,等.芹菜素对氧嗪酸钾盐致高尿酸血症小鼠的降尿酸及肾保护作用机制研究[J].中国药房,2016,27(34):4794-4797.
[13] 那莎,段陈方圆,王璐,等.牛膝总皂苷对大鼠急性痛风性关节炎的防治作用及机制研究[J].中国临床药理学与治疗学,2017,22(9):966-971.
[14] 李迎春,徐建华.急性痛风性关节炎的发病机制及研究进展[J].安徽医学,2013,34(1):96-98.
[15] SÁNCHEZ-LOZADA,LAURA G,NAKAGAWA T,et al. Hormonal and cytokine effects of uric acid[J]. Curr Opin Nephrol Hypertens,2006,15(1):30-33.
[16] TAUSCHE AK,RICHTER K,GRÄSSLER A,et al. Severe gouty arthritis refractory to anti-inflammatory drugs:treatment with anti-tumour necrosis factor α as a new the- rapeutic option[J]. Ann Rheum Dis,2004,63(10):1351- 1352.
[17] 潘乔丹,黄元河,唐海燕,等.赤苍藤和密蒙花多糖的含量测定及抗氧化研究[J].食品研究与开发,2016,37(22):6-9.
[18] 陈志高,屈伟. 35例吲哚美辛栓不良反应的文献分析[J]. 中国新药杂志,2018,27(1):115-118.
(收稿日期:2019-03-27 修回日期:2019-08-15)
(编辑:张元媛)
