贵长猕猴桃软腐病病原菌分离鉴定及其植物源杀菌剂室内筛选
2019-09-10石金巧龙友华黎晓茜莫飞旭冉飞黄亚欣
石金巧 龙友华 黎晓茜 莫飞旭 冉飞 黄亚欣

摘 要:【目的】明确贵长猕猴桃软腐病致病病原菌,筛选具有防控作用的綠色植物源杀菌剂,为猕猴桃软腐病的绿色防控提供科学依据。【方法】采用组织分离法分离、纯化并结合回接试验确定病原菌。通过形态学和分子生物学对病原进行鉴定,并采用菌丝生长速率法测定6种植物源杀菌剂对病原菌的毒力。【结果】分离获得的8株有效菌株中RF2和RF2-4可引发软腐病,将该菌株的rDNA-ITS序列在NCBI上进行BLAST比对,菌株RF2和RF2-4分别与葡萄座腔菌Botryosphaeria dothidea、拟茎点霉菌Phomopsis sp.同源性达100% 和99%,结合RF2和RF2-4病原菌形态特征分析,明确两株致病菌为葡萄座腔菌B. dothidea、拟茎点霉菌Phomopsis sp.。0.5%苦参碱AS对葡萄座腔菌B. dothidea和拟茎点霉菌Phomopsis sp.的EC50分别为0.442 mg·L-1和0.322 mg·L-1,0.3%丁子香酚SL的EC50则分别为0.680 mg·L-1和0.301 mg·L-1,两者毒力均高于其他植物源杀菌剂。【结论】引起贵长猕猴桃软腐病的病原菌为葡萄座腔菌B. dothidea和拟茎点霉菌Phomopsis sp.;0.5%苦参碱AS和0.3%丁子香酚SL对葡萄座腔菌B. dothidea和拟茎点霉菌Phomopsis sp.菌丝生长具有较强的抑制作用,该研究结果可为贵长猕猴桃软腐病的田间药剂防治提供筛选依据。
关键词:猕猴桃;软腐病;植物源杀菌剂;毒力测定;绿色防控
中图分类号:S 663.4 文献标识码:A文章编号:1008-0384(2019)03-331-07
Abstract: 【Objective】 Pathogens that cause the soft rot disease on Guichang kiwifruit and potential botanical fungicides for the disease control were investigated. 【Method】Suspected microbes were isolated using tissue culture and verified as the causation pathogens by means of artificial infection. The pathogens were identified morphologically and molecular biologically. In an indoor toxicity test using the mycelium growth method,6 selected botanical fungicides were applied on the identified pathogenic isolates to determine their potencies for the disease control. 【Result】Among the 8 isolated strains,RF2 and RF2-4 induced the soft rot disease on kiwifruits. The BLAST comparison on NCBI of the rDNA-ITS sequences of these strains suggested that RF2 was Botryosphaeria dothidea with a perfect match,and RF2-4 Phomopsis sp. with a 99% homology. The morphological analysis further confirmed the identifications. The EC50 of the organic fungicides were found for 0.5% matrine AS to be 0.442 mg·L-1 against B. dothidea and 0.322 mg·L-1 against Phomopsis sp.; and for 0.3% eugenol SL,0.680 mg·L-1 against B. dothidea and 0.301 mg·L-1 against Phomopsis sp. The potencies were greater than other botanical fungicides tested. 【Conclusion】B. dothidea and phomopsis sp.were positively identified as the pathogens that caused the soft rot disease on kiwifruits; and as botanical fungicides,0.5% matrine AS and 0.3% eugenol SL seemed most effective for the disease control.
Key words: kiwifruit; botanical fungicides; soft rot disease; toxicity determination; green method for disease control
0 引言
【研究意义】猕猴桃Actinidia属猕猴桃科Actinidiaceae猕猴桃属Actinidia,原产中国[1]。猕猴桃果实含有丰富的维生素、蛋白质等多种矿质元素,有“Vc之王”的美誉。目前,在中国、新西兰、日本、韩国、智利等国家广泛种植[2]。近年,贵州猕猴桃种植面积不断增加,至2017年底,贵州猕猴桃种植面积达28万hm2,主要种植品种为红阳、东红和贵长。贵州气候条件湿润、潮湿,猕猴桃病虫害不断加重,软腐病也越来越严重。软腐病的发生可加快猕猴桃的软化率,缩短储藏期,严重影响猕猴桃果实的品质及口感,给猕猴桃产业带来巨大的经济损失。猕猴桃软腐病在世界各猕猴桃产区均有报道发生,其病原菌也因果实品种、地区、环境条件等差异而不尽相同。因此,明确贵长猕猴桃软腐病致病病原菌,筛选具有防控作用的绿色植物源杀菌剂,对猕猴桃软腐病的绿色防治控具有重要意义。【前人研究进展】目前报道的猕猴桃软腐病病原菌主要包括葡萄座腔菌B.dothidea、拟茎点霉菌Phomopsis sp.、盘多毛孢菌Pestalotiopsis gracilis.、葡萄孢菌Botrytis cinersa、链格孢菌A. alternata及青霉菌Penicillium sp.等[3-8]。目前,对猕猴桃软腐病的防治主要以化学防治为主[9-11],而化学药剂的不合理使用容易引起污染、残留及抗药性等问题。【本研究切入点】随着人类安全意识的提高,绿色防控逐渐被重视。植物源杀菌剂是一种清洁、绿色的药剂,受阳光或微生物的作用容易分解、半衰期短、降解快,有利于农业的可持续发展。【拟解决的关键问题】本研究基于绿色防控的原则,通过病原菌的形态学、致病性特征,结合病原菌rDNA内部转录间隔区ITS序列对分离物进行鉴定,摸清贵长猕猴桃软腐病主要致病病原,并筛选出对病原具有较高毒力的植物源杀菌剂,以期为贵长猕猴桃软腐病的防治提供绿色手段,为解决猕猴桃产业发展难题提供技术依据。
1 材料与方法
1.1 供试材料
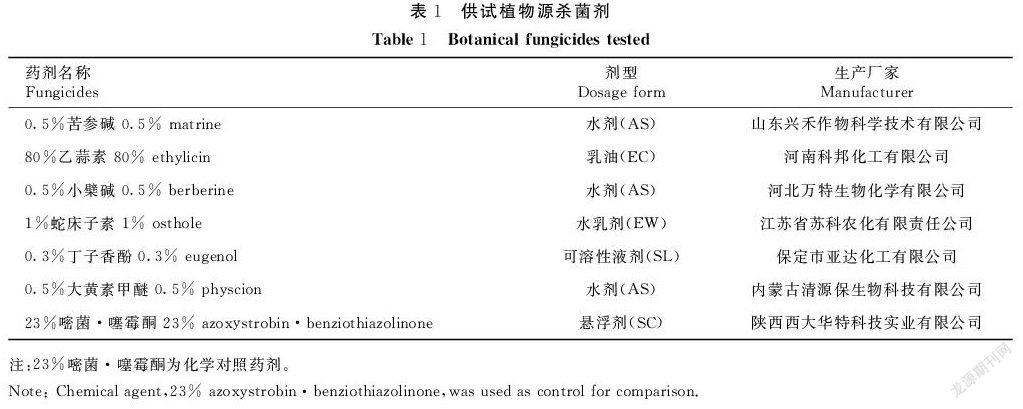
在貴州省修文县猕猴桃基地采集贵长猕猴桃病果带回贵州大学农安实验室进行病原菌分离、纯化及鉴定,对纯化的菌种编号保存。菌株保存和活化均用PDA培养基(马铃薯200 g,葡萄糖20 g,琼脂18 g,蒸馏水1 000 mL)。供试植物源杀菌剂见表1。
1.2 试验方法
1.2.1 病原菌致病性测定
按照柯赫氏法则将分离得到的病原菌进行致病性测定。将培养5 d的PDA平板菌落用打孔器打成直径为5 mm的菌饼,将菌饼的菌丝面紧贴在无菌处理过的果面上,分刺伤和不刺伤2种方式进行接种,对照为刺伤未接种。将接种好的果实放入250 mL烧杯中进行保湿,放入(25±0.5)℃培养箱中,于L∶D=12∶12条件下培养,注意保湿并定期观察发病情况测量病斑直径,病原菌致病性强弱根据病斑直径大小判断。无致病性记为“-”,有致病性记为“+”,“+”越多表示致病性越强,其中病斑直径R≤5 mm、5 mm
1.2.2 病原菌分子鉴定
将纯化的菌株送往生物工程(上海)股份有限公司进行DNA分子测序,将测定的序列登录 NCBI(www.ncbi.nlm.nih.gov)进行 BLAST 分析,并从GenBank数据库获得相关分离物的rDNA-ITS序列,在MEGA 6.0软件上用邻接法构建系统发育进化树。
1.2.3 室内毒力测定
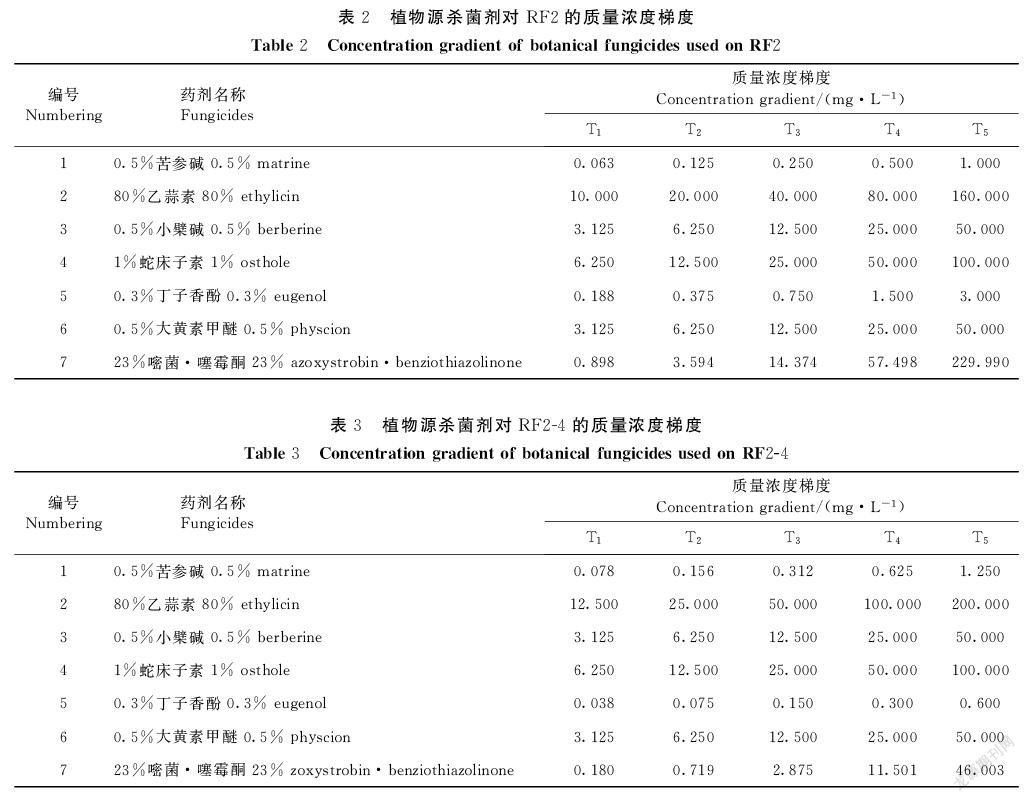
采用菌丝生长速率法测定,将供试植物源杀菌剂和化学对照药剂配制成5个浓度梯度(表2、3),将不同浓度药剂与PDA培养基充分混匀后,制成不同浓度含药平板,加入等量无菌水的PDA平板作为空白对照。用无菌的打孔器取菌龄一致、直径5 mm的软腐病病原菌菌饼接种于不同浓度含药平板和对照平板中央(d=9 cm),每个处理重复3次,置于(25±0.5)℃恒温培养箱中,于L∶D=12∶12条件下培养5 d,采用十字交叉法测量菌落直径,计算抑菌率。
抑菌率/%=(对照菌落直径-处理菌落直径)/对照菌落直径×100。
1.3 数据分析
采用Microsoft Excel 2007和DPS 7.05数据统计软件进行统计分析。
2 结果与分析
2.1 病原菌形态特征
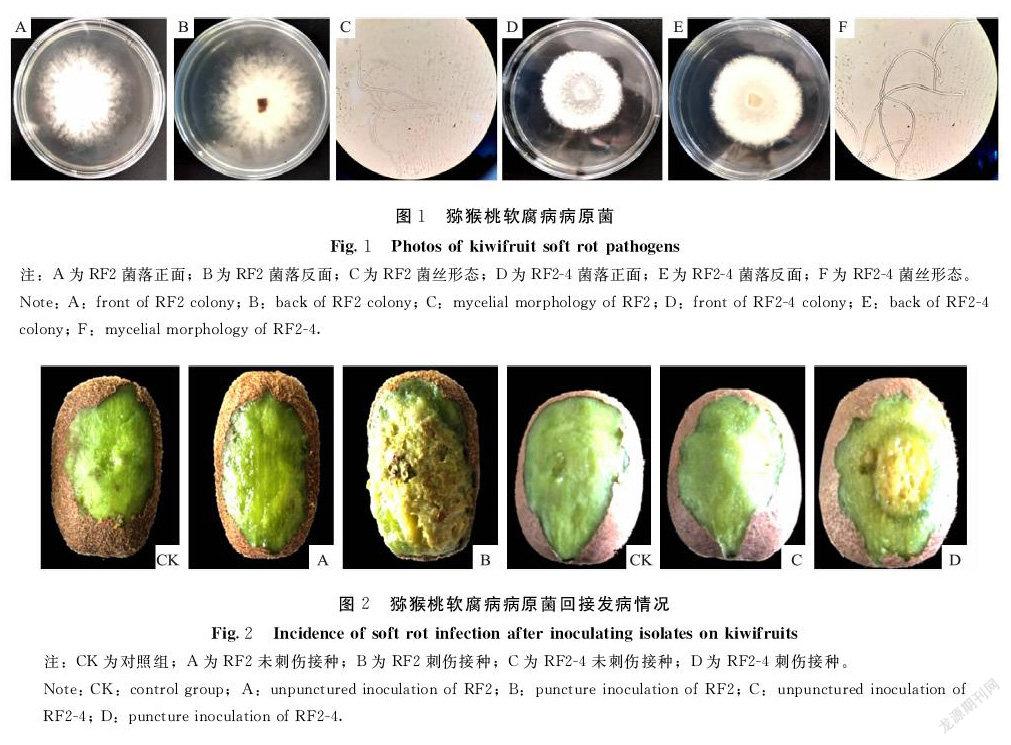
从贵长猕猴桃病果中分离纯化获得8株有效菌株,其中RF2和RF2-4可引发软腐病。将菌株置于(25±0.5)℃恒温培养箱中,于黑暗下培养,菌株RF2菌落初期为白色,长满后由中央开始转为墨绿色,菌落絮状,边缘不整齐,生长迅速,经4 d生长,菌落直径达67 mm(d=9 cm)(图1-A~B),气生菌丝较长,菌丝无隔,分支较多,呈树状形(图1-C);菌株RF2-4菌落初期为白色,菌落长满后由中央开始转为棕色,菌落絮状、较致密,边缘整齐,生长速度适中,经6 d生长,菌落直径达58 mm(d=9 cm)(图1-D~E),气生菌丝相对较短,无隔,分支较少(图1-F)。
2.2 病原菌致病性测定
由图2可知,刺伤未接种和未刺伤接种均未致病(图2-CK,图2-A和图2-C),刺伤接种的猕猴桃均致病且致病性较强(图2-B和图2-D)。14 d后,回接菌株RF2的病斑直径R为42.1 mm,致病性为“+++++”(R>20 mm);回接菌株RF2-4的病斑直径R为32.5 mm,致病性为“+++++”,其中RF2致病性最强。刺伤接种发病初期病斑内部呈乳白色,后病斑扩大,病健交界处果肉呈水渍状,与自然发病症状相同,对回接发病的病果进行再分离所得病原菌与原病原菌性状一致,根据柯赫氏法则证实分离获得的菌株RF2和RF2-4是猕猴桃软腐病的致病菌。
2.3 病原菌分子鉴定
对菌株进行分子鉴定,将测得的rDNA-ITS序列与GenBank数据库中已经收录的序列进行BLAST分析比对,利用MEGA 6.0软件的邻接法构建系统发育进化树。
通过BLAST分析比对,菌株RF2与B. dothidea的同源性最高,同源性达100%,系统发育进化树分析结果显示(图3),RF2与B. dothidea聚为同一分支,亲缘关系最近,根据分子生物学理论,将RF2菌株鉴定为B. dothidea;而菌株RF2-4与Phomopsis sp.的同源性最高,达99%,系统发育进化树分析结果显示(图4),RF2-4与Phomopsis sp.聚为一支,与其他菌株的遗传距离较远,根据分子生物学理论,将RF2-4菌株鉴定为Phomopsis sp.。
2.4 室内毒力测定
2.4.1 植物源杀菌剂对葡萄座腔菌的毒力
6种植物源杀菌剂对葡萄座腔菌B. dothidea的室内毒力见表4。0.5%苦参碱AS对葡萄座腔菌B. dothidea的毒力相对最强,EC50为0.442 mg·L-1;其次为0.3%丁子香酚SL,EC50为0.680 mg·L-1;两种药剂的毒力均强于对照化学药剂23%嘧菌·噻霉酮SC。其他4种植物杀菌剂的毒力均相对较弱,其中0.5%小檗碱AS对葡萄座腔菌B. dothidea毒力最弱,EC50为1 362.11 mg·L-1。试验表明,0.5%苦参碱AS和0.3%丁子香酚SL对葡萄座腔菌B. dothidea的毒力较强,可用于该病原菌的防控。
2.4.2 植物源杀菌剂对拟茎点霉菌的毒力
6种植物源杀菌剂对拟茎点霉菌Phomopsis sp.的室内毒力见表5。0.3%丁子香酚SL和0.5%苦参碱AS对拟茎点霉菌Phomopsis sp.的毒力效果较强,EC50值分别为0.301、0.322 mg·L-1,均强于对照化学药剂23%嘧菌·噻霉酮SC;其他4种植物杀菌剂的毒力均相对较弱。试验表明,0.3%丁子香酚SL和0.5%苦参碱AS对拟茎点霉菌Phomopsis sp.的毒力也较强,可用于抑制该病原菌菌丝生长。
3 讨论与结论
葡萄座腔菌B. dothidea和拟茎点霉菌Phomopsis sp.是寄主范围较广的病原真菌,侵染可引起猕猴桃软腐病[3]、猕猴桃枝枯病[12] 和蓝莓茎溃疡病[13]等。本研究通过病原菌分离纯化、致病性测定和rDNA-ITS分子鉴定,明确引起修文县贵长猕猴桃软腐病的主要病原菌为葡萄座腔菌B.dothidea和拟茎点霉菌Phomopsis sp.,这与前人报道[3-8]一致。
物源杀菌剂的主要成分是天然存在的化合物,这些活性物质主要由C、H、O等元素组成,来源于自然,能在自然界降解,具有安全、无污染、低残留等优点,具有不影响环境的优越性 [14-15],是一种清洁、绿色药剂,有利于农业的可持续性发展。
汤丽梅等[16]研究表明大蒜素对拟茎点霉菌Phomopsis sp.和葡萄座腔菌B. dothidea等猕猴桃软腐病的主要致病菌具有显著抑制作用;王强等[17]报道蒜头原汁对拟茎点霉菌Phomopsis sp.等10种病菌菌丝生长有较好的抑制效果;周军等[18]研究表明丁子香酚和苦参碱对桃果腐病菌的毒力较高。本试验结果显示,对照23%嘧菌·噻霉酮SC对葡萄座腔菌B. dothidea和拟茎点霉菌Phomopsis sp.毒力相对较弱,可能与田间防治过程中长期使用化学药剂有关。而0.3%丁子香酚SL和0.5%苦参碱AS对葡萄座腔菌B. dothidea和拟茎点霉菌Phomopsis sp.毒力较好,可为田间绿色药剂防治贵长猕猴桃软腐病提供参考依据。由于贵长引起猕猴桃软腐病的致病菌种类较多,要明确对猕猴桃软腐病毒力较好的药剂,仍需进一步的研究。
参考文献:
[1]马松涛,宋晓斌,张学武,等. 猕猴桃花果病害研究现状及趋势[J]. 西北林学院学报,2000,15(3):86-90.
MA S T,SONG X B,ZHANG X W,et al. Present situation and trend of the researches on flower and fruit diseases of kiwifruit [J]. Journal of Northwest Forestry University,2000,15(3): 86-90.(in Chinese)
[2]韩礼星,黄贞光,李明,等. 加入WTO后我国猕猴桃产业的发展策略[J]. 果树学报,2003,20(3):218-223.
HAN L X,HUANG Z G,LI M,et al. On the strategies for development of kiwifruit industry in China after accessed to WTO [J]. Journal of Fruit Science,2003,20(3): 218-223.(in Chinese)
[3]HAWTHORNE B T,REES-GEORGE J,SAMUELS G J. Fungi associated with leaf spots and post-harvest fruit rots of kiwifruit (Actinidia chinensis) in New Zealand[J]. New Zealand Journal of Botany,1982,20(2):143-150.
[4]丁爱冬,于梁,石蕴莲. 猕猴桃采后病害鉴定和侵染规律研究[J]. 植物病理学报,1995(2):149-153.
DING A D,YU L,SHI Y L. Studies on the identification of pathogenic fungi and their ways of post-harvest rot disease infection on kiwifruit [J]. Acta Phytopathologica Sinica,1995 (2): 149-153.(in Chinese)
[5]張承,李明,龙友华,等. 采前喷施壳聚糖复合膜对猕猴桃软腐病的防控及其保鲜作用[J]. 食品科学,2016,37(22):274-281.
ZHANG C,LI M,LONG Y H,et al. Control of soft rot in kiwifruit by pre-harvest application of chitosan composite coating and its effect on preserving and improving kiwifruit quality [J]. Food Science,2016,37(22): 274-281.(in Chinese)
[6]黎晓茜,曾彬,尹显慧,等. 修文县猕猴桃腐烂病病原鉴定及防治药剂筛选[J]. 中国南方果树,2016,45(5):101-104.
LI X X,ZENG B,YIN X H,et al. Identification of pathogenic fungi causing fruit rot of kiwifruit in Xiuwen county and the toxicity assay of fungicites [J]. South China Fruits,2016,45(5): 101-104.(in Chinese)
[7]吴文能,张起,雷霁卿,等. 贵长猕猴桃软腐病病原菌分离鉴定及抑菌药剂筛选[J]. 北方园艺,2018(16):47-54.
WU W N,ZHANG Q,LEI J Q,et al. Identification and pharmaceutical screening of kiwifruit soft rot disease on ‘Guichang’ gooseberry [J]. Northern Horticulture,2018 (16): 47-54.(in Chinese)
[8]潘慧,胡秋舲,张胜菊,等. 贵州六盘水市猕猴桃病害调查及病原鉴定[J]. 植物保护,2018,44(4):125-131.
PAN H,HU Q L,ZHANG S J. et al. Kiwifruit disease investigation and pathogen identification in liupanshui city,Guizhou province [J]. Plant Protection,2018,44(4): 125-131.(in Chinese)
[9]李诚,蒋军喜,冷建华,等. 6种杀菌剂对猕猴桃主要腐烂病菌的室内毒力测定[J]. 中国南方果树,2012,41(1):27-29.
LI C,JIANG J X,LENG J H,et al. Indoor toxicity test of six fungicides to main pathogenic fungi causing fruit rot of kiwifruit [J]. South China Fruits,2012,41(1): 27-29.(in Chinese)
[10]刘达富,王井田,陆雪峰,等. 猕猴桃果实腐烂病田间药效试验[J]. 浙江林业科技,2015,35(2):70-73.
LIU D F,WANG J T,LU X F,et al. Field experiment on fungicides on fruit rot of actinidia chinensis [J]. Journal of Zhejiang Forestry Science and Technology,2015,35(2): 70-73.(in Chinese)
[11]王小洁,李士谣,李亚巍,等. 猕猴桃软腐病病原菌的分离鉴定及其防治药剂筛选[J]. 植物保护学报,2017,44(5):826-832.
WANG X J,LI S Y,LI Y W,et al. Pathogen identification of kiwifruit soft rot and fungicide screening for control of the disease [J]. Journal of Plant Protection,2017,4(5): 826-832.(in Chinese)
[12]李诚,蒋军喜,冷建华,等. 猕猴桃枝枯病病原菌鉴定[J]. 北方园艺,2013(24):130-133.
LI C,JIANG J X,LENG J H,et al. Identification of the pathogen causing shoot blight of Kiwifruit [J]. Northern Horticulture,2013(24): 130-133.(in Chinese)
[13]凌丹燕. 蓝莓主要真菌病害的分离鉴定与防治研究[D]. 金华:浙江师范大学,2016.
LING D Y. The study of isolation and identification of major fungal diseases of blueberry and disease control [D].Jinhua: Zhejiang Normal University,2016.(in Chinese)
[14]何军,马志卿,张兴. 植物源农药概述[J]. 西北农林科技大学学报(自然科学版),2006,34(9):79-85.
HE J,MA Z Q,ZHANG X. Review of botanical pesticide [J]. Journal of Northwest A & F University(Natural Science Edition),2006,34(9): 79-85.(in Chinese)
[15]陳昂. 五种植物源农药的环境毒性评价[D]. 长沙:中南大学,2010.
CHEN A. Environmental toxicity evaluation of five botanical pesticides [D].Changsha: Central South University,2010.(in Chinese)
[16]汤丽梅,周清,吴尚,等. 大蒜素对猕猴桃果实致病菌的抑制活性及贮藏防效研究[J]. 中国南方果树,2014,43(4):15-18.
TONG L M,ZHOU Q,WU S,et al. Study on inhibitory activity of allicin to pathogens of kiwifruit and its efficacy on fruit storage [J]. South China Fruits,2014,43(4): 15-18.(in Chinese)
[17]王强,冯岩,何小静,等. 植物源杀菌剂的筛选[J]. 福建农业学报,2012,27(11):1246-1249.
WANG Q,FENG Y,HE X J,et al. Screening of the botanical fungicides [J]. Fujian Journal of Agricultural Sciences,2012,27(11): 1246-1249.(in Chinese)
[18]周军,赵杰. 植物性杀菌剂对桃炭疽病菌和桃果腐病菌的毒力测定[J]. 上海农业科技,2018(5):113.
ZHOU J,ZHAO J. Toxicity determination of botanical fungicides to anthracnose and fruit rot on Peach [J]. Shanghai Agricultural Science and Technology,2018 (5): 113.(in Chinese)
(责任编辑:林海清)
