糖基化亚硝基血红蛋白部分替代亚硝酸钠对哈尔滨风干肠质量的影响
2019-09-06刘鹏雪刘昊天孔保华
刘鹏雪,刘昊天,张 欢,孔保华*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
亚硝酸钠(NaNO2)是肉制品中一种非常重要的添加成分,具有很好的呈色和抗氧化作用,可以赋予肉制品特有的红色,抑制脂肪氧化,有效阻止“过热味”的产生,使肉制品产生独特的风味[1-2]。此外,NaNO2还具有一定的抑菌作用,可以抑制肉制品中的微生物生长,特别对肉毒梭状芽孢杆菌具有很好的抑制作用[3]。然而,NaNO2在特定条件下,如高温或酸性条件下,可参与亚硝基化合物如N-亚硝胺的形成,其对人体具有致突变、致畸和致癌作用。孙钦秀等[4]研究了添加NaNO2对哈尔滨风干肠中亚硝胺含量的影响,结果表明随着NaNO2添加量的增加,风干肠中亚硝胺的含量增加,尤其是硝基二苯胺。Hospital等[5]研究表明,较高的亚硝酸盐残留量可能会导致产品中形成更多的N-亚硝胺,特别是将其加热时。因此,如何降低肉制品中亚硝酸盐的使用量一直备受关注[6]。
自从发现NaNO2和N-亚硝胺之间存在一定的关联,人们对天然或者合成的NaNO2替代物的研究日益增加,其主要目的是替代NaNO2所发挥的呈色作用。近年来,很多学者研究利用植物提取物替代亚硝酸盐,并取得了一定的进展,Riel等[7]将欧芹提取物粉末作为NaNO2替代物添加到烟熏型香肠中,结果表明,添加欧芹提取物粉末可以使香肠中NaNO2含量降低,且与NaNO2处理的香肠的红度值(a*)相似,感官评价的结果显示出添加欧芹提取物的香肠的总体可接受性评分与添加NaNO2的香肠相当。此外,Terns[8]和Riazi[9]等分别研究了樱桃粉和红葡萄果渣作为NaNO2替代物对不同香肠质量和感官属性的影响,结果表明,樱桃粉和红葡萄果渣均可有效提高香肠的颜色且感官评价得分与添加NaNO2的香肠几乎没有差异。然而,值得注意的是,使用植物提取物作为亚硝酸盐替代品,涉及到向肉制品中间接加入硝酸盐和亚硝酸盐[10]。本课题组前期报道了可以利用一些肉类发酵剂将高铁肌红蛋白转变成亚硝酰肌红蛋白,使肉制品产生特征性粉红色从而替代亚硝酸盐,Zhang Xue等[11]研究发现,向中式香肠中添加108CFU/g的发酵乳杆菌,香肠的a*值与用亚硝酸盐处理的香肠相似,表明发酵乳杆菌有可能可以在香肠的生产中替代亚硝酸盐。Li Peijun等[6]评估了从中式干香肠中分离的木糖葡萄球菌和戊糖片球菌在不添加亚硝酸盐的MRS(Mann-Rogosa-Sharp)肉汤模型系统和生猪肉糊中将肌红蛋白转化为亚硝酰肌红蛋白的能力,结果表明,在模型系统和生猪肉糊中,含有木糖葡萄球菌样品的a*值均得到提高且与添加亚硝酸盐的肉几乎相同,为肉制品中的亚硝酸盐替代品提供了潜在的解决方案。然而,由于肉制品发酵的过程十分复杂,所以使用微生物发酵不能确定肉制品中的红色素是由微生物转化产生[6]。除上述替代物外,还开发了如大气压等离子体处理的水[12]、安卡大米[13]、胭脂树[14]和番茄酱[15]等多种替代物,然而由于某些原因,这些替代品还没有达到商业化阶段,不能在肉类加工过程中广泛使用。
亚硝基血红蛋白是一种通过血红蛋白与亚硝酸盐发生反应而生成的腌肉色素,国外对亚硝基血红蛋白的研究较早。Fox[16]早在1966年便提出了在肉的腌制过程中添加亚硝基血色原的观点,并通过实验证明由血红蛋白合成的亚硝基血色原可以使腌制肉制品的颜色稳定,同时可以减少肉制品中亚硝酸盐的使用量。我国对亚硝基血红蛋白的研究起步较晚,主要研究的是亚硝基血红蛋白制备工艺的优化[17-19]。虽然对于亚硝基血红蛋白在实验条件下的研究已经成熟,但在实际的加工生产过程中,由于其稳定性、分散性等加工性质尚不理想,所以限制了亚硝基血红蛋白的应用[20]。于是在亚硝基血红蛋白的制备过程中加入不同糖类以提高其稳定性。杨锡洪[21]研究发现亚硝基血红蛋白的氨基可以与糖的醛基发生美拉德反应生成蛋白质-多糖共价复合物。本课题组张红涛等[22]以新鲜猪血红蛋白为原料制备糖基化亚硝基血红蛋白(glycosylated nitrosohaemoglobin,GN-Hb)并应用于肉糜中,结果表明其呈色效果优于对照组且NaNO2残留量显著低于NaNO2处理组;杨锡洪等[23]将制备的GN-Hb添加到灌肠中,结果表明,在腌制好的原料肉进行斩拌时加入GN-Hb,可以赋予灌肠理想且稳定的色泽以及良好的质构。
哈尔滨风干肠因其独特的风味和质构而深受广大消费者的喜爱。本课题组前期实验结果表明,风干肠中NaNO2添加量为0.10 g/kg可起到良好的发色、抑菌、抗氧化和增加风味的作用,添加2.0 g/kg GN-Hb可以起到与NaNO2相近的a*值和感官评价得分,但添加GN-Hb会降低产品的亮度值(L*),且其抑菌和抗脂肪氧化的能力显著低于NaNO2处理组(P<0.05)[24]。为此,本实验进一步研究不同添加水平的GN-Hb部分替代NaNO2对哈尔滨风干肠的影响,旨在为后期低硝风干肠的开发提供理论基础。
1 材料与方法
1.1 材料与试剂
原料肉 黑龙江省北大荒肉业有限公司;辅料 哈尔滨大润发超市;NaNO2哈尔滨亿人食品添加剂公司;亚硝酸盐试剂盒 南京建成生物工程研究所;平板计数琼脂、MRS培养基、双层结晶紫中性红胆盐琼脂 广东环凯微生物科技有限公司;盐酸、丙酮、甲醇(均为分析纯) 哈尔滨盛达化验仪器销售公司。
1.2 仪器与设备
AL-104型精密电子天平 上海精科实业有限公司;FE20K型pH计 上海梅特勒-托利多仪器设备有限公司;722可见光分光光度计 上海惊宏实验设备有限公司;ZE-6000电子色差仪 日本电色工业株式会社;Aqua Lab水分活度测定仪 美国Decagon公司;GC-3L小型灌肠机 瑞安市鸿飞机械有限公司。
1.3 方法
1.3.1 糖基化亚硝基血红蛋白的制备
GN-Hb的制备参照Zhang Hongtao等[25]方法并稍作修改。新鲜血液中添加0.8%抗凝剂(柠檬酸钠)在4 ℃条件下迅速运回实验室,4 ℃、4 000×g离心30 min,弃上清液,取沉淀部分即血球细胞,计算血球细胞的干物质含量(本实验条件下干物质质量分数为46%),取220 g沉淀(本实验条件下对应的干物质含量为100 g)加入440 g蒸馏水,4 ℃搅拌1 h使细胞溶胀破壁,然后加入1.8 g抗坏血酸、0.8 g NaNO2和3 g葡萄糖,避光条件下静置3 h,期间进行间歇性搅拌,60 ℃水浴20 min,取出后立即冷却至室温,进行冻干。在本实验条件下,最终获得的GN-Hb粉末中NaNO2残留量仅为0.65 mg/g。
1.3.2 自然发酵风干肠的制备
原料:精瘦肉(猪臀肉)2 700 g,肥肉(猪背膘)300 g。辅料:盐75 g、曲酒30 g、绵白糖30 g、姜粉15 g、味素15 g、淀粉15 g、纯净水30 g、混合调料9 g(混合调料包括:花椒、大料、桂皮、丁香等),GN-Hb和NaNO2根据实验设计添加量如下:1)不添加GN-Hb和NaNO2的空白组(C组);2)不添加GN-Hb,NaNO2按瘦肉计添加量为0.05 g/kg(SN-1组);3)不添加GN-Hb,NaNO2按瘦肉计添加量为0.10 g/kg(SN-2组);4)GN-Hb添加量为0.5 g/kg,NaNO2添加量为0.05 g/kg(SG-1组);5)GN-Hb添加量为1.0 g/kg,NaNO2添加量为0.05 g/kg(SG-2组);6)GN-Hb添加量为1.5 g/kg,NaNO2添加量为0.05 g/kg(SG-3组)。
工艺要点:瘦肉剔除淋巴、筋腱、血管等结缔组织并切丁后,加入盐和NaNO2进行腌制,肥肉切丁,将腌制好的瘦肉丁和肥肉丁混合均匀后,加入调味料混匀,进行灌制,灌制好的风干肠在温度(25±2)℃ 条件下风干24 h(相对湿度30%~50%),然后转移到恒温恒湿培养箱中进行发酵((25±2)℃,相对湿度70%~75%),发酵0、3、6、9 d和12 d测定pH值、水分活度(aw)、微生物、NaNO2残留量、L*值、a*值和硫代巴比妥酸反应产物(thiobarbituric acid reactive substance,TBARS)值,在12 d对产品进行感官评价。在本实验中,SG-1、SG-2和SG-3组风干肠中GN-Hb的添加量分别为0.5、1.0 g/kg和1.5 g/kg,GN-Hb粉末中的NaNO2残留量为0.65 mg/g,相当于SG-1、SG-2和SG-3组风干肠中分别有0.33、0.65 mg/kg和0.98 mg/kg的NaNO2是由GN-Hb的添加所带入的,但与SN-1和SN-2组风干肠中50 mg/kg和100 mg/kg的NaNO2添加量相比,由GN-Hb的添加所带入的NaNO2非常少。
1.3.3 pH值和aw的测定
pH值测定参照GB/T 9695.5—2008《肉与肉制品pH测定》进行测定。准确称取切碎混匀的样品10 g加入90 mL蒸馏水中,4 ℃条件下间接性搅拌30 min后,滤纸过滤,取滤液,用pH计测定。aw的测定是将剪碎的风干肠样品铺满样品盒底部,推入水分活度仪中进行测定。
1.3.4 微生物测定
称取10 g剪碎的风干肠,加入90 mL生理盐水(0.85%),于4 ℃放置30 min,期间进行间歇性晃动,从该样液中制备连续10 倍的稀释液进行菌落计数。参照Hospital等[5]的方法,使用平板计数琼脂进行总菌落计数,MRS培养基进行乳酸菌菌落计数,双层结晶紫中性红胆盐琼脂进行大肠杆菌菌落计数。
1.3.5 NaNO2残留量的测定
亚硝酸盐测定采用试剂盒。10 g剪碎的风干肠,加入90 mL纯净水,于4 ℃放置30 min,取上清液依次加入测试盒中的试剂,风干肠中的亚硝酸盐可与显色剂生成淡红色偶氮化合物,0.5 cm光径比色杯,于550 nm波长处测OD值,通过比色可间接测定NaNO2残留量,计算公式如下:

式中:标准品浓度为100 μmol/L。
1.3.6 风干肠颜色的测定
风干肠颜色通过ZE-6000色差计进行测定。仪器经零点校正和白板(L*=95.26,a*=-0.89,b*=1.18)校正后,将去除肠衣和肥肉的中心样品混匀,铺满色差杯底部,置于载物台测定风干肠的L*值和a*值,每个样品同一方向旋转3 次,测定3 次后输出平均值并记录。
1.3.7 TBARS值的测定
TBARS值的测定参照Wang等[26]的方法,略作修改。准确称取2.0 g剪碎的样品放入试管中,加入3 mL硫代巴比妥酸溶液和17 mL三氯乙酸-盐酸溶液,混匀后沸水浴中加热30 min,取出后迅速冷却至室温,吸取5 mL反应后的上清液加入等体积氯仿,1 000×g离心10 min,532 nm波长处测定上清液的吸光度。TBARS值以每千克脂质氧化样品中丙二醛的质量表示,计算公式如下:

式中:A532nm为样品的吸光度;Ws为样品的质量/g;9.48为常数。
1.3.8 感官评定
风干肠的感官评定参考Riaz等[9]的方法并稍作修改。邀请20 名食品学院具有丰富经验的同学,感官评定前使小组成员掌握本实验的评分标准和注意事项,了解实验的目的和意义。然后将蒸煮后的样品切成约2.5 cm长度的切片,放在以随机顺序编码的白色塑料盘中,在每次评价之前,小组成员需用纯净水漱口。
在该测试中评价的属性是肉制品最重要和基本的感官性质,根据7 分制原则进行打分,评分指标包括颜色(7 分为颜色红润,有光泽;1 分为颜色暗淡、光泽差),气味(7 分为具有发酵肉制品特有的风味;1 分为气味较差),风味(7 分为肉制品有浓郁的香味、回味好,1 分为香味很淡回味少),口感(7 分为肉质细腻、耐嚼,1 分为肉质有柴感、较硬)和总体可接受性(7 分为可接受高,1 分为可接受性低)。
1.4 数据分析
2 结果与分析
2.1 pH值和aw的测定及颜色分析
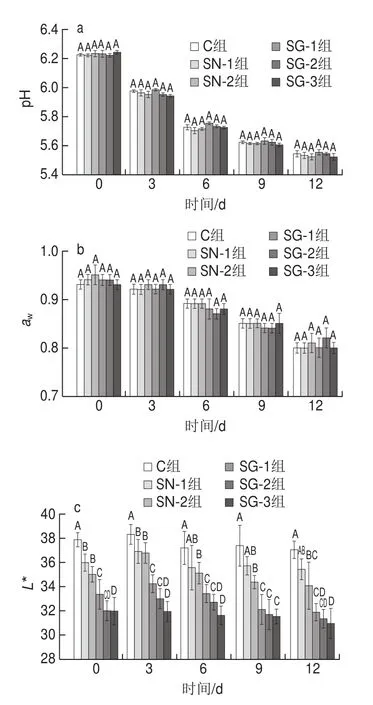
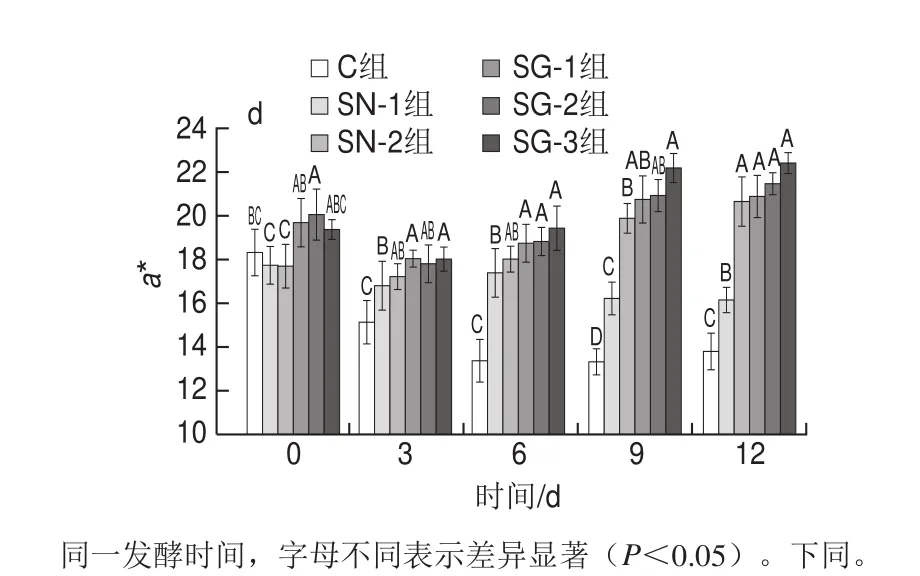
图1 风干肠发酵过程中pH值(a)、aw(b)、L*(c)和a*(d)的变化Fig. 1 Changes in pH (a), aw (b), L* (c) and a* (d) in sausages during fermentation
如图1a所示,发酵0~3 d,各组风干肠的pH值下降速度较快,这可能归因于碳水化合物代谢生成乳酸等有机酸[27]。发酵3~12 d,各组风干肠的pH值下降速度减慢,可能与碱性化合物如氨和三甲胺的积累有关[28]。此外,在整个风干发酵期间,SG-1、SG-2和SG-3组风干肠的pH值与SN-1、SN-2及C组的风干肠相比均没有显著性差异(P>0.05),说明GN-Hb部分替代NaNO2后不对风干肠的pH值产生影响,且GN-Hb的添加量对风干肠的pH值没有显著影响(P>0.05)。这与图2B所显示的各组风干肠乳酸菌菌落数在整个风干发酵期间均无显著性差异(P>0.05)的结果相符。
aw影响着微生物的生长以及产品的货架期[29-30]。如图1b所示,在本实验范围内,各组风干肠在发酵各个时间点aw均没有显著性差异(P>0.05),说明GN-Hb部分替代NaNO2后不对风干肠的aw产生影响,且GN-Hb的添加量对风干肠的aw没有显著影响(P>0.05)。
肉制品的特征性粉红色被认为是消费者的主要购买标准之一[31-32]。如图1c所示,在同一发酵时间,对照组风干肠的L*值显著高于其他各组(P<0.05),NaNO2添加会降低风干肠的L*值。当GN-Hb部分替代NaNO2时,随着GN-Hb添加量的增加,风干肠的L*值呈下降趋势,在0~6 d内,SG-1组风干肠的L*值显著高于SG-3组风干肠(P<0.05),但SG-1与SG-2,SG-2与SG-3组风干肠之间的L*值差异不显著(P>0.05),在9~12 d内,SG-1与SG-2、SG-3组风干肠的L*值均无显著性差异(P>0.05),且在发酵12 d,SG-1和SG-2组风干肠的L*值虽然低于SN-2组风干肠,但差异不显著(P>0.05)。
如图1d所示,第0天时,只添加NaNO2的两组风干肠SN-1和SN-2具有最低的a*值,这可能是由于NaNO2的添加使风干肠在混料和灌制的过程中氧化会立即形成灰色和棕色的肌红蛋白[33],在第3~12天,如本实验所预期的那样,对照组均获得了显著最低的a*值(P<0.05),当GN-Hb部分替代NaNO2后,风干肠的a*值显著提高(P<0.05)。此外,在本实验范围内,风干肠的a*值受GN-Hb添加量的影响不大,SG-1与SG-2及SG-3组风干肠的a*值在整个风干发酵期间均无显著性差异(P>0.05),且在3~12 d内,SG-1与SG-2组风干肠的a*值与SN-2组风干肠相比,均无显著性差异(P>0.05),说明这两种复配比例均可替代NaNO2的发色的作用。
2.2 微生物分析

图2 风干肠发酵过程中典型的微生物菌落总数的变化Fig. 2 Changes in total bacterial count in sausages during fermentation
各组风干肠的总菌落数(图2A)和乳酸菌菌落数(图2B)在整个风干发酵期间均无显著性差异(P>0.05)。总菌落数在0~3 d迅速增加并在3~6 d保持稳定,6~12 d略有降低趋势。乳酸菌菌落数均在0~6 d内呈持续上升的趋势并在第6天时达到最大值,随后呈下降的趋势。说明当GN-Hb部分替代NaNO2时不会影响风干肠中总菌落和乳酸菌的生长,且不同添加量的GN-Hb的各组之间差异不显著(P>0.05)。但是不同处理组风干肠的大肠杆菌菌落数具有显著性差异(P<0.05),如图2C所示,6 组风干肠中只有NaNO2添加量为0.10 g/kg的SN-2组风干肠在整个风干发酵期间大肠杆菌菌落数一直呈下降的趋势,其他5 组风干肠在0~3 d内大肠杆菌菌落数呈上升趋势,随后逐渐下降,说明在0~3 d内,大肠杆菌在这5 组风干肠中仍然能够生长,但在整个风干发酵期间,对照组风干肠中的大肠杆菌菌落数一直呈现最高值。从图2C还可以看出,SG-1、SG-2和SG-3组风干肠的大肠杆菌菌落数低于SN-1组风干肠,且GN-Hb添加量越大,大肠杆菌菌落数越低(P<0.05)。这说明GN-Hb对大肠杆菌的生长具有抑制作用,这可能是因为GN-Hb是美拉德反应的产物[21],而美拉德反应的产物具有较好的抑菌能力。Rao等[34]研究表明,美拉德反应产物对于其研究中所使用的所有细菌均有抑制作用,并且对大肠杆菌观察到最大的抗菌活性。Chung等[35]也报道了壳聚糖-葡萄糖美拉德反应产物对大肠杆菌的高度抗菌活性。
2.3 NaNO2残留量分析
风干肠中NaNO2残留量的变化取决于NaNO2的氧化还原反应以及NaNO2与蛋白质,脂质和其他肉类成分之间的结合程度[7]。如图3所示,GN-Hb部分替代NaNO2不影响风干肠的NaNO2残留量。在整个风干发酵期间,SG-1、SG-2和SG-3组的风干肠的NaNO2残留量均与SN-1组风干肠无显著性差异(P>0.05),说明由于添加GN-Hb而带入的微量的NaNO2不会对风干肠中NaNO2残留量产生影响,这与前期的研究结果一致[24]。且在整个风干发酵期间,SG-1、SG-2和SG-3组的风干肠的NaNO2残留量均未超过国家标准所限定的最大残留量30 mg/kg。

图3 风干肠发酵过程中NaNO2残留量的变化Fig. 3 Changes in residual sodium nitrite in sausages during fermentation
2.4 TBARS值的测定结果
TBARS值可以反映肉制品发酵过程中脂质氧化水平,主要用于评估氧化的次级产物(例如丙二醛及其他醛、酮等)的形成[36]。如图4所示,各组风干肠的TBARS值在整个风干发酵期间均呈现上升趋势,且在0~3 d内无显著性差异(P>0.05),SN-2组风干肠的TBARS值在6~12 d内均呈现最低值,SG-1、SG-2和SG-3组风干肠的TBARS值与之无显著性差异(P>0.05)且低于SN-1组风干肠,这说明GN-Hb具有一定的抑制脂肪氧化的作用,这可能是因为GN-Hb是美拉德反应的产物[21]。Chang等[37]的研究结果显示,美拉德反应产物可以阻止TBARS值的增加。Liu Qian等[38]研究表明,当乳清蛋白与葡萄糖在60 ℃条件下加热时,乳清蛋白的抗氧化性得到显著提高。Daglia等[39]表明,美拉德反应可以产生一些高分子质量的化合物,这些化合物可能对美拉德反应产物的抗氧化活性有重大贡献。此外,美拉德反应产物的中间体还原酮化合物可以提供氢原子,使其具有更高的还原能力[34]。与此同时,美拉德反应产物中的羟基可能在其还原活性中起重要作用,糖基化可以导致葡萄糖-蛋白质系统的结构变化,从而诱导形成可以提供还原能力的化合物。Gu Fenglin等[40]研究表明美拉德反应产物具有螯合活性,这可能归因于美拉德反应产物中存在的羟基和吡咯基团。此外,从图4还可以看出,随着GN-Hb添加量的增大,风干肠的TBARS值逐渐减小,但无显著性差异(P>0.05)。Miranda等[41]的研究结果显示,美拉德反应产物的浓度与氧化产物形成减少之间的关系并不总是线性的,这与本研究的结果相似。
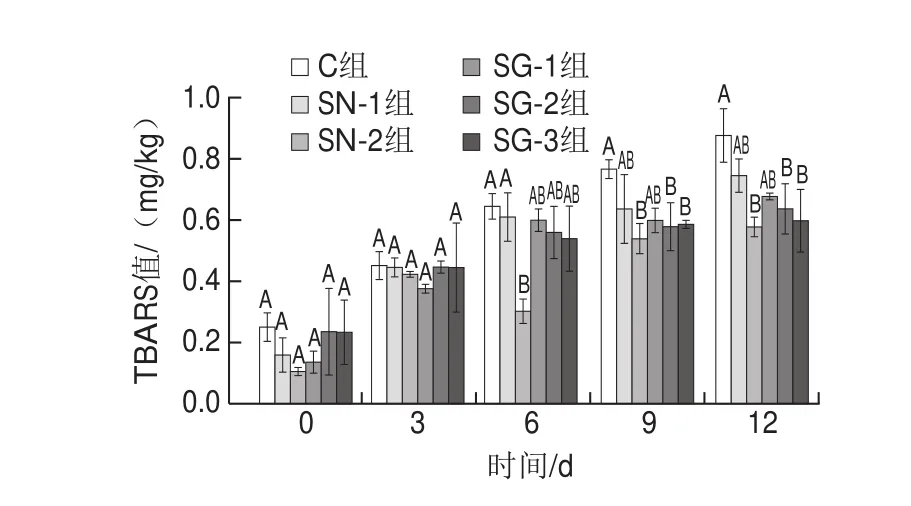
图4 风干肠发酵过程中TBARS值的变化Fig. 4 Changes in TBARS value in sausages during fermentation
2.5 感官评价结果
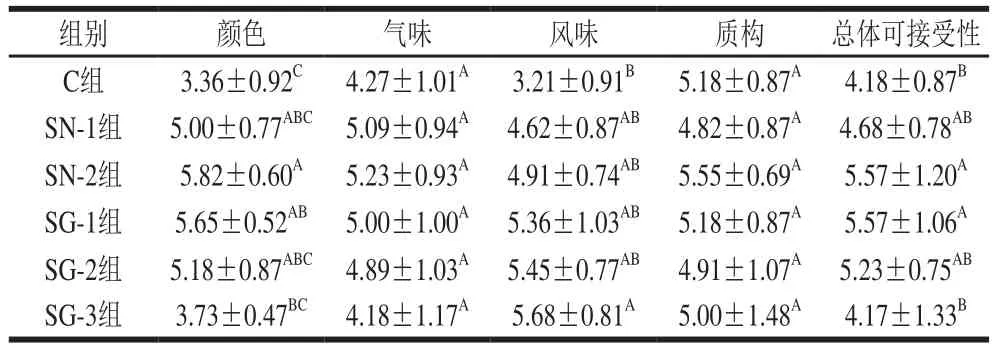
表1 风干肠发酵后感官评价Table 1 Sensory evaluation of sausages
如表1所示,对于颜色,SN-2组风干肠分最高,SG-1和SG-2组风干肠与之无显著性差异(P>0.05),但是SG-3组颜色得分较低,主要是由于添加过多量的GN-Hb造成过红的颜色,这种过红的颜色反而不受消费者的喜爱,使得产品的接受程度降低。对于风味,SG-1、SG-2和SG-3组风干肠得分高于SN-2组风干肠但无显著性差异(P>0.05),且GN-Hb添加量越大,风味得分越高,说明GN-Hb可以提高风干肠的风味。对于气味和质构,各组风干肠间均无显著性差异(P>0.05)。对于总体可接受性评分,SN-2组和SG-1组风干肠获得了最高分,SG-2组得分与之无显著性差异(P>0.05),但在本实验范围内,添加高浓度GN-Hb的SG-3组风干肠获得了较低的总体可接受性得分,这可能是因为较低的颜色得分值导致的,因为颜色是评价肉制品品质和决定消费者是否购买的重要标准[31]。
3 结 论
本实验研究了不同添加量GN-Hb部分替代NaNO2对哈尔滨风干肠理化特性及感官品质的影响,结果表明GN-Hb添加量对风干肠的pH值、aw和NaNO2残留量无显著影响。微生物分析结果表明,GN-Hb的添加对风干肠中的菌落总数和乳酸菌菌落数无显著影响,但是可以显著降低大肠杆菌菌落数。此外,GN-Hb对脂肪氧化有一定的抑制。颜色分析表明,GN-Hb部分替代NaNO2可以提高风干肠的红色值。感官评定结果显示,GN-Hb添加量为0.5 g/kg和1.0 g/kg时,风干肠总体可接受性评分均与0.10 g/kg NaNO2处理组风干肠相似。综上所述,1.0 g/kg GN-Hb与0.05 g/kg NaNO2复配可以部分替代哈尔滨风干肠中NaNO2添加量,产品的颜色、风味和产品质量和添加NaNO2相近。
