5-氨基酮戊酸光动力治疗高危型人乳头状瘤病毒宫颈持续感染疗效观察
2019-09-04周迪兰王文英
李 瑞,葛 静,周迪兰,王文英,秦 琳
解放军总医院第四医学中心妇产科(北京 100048)
近些年随着宫颈上皮内瘤样病变(Cervical intraepithelial neoplasia,CIN)和宫颈癌发病率有逐渐升高和发病人群年轻化转移的趋势,关于宫颈人乳头状瘤病毒感染(HPV)的防治研究进一步引起医学的高度重视[1]。一般来说,HPV感染的潜伏期为6周至2年,早期可无症状或症状不明显,比如体表皮肤或生殖器上有肉眼可见的良性疣。普遍认为,宫颈持续存在的高危型人乳头状瘤病毒(High-risk human papillomavirus,HR-HPV)感染和宫颈恶性疾病发生进展紧密相关,比如HPV 16、18感染等,因此加强宫颈HPV筛查和及时阻断HPV感染是预防CIN、宫颈癌等妇科恶性疾病的重要环节[2-3]。目前医学上尚无根治HPV感染的特效疗法或药物,临床治疗HPV感染以缓解症状、治疗疣体为主要原则,比如常用的干扰素疗法[4]。5-氨基酮戊酸光动力(ALA-PDT)疗法目前已成功用于尖锐湿疣的临床治疗[5],但在妇科特别是宫颈疾病领域尚处于起步阶段。本研究旨在探讨ALA-PDT疗法对高危型HPV宫颈持续感染的治疗效果,报告如下。
资料与方法
1 一般资料 收集本院2016年6月至2018年9月期间收治的86例HR-HPV宫颈持续感染患者,纳入标准:均接受常规妇科检查、第二代杂交复活实验(HC-II)宫颈细胞学检查以及必要的阴道镜下病理活检等明确HR-HPV宫颈持续感染,且感染病程至少超过1年;患者对本研究知晓并签署知情同意书。排除标准:阴道镜下活检提示宫颈鳞状上皮内瘤变(CIN)或宫颈癌;对本研究所用药物和ALA-PDT过敏者;哺乳、妊娠期妇女;CIN II~III级;宫颈表面存在疣体;合并严重的器质性病变、HIV感染、淋病、宫颈炎、非淋菌性尿道炎、精神疾患、自身免疫性疾病或精神疾患者;入组前3个月内没有接受过任何HPV相关治疗。采用单盲随机数表法分为两组各43例,重组人干扰素组和ALA-PDT疗法组人口学资料见表1,两组在年龄、身高、体重、婚姻史、性生活史和相关疾病史方面比较,差异无统计学意义(P>0.05)。

表1两组HR-HPV宫颈持续感染患者相关资料比较
2 治疗方法 重组人干扰素组:月经干净3 d后给予重组人干扰素α-2b阴道泡腾胶囊(国药准字S20050075)宫颈给药治疗,每晚清洁外阴后置于阴道深部,80万IU/次,每个月经周期共治疗20次,持续治疗3个月。ALA-PDT组:患者月经干净3~5 d开始治疗,治疗仪器和光敏剂采用光动力治疗仪(LED IB型)、半导体激光治疗仪(LD600-C)和5--氨基酮戊酸(5-ALA),用温敏凝胶溶解(118 mg/支5-氨基酮戊酸加入0.5 ml)配置成浓度为20%的溶液。宫颈及宫颈管内应用药液浸湿制备的薄棉片覆盖,用外套避孕套的无菌纱卷塞入阴道封包,持续敷药时间不少于3 h,进行ALA治疗。先在患者宫颈外口出使用点光照射30 min,剂量为100J/cm2,再将柱状光纤插入宫颈口进行10 min的照射,剂量为80J/cm2。每周治疗1次,连续3次。
3 观察指标 所有患者均建立详细的研究档案,通过来院治疗、门诊复查、电话等方式随访至治疗结束后3个月,记录HR-HPV检测结果,包括宫颈HPV转阴率、HPV负荷量。检测方法:检测试剂和仪器均购自于美国Digene公司,分别于治疗前、治疗后3个月时采用专用HPV取样器,轻缓插入子宫颈外口,同一方向旋转5圈后轻缓取出取样器,放入有保存液的小瓶中,由专业人员严格按照HC-II HPV DNA检测试剂盒说明书检测,检测样本的HPV DNA含量即HPV负荷量。根据检测样本相对发光单位(RLU)/标准阳性对照(CO)的比值判断阳性(≥1.0)和阴性(<1.0),比值越高,表示检测样本中HPV DNA负荷量越高。
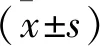
结 果
1 两组患者宫颈HPV转阴效果 两组均成功完成治疗,且治疗后随访3个月无失访、中途退出病例。ALA-PDT组治疗后3个月HPV转阴率为62.79%(27/43),明显高于重组人干扰素组34.88%(15/43),差异有统计学意义(P<0.05)。见表2。

表2两组HR-HPV宫颈持续感染患者治疗后3个月HPV转阴效果比较
2 两组患者HPV DNA负荷量变化比较 重组人干扰素组、ALA-PDT组治疗前宫颈HPV DNA负荷量平均负荷为596.27、603.51,治疗后3个月分别下降至238.17、159.60。ALA-PDT组治疗后3个月宫颈HPV DNA负荷量下降幅度≥90%和≥50%的比重均高于重组人干扰素组,差异有统计学意义(P<0.05);两组宫颈宫颈HPV DNA负荷量下降幅度0~50%和上升比重比较差异均无统计学意义(P>0.05)。见表3。
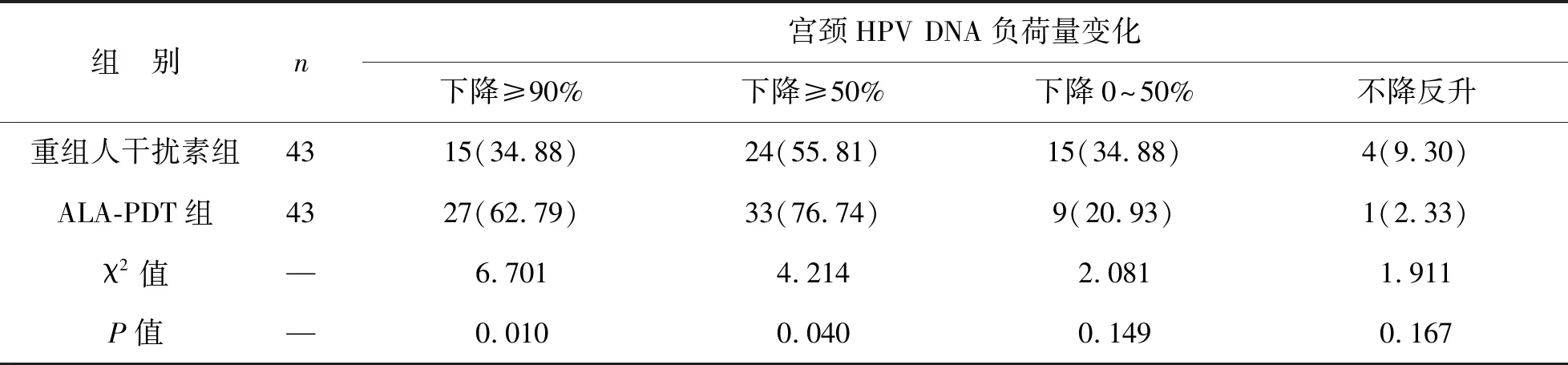
表3两组HR-HPV宫颈持续感染患者治疗后3个月HPV DNA负荷量变化比较[例(%)]
3 两组患者治疗安全性评价 重组人干扰素组用药平稳,未出现明显不适症状。ALA-PDT组治疗期间未出现严重不适症状,仅有6例患者主诉光照过程中阴道有轻微灼热不适感,但可耐受,不影响治疗。治疗随访期间有3例主诉阴道分泌物增多,但在5~7 d内逐渐好转。
讨 论
宫颈癌作为最常见的妇科恶性肿瘤,原位癌高发年龄30~35岁,浸润癌为45~55岁,具有发病率高、易进展、病死率高等特点。尽管近十几年来随着宫颈细胞学筛查的推广应用和女性对妇科疾病的防治意识有一定提高,但宫颈癌的发病率尤其是发展中国家仍处于较高水平,其预后生存情况仍比较严峻,造成严重的社会疾病负担[6]。据报道显示[7],宫颈癌发病率和病死率在全球范围内居女性恶性肿瘤的第4位,其中发展中国家占宫颈癌死亡人数的90%左右,我国作为人口基数庞大的发展中国家,宫颈癌发病例数占亚洲国家宫颈癌总例数的22%左右。
随着分子生物学、流行病学的深入发展,国际上公认HPV感染是CIN、宫颈癌发病和进展的重要原因[8]。虽然大多数HPV感染在潜伏期内(2年内)在自身机体免疫系统作用下可逐渐清除病毒,但持续性的HPV感染也不少见,对于宫颈HPV感染持续时间超过1年的高危患者需引起高度重视,及时积极治疗促进HPV转阴、减少HPV DNA负荷量是预防CIN发生进展和宫颈癌发生的关键[9]。HPV作为一种封闭的双链环状DNA病毒,DNA有8个开放阅读框架(ORF),其中E1~E7在感染初期表达,L1~L2在感染后期表达。E1、E2虽然没有参与HPV的复制过程,但和其DNA复制有紧密关系。E6、E7作为癌基因蛋白类,当E1、E2减少时,会刺激E6、E7在宿主DNA内表达,E6、E7的表达迅速升高会抑制抑癌基因p53、PRb的表达,显著增加癌变风险[10]。干扰素具有抗肿瘤、抗病毒和调节免疫等多种生物学作用,能抑制E6、E7基因表达和促进宫颈癌Caski细胞凋亡,因此常用于治疗HPV感染,但临床实践表明,干扰素也存在HPV转阴率偏低、用药时间长等不足[11]。
ALA-PDT是一种在激光、光敏剂和氧的相互作用下治疗皮肤黏膜肿瘤或癌前病变的新型治疗手段,其中ALA作为第二代光敏剂,和第一代光敏剂相比,克服了组织选择性差、光动力损伤稳定性差、体内滞留时间长等缺陷,具有毒性低、代谢快和疗效好的优点,可参与体内血红素的生物合成,在ALA脱水酶等作用下生成原卟啉IX。原卟啉IX作为血红素的前体物质,具有强光敏作用。光照部位均匀涂抹ALA后,能被HPV感染的活跃细胞选择性吸收,在激光辐射下产生光动力学反应,生成具有杀伤细胞作用的单态氧,起到促进HPV感染细胞死亡、促进HPV转阴的治疗效果。此外ALA具有很强的特异性,原因在于ALA只能被光照部位的皮肤、黏膜吸收,不仅确保ALA-PDT治疗的效果,而且毒性作用较低。
本研究中两组高危型HPV宫颈持续感染患者治疗后3个月HC-II检测显示:ALA-PDT组有62.79%患者HPV转阴,宫颈HPV DNA负荷量也下降至159.60,下降幅度≥50%者达76.74%,而重组人干扰素组HPV转阴率仅为34.88%,HPV DAN负荷量降至为238.17,下降幅度≥50%者为55.81%。可以看出,ALA-PDT疗法对促进高危型HPV宫颈持续感染转阴、降低HPV DAN负荷量效果更优,和文献报道结论相吻合。此外ALA-PDT组治疗观察期间未出现严重不良反应,仅有少量轻度阴道灼热不适感和分泌物增多,但均可耐受且自行好转,安全性较好。
本研究也有些许不足,比如研究例数偏少,ALA-PDT
用药次数少以及随访观察时间偏短,对远期转阴率以及降低癌变率等缺乏大量本数据比较,需要在日后实践中摸索ALA-PDT的更好的用药方式。但总的来说,ALA-PDT疗法具有疗效显著、安全性好、无创、操作简单等优点,是及时阻断高危型HPV宫颈持续感染的有效方法,对降低此类患者癌变率、改善预后生活质量具有重要意义。
