低氧暴露所致大鼠骨骼肌萎缩的蛋白转化调节机制
2019-09-03付鹏宇胡扬李燕春于加倍朱镕鑫贾杰龚丽景
付鹏宇,胡扬,李燕春,于加倍,朱镕鑫,3,贾杰,龚丽景*
(1. 北京体育大学运动人体科学学院,北京 100084; 2. 北京体育大学中国运动与健康研究院,北京 100084;3. 上海体育科学研究所,上海 200030)
高原是指海拔超过2400 m的环境[1]。急进高原会给机体的生理和代谢系统带来多种不利影响,骨骼肌萎缩就是其中之一[2]。高原低氧暴露可造成运动员肌肉力量和耐力丢失,影响高原训练效果。低氧所致的肌萎缩还表现出快慢肌的差异,不同类型的骨骼肌可能对低氧刺激产生不同的应答,从而影响运动员相应运动素质的发挥;随着高原旅游的兴起,世居平原者进入高原可能会发生的肌肉丢失和肌力下降,从而影响其体力活动和健康状态[3]。低氧下机体组织器官会发生功能改变或释放出各种调节因子以直接和/或间接调控骨骼肌质量。低氧环境下食欲和消化吸收能力会受到抑制,使能量摄入不足,导致机体处于负能量平衡状态,诱发骨骼肌蛋白代谢失衡,影响肌肉质量的维持[4]。相反观点认为低氧诱导的肌萎缩与摄食行为无关,营养良好情况下的低氧暴露仍会使肌肉质量无法维持,可能与低氧特异性因素对骨骼肌蛋白转化(蛋白合成和分解间的动态平衡)的改变有关[5]。
低氧下骨骼肌蛋白的转化过程由多基因协同发挥作用[6]。其中低氧诱导因子1α(hypoxia-inducible factor 1α,HIF1α)是关键的低氧调节因子,参与调控低氧应激下蛋白质代谢;丝氨酸/苏氨酸激酶(RAC-alpha serine/threonine-protein kinase,Akt),又称作蛋白激酶B(protein kinase B,PKB/Akt),是蛋白合成和分解的中枢因子,磷酸化后有活性[7];哺乳动物雷帕霉素靶向基因(mammalian target of rapamycin,mTOR)可整合细胞外多种信号刺激,影响基因转录及蛋白质合成[8]。其下游的真核翻译起始因子4E结合蛋白1(eukaryotic translation initiation factor 4E (eIF4E)-binding protein 1,4EBP1)和核糖体蛋白S6激酶β-1(ribosomal protein S6 kinase beta-1,P70S6K1/S6K1)参与蛋白合成的调控[9];叉头框蛋白O1(forkhead box O1,FoxO1)是调控蛋白分解两条重要通路的关键基因,包括泛素蛋白酶途径(ubiquitin-proteasome pathway,UPP)和自噬溶酶体途径(autophagy-lysosome pathway,ALP),其中肌萎缩F-box 1(muscle atrophy F-box 1,Fbx32/atrogin1)和肌肉特异性环指蛋白1(muscle-specific ring finger 1,MuRF1)是UPP的重要基因[10];微管相关蛋白3(microtubule associated protein light chain 3,Map1lc3/LC3)和B细胞淋巴瘤-2相互作用蛋白1(B-cell lymphoma-2 interacting protein 1,Beclin1)是ALP的重要基因[11]。
目前,关于低氧暴露所致肌萎缩的发生机制和肌肉类型的选择性尚不清楚,是否与低氧下摄食量减少有关还存在争议。低氧暴露与摄食量不足所致的半饥饿状态下骨骼肌蛋白转化的差异还有待于进一步的探究。因此,本研究中通过低氧暴露和常氧配对低氧摄食干预大鼠后,对比不同类型骨骼肌蛋白转化调节的差异,以探明低氧暴露诱导骨骼肌萎缩发生的可能机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
21只SPF级雄性SD大鼠,8周龄,体重约为230 g,购于北京维通利华实验动物技术有限公司【SCXK(京)2015-0004】。饲养于北京体育大学动物实验室【SYXK(京)2016-0034】。 饲养期间各组大鼠自由饮水,饲喂普通维持饲料由军事医学科学院实验动物中心【SCXK(军)2012-0004】提供。饲养环境:昼夜各半循环照明,湿度恒定,温度控制在22~25℃。所有操作均符合北京体育大学运动科学实验伦理学要求(审批号:IACUC 2017009 A)。
1.1.2 实验试剂
Anti-HIF1α(Novusbio,NB100-479),Anti-pan-Akt(Abcam,ab8805),Anti-pSer473-Akt(Cell Signaling,4060),Anti-mTOR(Abcam,ab2732),Anti-4EBP1(Abcam,ab2606),Anti-p70S6K1(Abcam,ab32529),Anti-FoxO1(Abcam,ab52857),Anti-pSer256-FoxO1(Abcam,ab131339),Anti-atrogin1/Fbx32(Abcam,ab74023),Anti-MuRF1(Abcam,ab172479),Anti-LC3B(Novusbio,NB100-2220),Anti-beclin1(Abcam,ab207612)。
1.1.3 实验仪器
双能X射线骨密度仪(dual energy X-ray absorptiometer,DEXA;Lunar Idxa,美国),天平(Sartorius,美国),正置光学显微镜(尼康,Nikon Eclipse E100,日本),电泳槽和干转转膜系统(Life Technologies,美国),近红外光谱检测系统(LI-COR,美国)。
1.2 方法
1.2.1 动物分组及实验干预
大鼠随机分为3组:①常氧正常饮食组(C组):常氧环境中自由饮食;②低氧正常饮食组(H组):置于氧浓度为12.4%的低氧房中(模拟海拔4000 m高度),自由饮食;③常氧配对饮食组(P组):常氧环境中,控制其摄食量与H组配对(H组前一天的摄食量,即为P组当天的投食量)。每组7只。
1.2.2 形态指标测试及取材
记录各组大鼠的摄食量和体重。4周后, DEXA)扫描大鼠体成分(包括肌肉和脂肪总量);麻醉后取两侧比目鱼肌(soleus,SOL)和趾长伸肌(extensor digitorum longus,EDL),称量湿重。一侧肌肉投入多聚甲醛固定液中固定,另一侧肌肉置于-80℃保存,用于蛋白含量的测试。
1.2.3 HE染色观察肌纤维形态及肌纤维横截面积(muscle fiber cross-sectional area,FCSA)的计算
骨骼肌组织在多聚甲醛中固定24 h后,修剪为约5 mm3的组织块,石蜡包埋切片,HE染色,封片后,10×40倍镜下拍照,用Image J软件分析计算FCSA。
1.2.4 Western Blot(WB)测试骨骼肌蛋白含量
分别提取各肌肉蛋白后,BCA法测定蛋白浓度,调整上样量为20 μg。使用梯度胶电泳分离蛋白,转至NC膜,封闭液封闭1 h,4℃孵育一抗过夜,洗去未结合的一抗,室温孵育二抗1 h,洗去未结合的二抗,近红外光谱检测系统检测条带信号值,Image Studio软件对结果进行相对定量分析。
1.3 统计学分析
2 结果
2.1 大鼠体重变化
大鼠初始体重无明显差异,从第2周时,H组体重较C组均显著下降(P< 0.05),P组与C组差别不大;干预3周、4周时,H组较C组和P组均显著下降(P< 0.05),P组较C组差异无显著性(图1)。
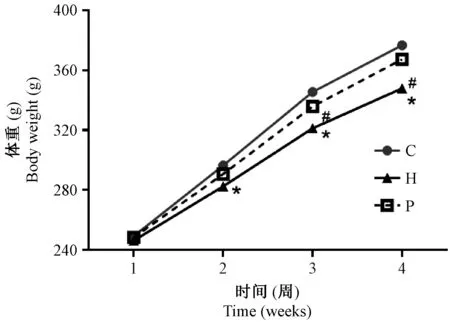
注:干预2,3,4周后,H组体重与C组相比差异具有显著性,*P < 0.05。 干预3,4周后,H组体重与P组相比差异具有显著性,#P < 0.05。图1 体重变化Note. After 2, 3, and 4 weeks of intervention, the difference in body weight between the groups H and C was significant,*P < 0.05. After 3 and 4 weeks of intervention, the difference in body weight between the groups H and P was significant,#P < 0.05.Figure 1 Changes in body weight of the rats
2.2 大鼠摄食量变化
干预期前2周,H组大鼠(P组同)日平均摄食量较C组显著下降(P< 0.05),干预期后2周,H组和C组间差异无显著性(图2)。
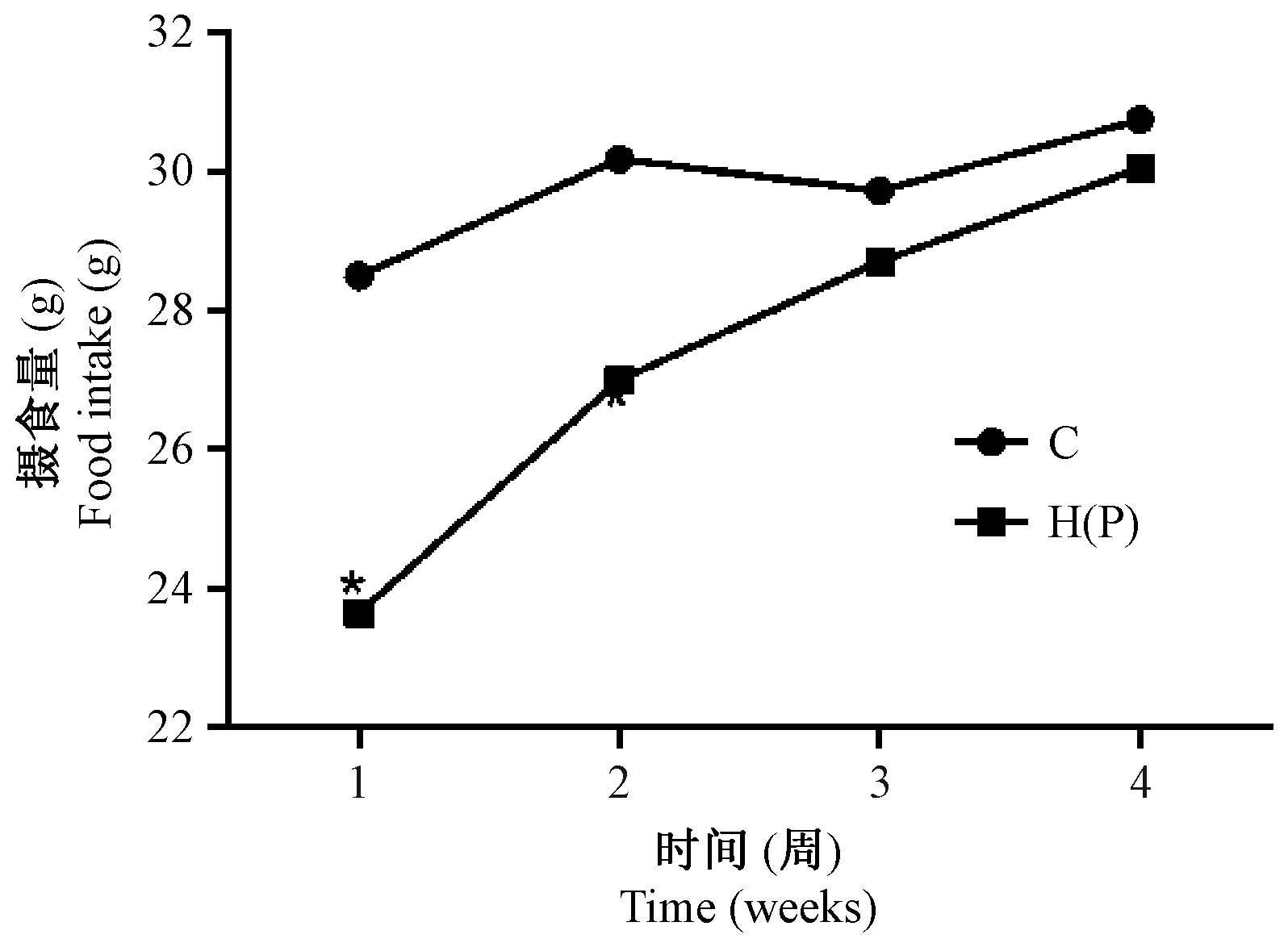
注:干预1,2周时,H组与C组相比具有显著性差异,*P< 0.05。图2 摄食量变化Note. At 1 and 2 weeks of intervention, there was a significant difference between the groups H and C, *P< 0.05.Figure 2 Changes in food intake of the rats
2.3 干预后大鼠体质量、肌肉质量和脂肪质量
4周干预后,H组大鼠体质量和肌肉总量较C组和P组显著性降低(P< 0.05),P组与C组间无差异;各组间脂肪量差异无显著性(图3)。

注:H组与C组相比,*P< 0.05。 H组与P组相比,#P < 0.05。图3 干预后大鼠体重、肌肉质量和脂肪质量的变化Note. Compared between the groups H and C,*P< 0.05. Compared between the groups H and P,#P < 0.05.Figure 3 Changes in body weight, muscle mass and fat mass of the rats after intervention
2.4 干预后大鼠骨骼肌湿重
H组SOL和EDL湿重较C组显著下降(P< 0.05),P组各肌肉湿重与C组接近(图4)。
2.5 干预后大鼠FCSA
各组SOL的FCSA没有显著性差异;H组EDL的FCSA较C组显著下降(P< 0.05),H组EDL的FCSA较P组显著下降(P< 0.05)(图5)。
2.6 干预后大鼠骨骼肌HIF1α蛋白含量
H组大鼠EDL中HIF1α蛋白含量较C组显著增加(P< 0.05),P组与C组间无显著性差异;SOL各组间HIF1α蛋白含量无显著差异(图6)。
2.7 干预后大鼠骨骼肌p-Akt和Akt蛋白含量及两者比值
H组大鼠SOL和EDL中p-Akt蛋白含量较C组显著下降,P组EDL中p-Akt蛋白含量较C组显著下降(P< 0.05)(图7A,B);Akt蛋白含量各组间无显著性差异(图7A,C);H组和P组SOL中p-Akt/Akt显著低于C组(P< 0.05),而EDL中两者比值较C组无明显变化(图7D)。
2.8 干预后大鼠蛋白合成相关基因(mTOR、4EBP1、p70S6K1)蛋白含量
H组大鼠EDL中mTOR蛋白含量较C组显著下降(P< 0.05),P组较C组无显著差异(图8A,B);H组大鼠EDL中4EBP1蛋白含量较C组显著下降(P< 0.05)(图8C,D),两肌肉中各组间p70S6K1蛋白含量无显著差异(图8C,E)。
2.9 干预后大鼠蛋白分解相关基因(FoxO1、p-FoxO1、UPP和ALP基因)蛋白含量
P组SOL中p-FoxO1蛋白含量显著高于C组(P< 0.05)(图9A,B);两肌肉中各组间FoxO1含量无显著差异(图9A,C);两肌肉中各组间p-FoxO1/FoxO1比值间无显著差异(图9D)。
2.9.1 UPP相关基因(atrogin1、MuRF1)蛋白含量
H组大鼠EDL中atrogin1蛋白含量较C组显著上升(P< 0.05),P组与C组间无显著差异(图10A,B);H组两肌肉中MuRF1蛋白含量显著高于C组,P组SOL中MuRF1蛋白含量显著高于C组(P< 0.05)(图10A,C)。

注:A. 各组大鼠SOL和EDL图片。 B. H组与C组相比,*P < 0.05。图4 干预后大鼠骨骼肌湿重Note. A. Images of SOL and EDL muscles of the rats in each group. B. Compared between the groups H and C,*P < 0.05.Figure 4 Wet weight of skeletal muscle in the rats after intervention

注:A. 肌纤维的组织学结构(HE染色,×400, 标尺=50 μm)。 B. H组与C组相比,#P < 0.05;H组与P组相比,#P < 0.05。图5 肌纤维形态与FCSANote. A. Histological structure of muscle fibers (×400, HE staining. Bar=50 μm). B. Compared between the groups H and C,*P < 0.05. Compared between the groups H and P,#P < 0.05.Figure 5 Muscle fiber morphology and muscle fiber cross-sectional area of the rats
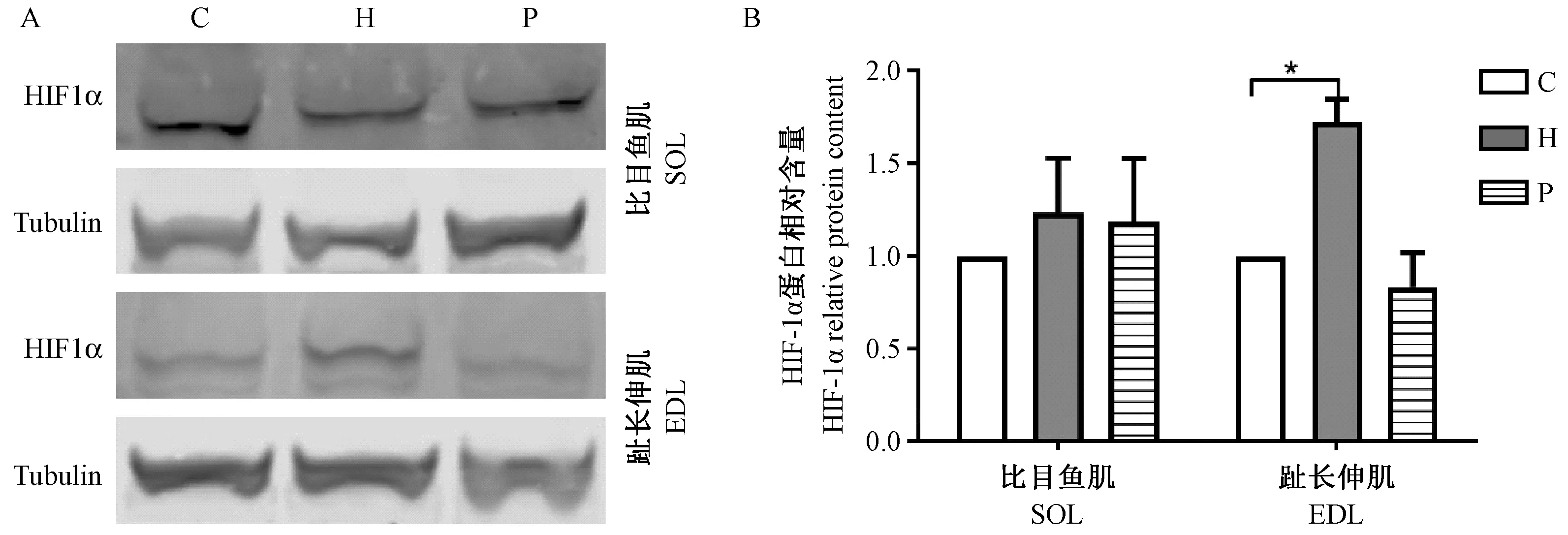
注:A. HIF1α的WB结果。B. H组与C组相比,*P< 0.05。图6 HIF1α蛋白条带(A)和相对含量(B)Note. A. Western Blot of HIF1α. B. Compared between the groups H and C,*P< 0.05.Figure 6 HIF1α protein bands (A) and relative content (B) of skeletal muscles of the rats

注:A. p-Akt和Akt的WB结果。 B&C&D. H组与C组相比,*P< 0.05。图7 p-Akt和Akt蛋白条带(A)和相对含量(B&C)以及两者比值(D)Note. A. Western Blot results of p-Akt. B, C and D. Compared between the groups H and C,*P< 0.05.Figure 7 Protein bands (A), relative content (B, C) and p-Akt/Akt (D) ratio of the rat skeletal muscles

注:A&C. mTOR、4EBP1和p70SK61的WB结果。 B&D&E. H组与C组相比,*P< 0.05。图8 mTOR、4EBP1和p70SK61蛋白条带(A&C)和相对含量(B&D&E)Note. A&C. Western Blot. Protein bands of mTOR, 4EBP1 and p70SK61. B, D and E. Compared between the groups H and C,*P< 0.05.Figure 8 Protein bands (A&C) and relative content of mTOR, 4EBP1 and p70SK61 (B&D&E) in skeletal muscles of the rats
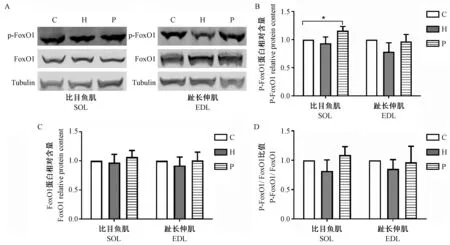
注:A. p-FoxO1和FoxO1的WB结果。 B&C&D. H组与C组相比,*P< 0.05。图9 p-FoxO1和FoxO1蛋白条带(A)和相对含量(B&C)及两者比值(D)Note. A. Western Blot analysis of p-FoxO1 and FoxO1. B, C and D. Compared between the groups H and C,*P< 0.05.Figure 9 Protein bands (A), relative contents (B, C) and p-FoxO1/FoxO1 ratio (D) in skeletal muscles of the rats
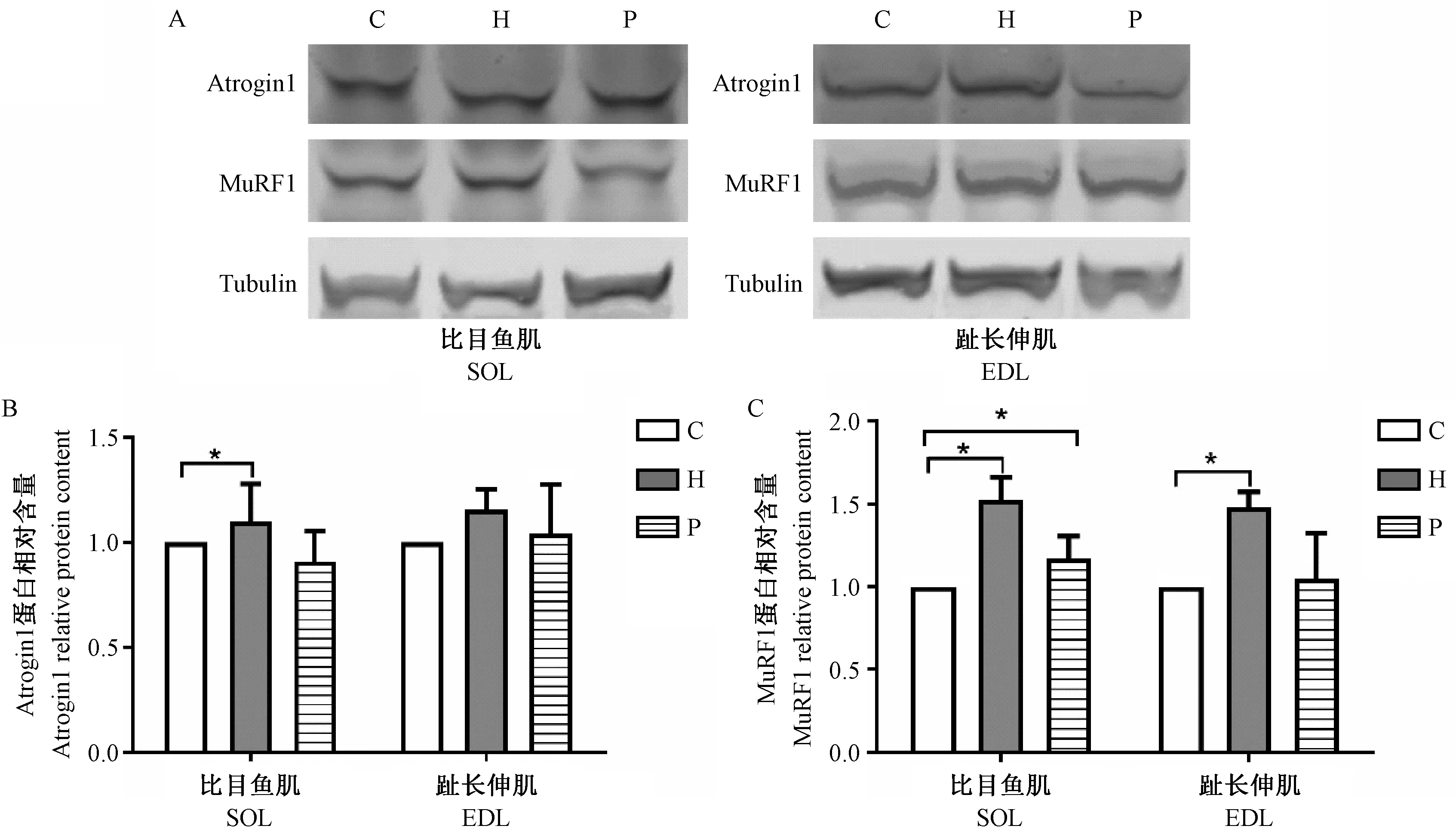
注:A. atrogin1和MuRF1的WB结果;B&C. H组与C组相比,*P<0.05。图10 atrogin1和MuRF1蛋白条带(A)和相对含量(B&C)Note. A. Western Blot results of atrogin1 and MuRF1. B, C. Compared between the groups H and C,*P< 0.05.Figure 10 Protein bands (A) and relative content of atrogin 1and MuRF1(B, C) of the rat skeletal muscles
2.9.2 ALP相关基因(LC3、beclin1)蛋白含量
H组大鼠EDL中LC3Ⅱ蛋白含量较C组显著上升(P< 0.05)(图11A,B);H组SOL中LC3Ⅰ蛋白含量较C组显著上升(P< 0.05)(图11A,C);H组EDL中LC3Ⅱ/Ⅰ比值较C组显著上升(P< 0.05),P组与C组间无显著差异(图11D);H组EDL中beclin1蛋白含量较C组显著上升(P< 0.05),P组与C组间无显著差异(图11A,E)。

注:A. LC3和beclin1的WB结果。B&C&D&E. H组与C组相比,*P< 0.05。图11 LC3和beclin1蛋白条带(A)和相对含量(B&C&D&E)Note. A. Western Blot results of LC3 and beclin1. B, C. Compared between the groups H and C,*P< 0.05.Figure 11 Protein bands (A), relative content and ratio of LC3 and beclin 1in skeletal muscles of the rats (B, C, D and E)
3 讨论
世居平原者初上高原时常会出现骨骼肌质量的丢失。本研究,发现大鼠暴露在模拟海拔4000 m的低氧环境中,体重、肌肉总量、肌肉湿重和FCSA均出现下降,证明低氧暴露确可诱导肌萎缩的发生。
3.1 低氧暴露下摄食量变化对骨骼肌质量的调节作用
本研究观察到大鼠摄食量在低氧暴露初期下降、后期恢复正常;P组体重随着干预时间延长逐渐接近C组,其肌肉质量、湿重和FCSA与C组均差异不大,提示低氧所致肌萎缩可能并非因摄食量减少引起。低氧暴露初期体重和摄食量下降,可能原因是下丘脑、胃肠及脂肪组织中的胃促生长素(ghrelin)、多肽YY激素(peptide YY,PYY)、胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)和瘦素(Leptin)等食欲调节激素的水平在低氧下发生改变[12],但随时间延长,机体肠道通透性和葡萄糖摄取量不再发生改变,机体主观食欲和摄食量逐渐回升,体重和肌肉质量恢复至常氧水平[13]。
3.2 低氧暴露和半饥饿状态下骨骼肌蛋白转化调节的变化
低氧暴露下骨骼肌蛋白转化效率提高是诱导肌萎缩发生的关键,表现为蛋白合成速率低于分解速率。HIF1α是转录调控的关键因子,参与低氧适应性反应过程,在骨骼肌蛋白的转化调节中发挥重要作用[14]。本研究H组EDL中HIF1α含量显著增加,而P组较C组则无明显变化。HIF1α的稳定表达是其在低氧环境中发挥生理效应的关键。HIF1α的靶基因碳酸酐酶9(carbonic anhydrase IX,Ca-9)仅在持续低氧暴露(21 d)后显著增加,而常氧控食则不会诱导Ca-9的表达增加[15]。Akt是蛋白合成和分解的中枢调节因子。本研究中P组p-Akt/Akt比值较C组无明显变化。Akt被磷酸化激活后,可进一步激活mTOR及下游mTOR复合物1/2(mTOR complex 1/2,mTORC1/2),抑制结节性硬化复合物1和2(tuberous sclerosis complex 1/2,TSC1/2)表达以促进蛋白质合成;p-Akt还可通过促进FoxO1蛋白磷酸化而抑制蛋白质分解。HIF1α可抑制Akt的表达,急性低氧可降低Akt磷酸化水平,持续低氧会增加Akt总量,导致p-Akt/Akt下降[16]。
3.2.1 蛋白合成相关基因的变化
mTOR可调节下游4EBP1和p70SK61促进骨骼肌蛋白质合成。4EBP1激活后,与eIF4E分离;p70SK61在磷酸肌醇激酶1催化下活化,两者共同促进mRNA的翻译[16]。本研究H组EDL中mTOR、4EBP1含量较C组显著下降,P组相关蛋白水平无明显变化。低氧可通过AMP依赖蛋白激酶(Adenosine 5′-monophosphate (AMP)-activated protein kinase,AMPK)进一步激活TSC2,阻碍mTOR及其下游4EBP1和p70S6K1的表达,抑制骨骼肌蛋白合成。有研究显示,mTOR通路相关基因在低氧暴露4 d并未发生显著变化,21 d后显著降低,而半饥饿干预初期和末期,机体mTOR通路均未发生显著变化[5]。
3.2.2 蛋白分解相关基因的变化
FoxO1作为调节骨骼肌质量的关键转录因子,可介导UPP和ALP以促进骨骼肌蛋白分解。它受p-Akt调节,p-FoxO1出核失活[17]。本研究P组p-FoxO1/FoxO1比值较C组无显著差异。低氧通过抑制Akt活性而减少p-FoxO1,间接促进蛋白分解相关基因表达;同时直接增加FoxO1的表达,促进骨骼肌萎缩发生。E3泛素连接酶atrogin1和MuRF1—骨骼肌蛋白分解途径中重要的限速酶,其表达的增加可作为UPP激活的标志,受FoxO1调控;LC3和beclin1表达增加是溶酶体蛋白被激活的标志。其中LC3是自噬体形成阶段的标志,经剪切修饰变成胞质蛋白LC3-I,LC3-Ⅰ与磷脂酰乙醇胺(phosphatidyl ethanolamines,PE)共价结合形成LC3-Ⅱ,有助于自噬体双层膜闭合,LC3-II/I常作为衡量自噬通量的关键指标;beclin1是自噬执行者,调控自噬前体形成,引导部分自噬相关蛋白定位于自噬体膜。两者表达受FoxO1正调控。本研究H组EDL中atrogin1、MuRF1、beclin1蛋白含量及LC3Ⅱ/Ⅰ比值显著高于C组,而P组与C组间无显著差异,这与其他研究类似。低氧不仅可通过调节FoxO1以促进下游UPP和ALP相关蛋白表达,也可直接作用于分解蛋白,如beclin1的启动子包含一个功能性低氧反应元件(hypoxia response element,HRE),可在低氧状态下直接促进蛋白分解[18]。
3.3 低氧暴露诱导骨骼肌萎缩的肌肉类型差异
低氧所致肌萎缩常伴有肌肉类型差异。本研究中H组SOL和EDL湿重均出现显著下降,但SOL的FCSA较C组未出现减少,提示低氧所致骨骼肌萎缩可能选择性发生于快肌。不同类型骨骼肌可通过不同的途径参与对慢性低氧暴露的适应性改变。EDL对低氧的反应主要表现在UPP和ALP相关基因的表达增加,而SOL则对低氧特异性因素的反应较小,对摄食量减少较为敏感。本研究低氧下EDL中HIF1α、4EBP1、atrogin1、beclin1水平和LC3Ⅱ/Ⅰ比值显著增加,而这些基因在SOL中则没有显著变化。研究认为,atrogin1的表达增加可能是快肌对皮质酮和糖皮质激素受体信号的敏感性增加的结果,E3泛素连接酶表达的增加可能更多的依赖于低氧刺激,而非摄食量的变化;HIF1α靶基因beclin 1是bcl-2家族中的低氧诱导成员,低氧诱导的EDL中beclin1的增加独立于摄食量的影响[19]。
